



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第三章第三章 电解质溶液电解质溶液Chapter 3 Electrolyte Solution 第三节第三节 酸碱溶液酸碱溶液pH 值的计算值的计算Calculation for pH 一、 酸碱溶液酸碱溶液pH计算计算 的一般方法(略)的一般方法(略) )HAc()Ac( )H()HAc( (aq)Ac(aq)OH O(l)HHAc(aq)a32ccccccK离子化分子化 二二、一元弱酸或弱碱溶液一元弱酸或弱碱溶液 monoprotic weak acids and base solution ) (1) 一元弱酸的电离平衡一元弱酸的电离平衡The ionization equilibriu
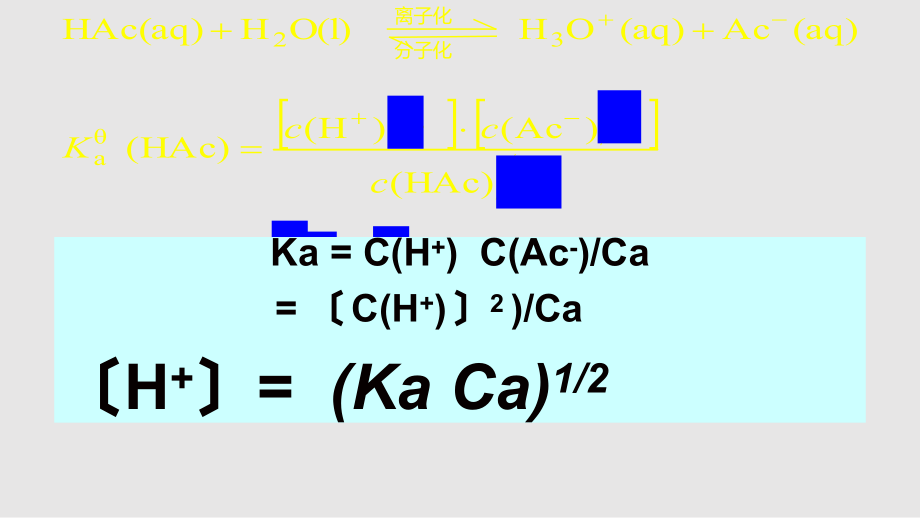
2、m of monoprotic weak acids )HAc()Ac( )H()HAc( (aq)Ac(aq)OH O(l)HHAc(aq)a32ccccccK离子化分子化Ka = C(H+) C(Ac-)/Ca = C(H+) 2 )/CaH+= (Ka Ca)1/2 稀释定律稀释定律:在一定温度下( Ka 为定值 ),某弱电解质的电离度随着其溶液的稀释而增大. HA(aq) H+(aq) + A(aq) 初始浓度 c 0 0 平衡浓度 c cc ccKKcKcKcKcccc 11 %5 500 1 aa2aa2a时,当 稀释定律)500( )OH(bbKcKcc同理对同理对一元弱碱:一元
3、弱碱:(2)(2)一元弱碱的电离平衡一元弱碱的电离平衡The ionization equilibrium of monoprotic weak basesKb = C(OH-) C(HAc)/Cb = C(OH-) 2 )/CbOH-= (Kb Cb)1/2 已知25时, 0.200molL- -1氨水的电离度为 0.934%,求c(OH), pH值和氨的离解常数.Example Example 6 6initial 0.200 0 0equilibrium 0.200(1 0.934%) 0.2000.934% 0.2000.934%5323343b331076.1 1087.1200.0
4、)1087.1( )NH()OH()NH()NH( 27.11)1087.1lg(14pOH14pH1087.1%934.0200.0)OH(cccKcOH NH OH NH423Solution共轭酸碱对解离常数的关系:共轭酸碱对解离常数的关系:The relationship for the conjugate acid-base pair and dissociation constant 酸的酸性越强,其共轭碱的碱性就越弱,反之亦然。wbawbapppKKKKKKH2S H+ + HSHS H+ + S2 H2O H+ + OH7a,1100.1K15a,2101.7K14w100.1
5、K多元弱酸溶液的离解平衡多元弱酸溶液的离解平衡 polyprotic weak acids aqueous solution dissociation equilibrium结 论 多元弱酸的离解是分步进行的,多元弱酸的离解是分步进行的,一般溶液中的一般溶液中的 H H+ +主要来自于弱酸的第一步离解,计主要来自于弱酸的第一步离解,计算算 c c(H(H+ +) )或或 pH pH 时可只考虑第一步离解。时可只考虑第一步离解。KaKa1 1 X K X Kb3b3 = = KwKw 其它条件的计算处理自己选学。其它条件的计算处理自己选学。 321 KKK(1) 强酸和弱碱生成的盐的水解强酸和弱
6、碱生成的盐的水解 (3) HOHNH OH NH 1 (2) OHNH OH NH (1) H OH OH Cl NH ClNHa2324b234w244KKK盐溶液盐溶液(Properties of salts)12314a,1wb,3432427814a,2wb,24222421314a,3wb,124234105.1107.6100.1 OHPOH OHPOH106.1102.6100.1 OHPOH OHHPO102.2105.4100.1 OHHPO OHPOKKKKKKKKK(2) 多元弱酸和强碱生成的盐的水解多元弱酸和强碱生成的盐的水解 a,2a,2a,143 POHKKK对于b
7、,3b,2b,134 PO KKK对于(3) 酸式盐酸式盐1231443a,1w34b,343242843a,22442105.1107.6100.1)POH()(PO OHPOH OHPOH102.6)POH( HHPO POHKKKK解离大于水解, NaH2PO4溶液显弱酸性解离小于水解, Na2HPO4溶液显弱碱性 概括总结:概括总结:s 适用范围:一元的弱酸、多元弱适用范围:一元的弱酸、多元弱酸及强酸弱碱盐。酸及强酸弱碱盐。Ka = C(H+) C(Ac-)/Ca = C(H+) 2 )/CaH+= (Ka Ca)1/2)500( )OH(bbKcKccKb = C(OH-) C(HA
8、c)/Cb = C(OH-) 2 )/CbOH-= (Kb Cb)1/2b 适用范围:一元的弱碱、多元弱适用范围:一元的弱碱、多元弱碱及强碱弱酸盐。碱及强碱弱酸盐。相关知识的应用相关知识的应用一元的弱碱、多元弱碱及强碱弱酸盐:一元的弱碱、多元弱碱及强碱弱酸盐:NH3H2O、Na3PO4、NaAc.共轭酸碱对解离常数的关系:共轭酸碱对解离常数的关系:wbawbapppKKKKKK一元的弱酸、多元弱酸及强酸弱碱盐:一元的弱酸、多元弱酸及强酸弱碱盐:HAc 、H3PO4、NH4Cl.Ka1 X Kb3 = Kw Ka3 X Kb1 = Kw 弱酸和弱碱生成的盐的水解弱酸和弱碱生成的盐的水解HAcOH
9、NH OHAcNHAcNHAcNH232444 108.5 (HCN) CNNH 108.1 O)H(NH 108.1(HAc) AcNH 109.6 (HF) FNH 10a4ba523b5a4ba4a4baKKKKKKKKKK碱性中性酸性H+= (Ka Ka)1/2 pH = 1/2 (pKa+ pKa)四四、 两性物质:两性物质:amphotericityNaHCO3 NaH2PO4H+= (Ka1 Ka2)1/2 pH = 1/2 (pKa1+ pKa2)Na2HPO4 pH = 1/2 (pKa2+ pKa3) At 25, 0.10molL- -1mmomiac(OH), calc
10、ulate pH of the solution. Calculate 0.10molL-1、NaHCO3Na2CO3、HAc 、NaAc、NH4ClH3PO4。 )HAc()Ac( )H()HAc( (aq)Ac(aq)OH O(l)HHAc(aq)a32ccccccK离子化分子化 二二、一元弱酸或弱碱溶液一元弱酸或弱碱溶液 monoprotic weak acids and base solution ) (1) 一元弱酸的电离平衡一元弱酸的电离平衡The ionization equilibrium of monoprotic weak acids 已知25时, 0.200molL- -
11、1氨水的电离度为 0.934%,求c(OH), pH值和氨的离解常数.Example Example 6 6H2S H+ + HSHS H+ + S2 H2O H+ + OH7a,1100.1K15a,2101.7K14w100.1K多元弱酸溶液的离解平衡多元弱酸溶液的离解平衡 polyprotic weak acids aqueous solution dissociation equilibrium结 论 多元弱酸的离解是分步进行的,多元弱酸的离解是分步进行的,一般溶液中的一般溶液中的 H H+ +主要来自于弱酸的第一步离解,计主要来自于弱酸的第一步离解,计算算 c c(H(H+ +) )或或 pH pH 时可只考虑第一步离解。时可只考虑第一步离解。KaKa1 1 X K X Kb3b3 = = KwKw 其它条件的计算处理自己选学。其它条件的计算处理自己选学。 321 KKK弱酸和弱碱生成的盐的水解弱酸和弱碱生成的盐的水解HAcOHNH OHAcNHAcNHAcNH232444 108.5 (HCN) CNNH 108.1 O)H(NH 108.1(HAc) AcNH 109.6 (HF) FNH 10a4ba523b5a4ba4a4baKKKKKKKKK
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 二零二五年度广告发布合同关于乙方开具发票的补充协议
- 内蒙古赤峰市2025届高三下学期二模化学试题 答案
- 二零二五年度校企合作学生实习实训基地实习指导与评价协议
- 二零二五年度房地产开发工程款代付合作协议
- 二零二五年度事业单位劳动合同(事业单位实习实训生)
- 2024年证券从业资格考试必知要点试题及答案
- 解析CPSM考试知识体系试题及答案
- 2024年消防设施应急预案试题及答案
- 快速查找:2024年图书管理员考试试题及答案
- 证券的资产配置策略试题及答案
- 化工过程的在线监测与控制
- 粮油烘干培训课件
- 切格瓦拉完整
- 行政法(中国政法大学版)
- 2020网络与信息安全管理员职业技能标准(职业编码:4-04-04-02)
- DC-DC反激变压器计算
- DL/T 5182-2021 火力发电厂仪表与控制就地设备安装、管路、电缆设计规程
- 人民医院能源托管服务项目可研技术方案书
- 刘德武老师轴对称图形课件
- 改革开放以来我国事业单位改革的历史回顾
- 沪科版八年级数学下册第十七章《一元二次方程》单元测试及答案

评论
0/150
提交评论