



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
第五章氧化还原滴定法
5.1氧化还原反应的方向和程度
5.1.1条件电位1
氧化还原反应—电子的转移
Ox1+Red2=Red1+Ox2由电对电位的高低判断反应的方向可逆电对Ox+ne=Red的电位为2(标准电位)与温度t有关25℃时:Nernst方程式氧化还原滴定通常在室温进行,不考虑温度影响电位与分析浓度的关系为:3表示c(Ox)=c(Red)=1mol·L-1时电对的电位,与介质条件(I,)有关,也与温度t
有关.
可查附录表III·8a(Ox)=c(Ox)·(Ox)/Ox
a(Red)=c(Red)·(Red)/Red
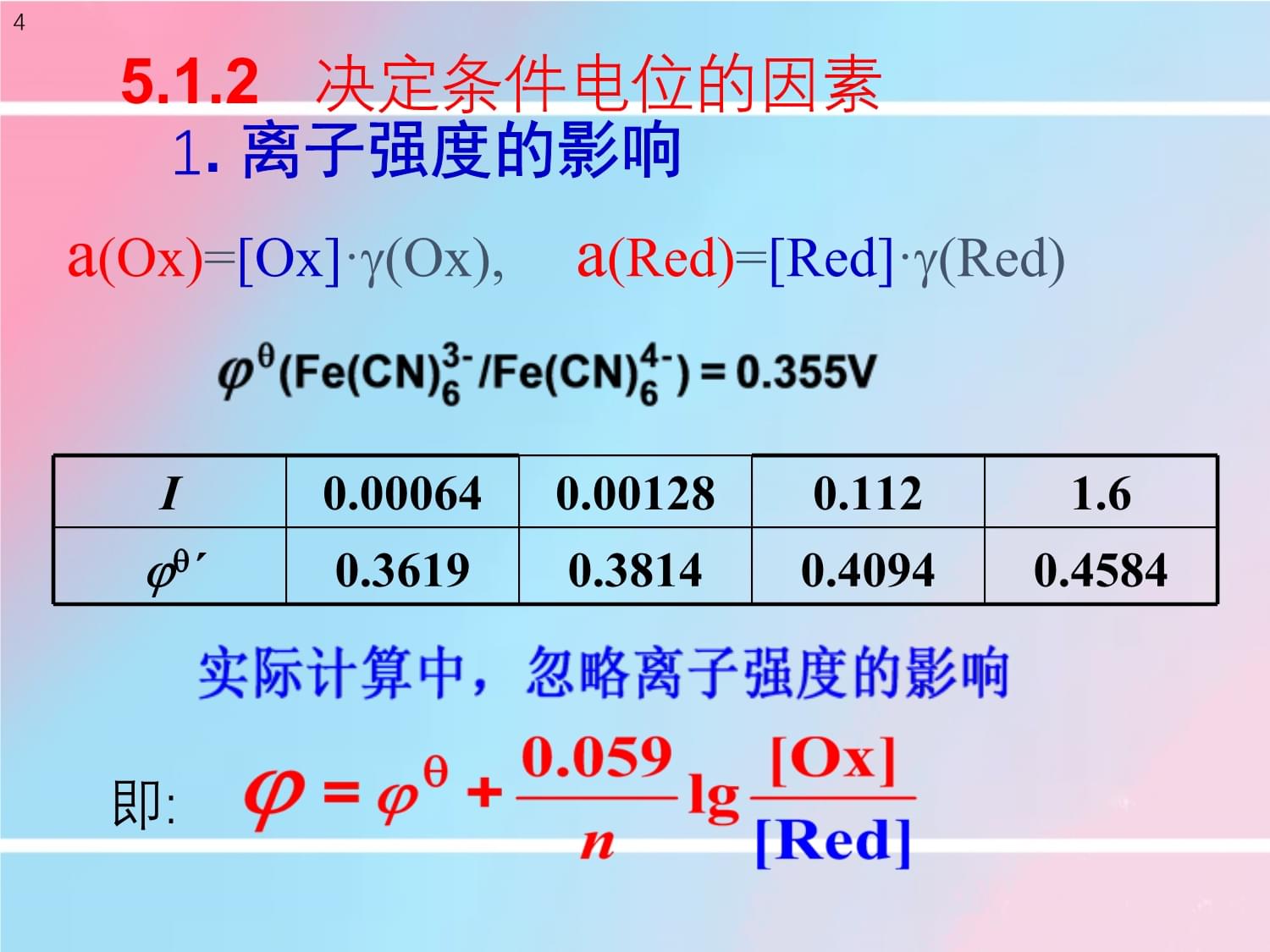
称条件电位5.1.2决定条件电位的因素
1.离子强度的影响4I0.000640.001280.1121.6
´0.36190.38140.40940.4584
即:a(Ox)=[Ox]·(Ox),a(Red)=[Red]·(Red)2.生成沉淀的影响
(改变浓度比值)Ox
,
,还原性;Red,
,氧化性.5例如,碘量法测铜S2O32-3.生成络合物的影响6特例:邻二氮菲(ph),lgb(Fe(ph)33+)=14.1 lgb(Fe(ph)32+)=21.3
Fe3+/Fe2+的条件电位
(Fe3+/Fe2+)=0.77V氧化态形成的络合物更稳定,结果是电位降低0.320.440.680.700.75HFH3PO4H2SO4HClHClO4介质(1mol/L)与Fe3+的络合作用增强例5.2
碘量法测Cu2+时,样品中含Fe3+.7pH=3.0,[F]=0.1mol·L-1时,已知:Fe3+不再氧化I-,Fe3+的干扰被消除。4.溶液酸度的影响[H+]或[OH-]参加电极反应,包括在Nernst方程中,直接影响电位值.82.影响Ox或Red的存在形式例
H3AsO4+2H++2e=HAsO2+2H2O(As(V)/As(III))与pH的关系9酸度影响反应方向pH8-9时,
I3-可定量氧化As(III)4mol/LHCl介质中,As(V)可定量氧化I-
I3--0.6-0.4-0.200.20.40.60.8024681012(2.2)(7.0)(11.5)H2AsO4-H3AsO4(9.2)HAsO42-AsO43-AsO2-HAsO2/VpHI3-I-0.3I3-I-H3AsO4+2H++3I-HAsO2+I3-+2H2O[H+]=4mol·L-1pH=8生物化学家称在pH7时的为条件电位。
因为在一个细胞内pH接近于7。例:
反应
O2+4H++4e=2H2O+1.229
+0.816O2(g)+2H++2e=H2O2
+0.69
+0.295脱氢抗坏血酸+2H++2e=抗坏血酸+0.390
+0.058富马酸盐+2H++2e=丁二酸盐+0.433
+0.03110每当H+在氧化还原反应中出现时,电位都与pH有关.[例5.4]巴黎绿(含砷杀虫剂)的主要
成分(Cu2+、As(III))的测定
3CuO·3As2O3·Cu(C2H3O2)2醋酸亚砷酸铜11Cu2+As(III)Cu(P2O7)26-As(III)Cu(P2O7)26-As(V)
I-pH4KII2+CuI↓测Cu无蓝蓝粉白P2O74-pH8测As(III)S2O32-
I2淀粉可以利用各种因素改变,提高测定的选择性5.1.3氧化还原反应进行的程度12p2Ox1+p1Red2=p2Red1+p1Ox2
氧化还原反应的条件常数K’氧化还原平衡常数计算式推导见13p为电子转移数n1、n2的最小公倍数,当n1=n2时:p=n1=
n2,
反应方程式中p1=p2=1
表示反应完全度对于滴定反应,欲使反应的完全度≥99.9%,两电对的条件电位应相差多少?14(1)n1=n2=115(2)n1=1,n2=2(3)n1=n2=2△>0.4V反应就能定量进行5.2氧化还原反应的速率5.2.1浓度的影响
c增加,反应速率增大(质量作用定律)
5.2.2温度的影响
温度每增高10℃,反应速率增大2-3倍.例:KMnO4滴定H2C2O4,需加热至70-80℃.16
加入少量KI,可加快反应速度
175.2.3催化剂与反应速率:1.44V,0.56V
K=1030
慢快As(III)As(IV)As(V)例1.Ce4+氧化As(III)的反应分两步:2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O开始时反应慢,随着Mn(II)的产生,反应越来越快.自动催化反应:由于生成物本身引起催化作用的反应。例2.5.2.4诱导反应防止溶液:MnSO4-H3PO4-H2SO418诱导反应:KMnO4Fe2+
Fe3++Mn2+受诱反应:KMnO4+2Cl-Cl2+Mn2+H+H+诱导体作用体受诱体Mn(II)–催化,促使中间体成为Mn(III);H3PO4与Mn(III)络合,降低(Mn(III)/Mn(II))提高反应的酸度K2Cr2O7+Sn2+Cr3++Sn4+
诱导O2+Sn2+Sn4+
>90%∴不可用K2Cr2O7直接滴定Sn2+
(KMnO4/Mn2+)=1.51(Cl2/Cl-)=1.355.3氧化还原滴定
5.3.1氧化还原滴定中的指示剂
自身指示剂:KMnO4
2×10-6mol·L-1即可见粉红色2.特殊指示剂例:淀粉
+
I2
(1×10-5mol·L-1)
生成深蓝色吸附化合物,
SCN
+
Fe3+
FeSCN2+
(
1×10-5mol·L-1可见红色)193.氧化还原指示剂20
指示剂还原形氧化形颜色变化
次甲基蓝0.52无色天蓝色二苯胺磺酸钠
0.85无色紫红色邻苯氨基苯甲酸0.89无色紫红色邻二氮菲亚铁
1.06红色
浅蓝色
In1In2In3In4
无无紫红无or浅紫
*二苯胺磺酸钠5.3.2氧化还原滴定曲线滴定前,Fe3+未知,不好计算sp前,Ce4+未知,按Fe3+/Fe2+电对计算sp后,Fe2+未知,按Ce4+/Ce3+电对计算21以Ce4+滴定Fe2+(均为0.1000mol·L-1)为例:对于滴定的每一点,达平衡时有:(1mol·L-1H2SO4)sp时电位的计算2223通式(对称电对)Ce4+滴定Fe2+的滴定曲线24/V突跃1.261.06
1.06邻二氮菲亚铁0.860.89
邻苯氨基苯甲酸
0.85
二苯氨磺酸钠Cr2O72-/Cr3+-0.1%时,=0.68+0.059lg103+0.1%时,=1.44+0.059lg10-3Fe3+滴定Sn2+25
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 防虐待安全教育
- 《蜀道难》课件统编版高二语文选择性必修下册2
- 一年级下册道德与法治教学设计-14 请帮我一下吧 人教部编版
- 浙教版信息技术八年级下 第八课 丰富的动画补间动画 教学设计
- 初中地理商务星球版七年级上册第一章 地球第三节 地球的自转教学设计及反思
- 七年级生物上册 3.6.1 植物光合作用的发现教学设计 (新版)苏教版
- 高速公路交通事故警示教育
- 四年级科学上册教学设计-第一单元4《我们是怎样听到声音的》教科版 (1份打包)
- 2025年份3月份白酒酒瓶激光雕刻定制代理生产合同
- 课时5:练习十四(教学设计)-2024-2025学年四年级上册数学苏教版
- 2024年中国铁路上海局集团有限公司招聘笔试参考题库附带答案详解
- 肾病科肾病综合征一病一品优质护理汇报课件
- 4马克思主义宗教观
- 实用版建筑工程工程合同模板
- 测量资料表格填写范例
- 医疗机构高警示药品风险管理规范(2023版)
- 幼儿园优质公开课:小班语言《小白鱼过生日》完整绘本有声故事PPT
- 《儿科学》课件第9章第九节 腹泻病
- 钢筋混凝土外文翻译文献
- 项目2 动车组餐车乘务作业《高铁动车餐饮服务》教学课件
- 致远安全技术白皮书(简版)

评论
0/150
提交评论