



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
晚期胃癌的免疫治疗进展
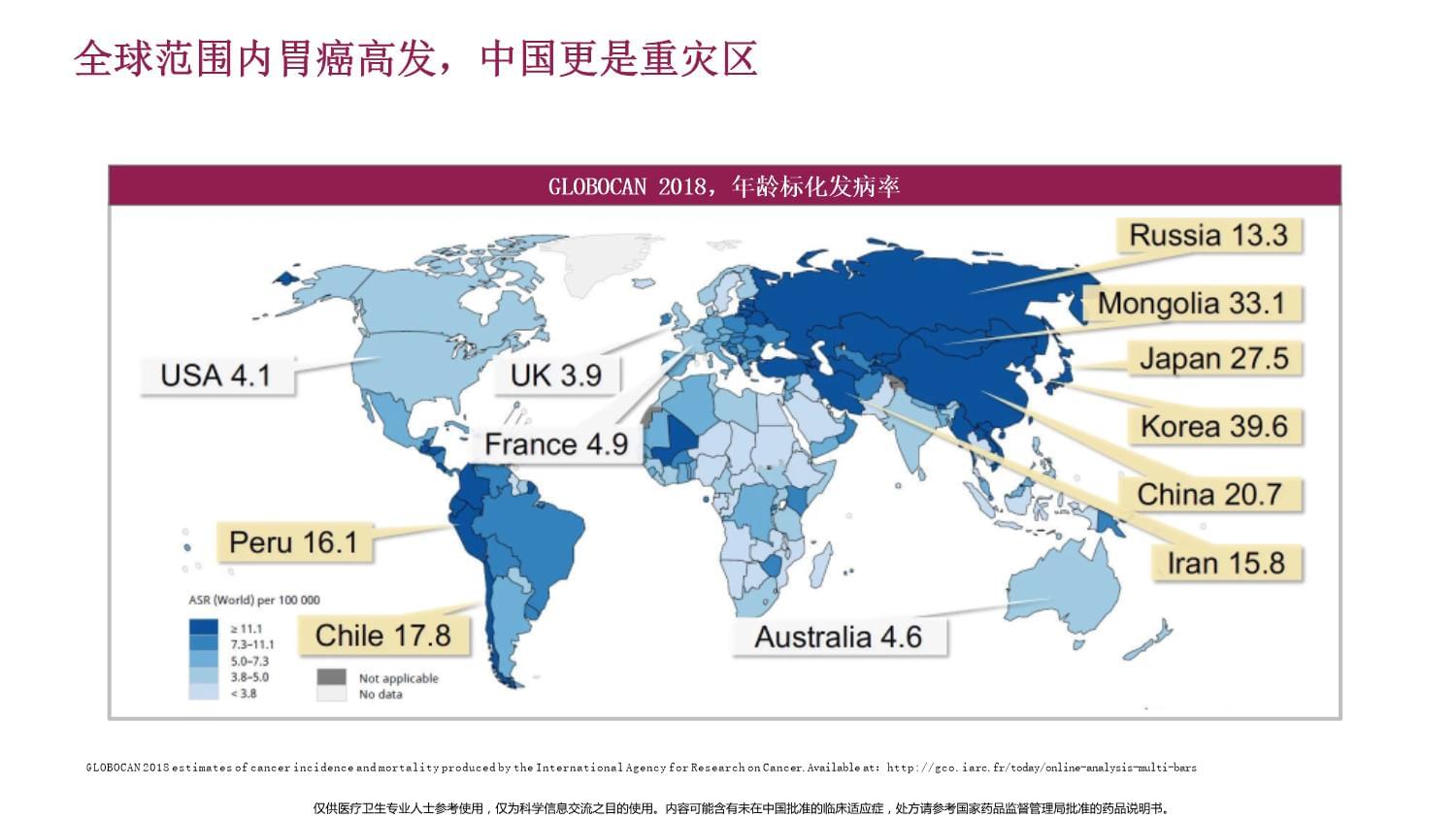
及替雷利珠单抗临床研究数据目录01PD-1抑制剂治疗胃癌兴起02胃癌免疫治疗从后线推向一线03替雷利珠单抗在胃癌领域的临床研究布局及数据全球范围内胃癌高发,中国更是重灾区GLOBOCAN2018,年龄标化发病率GLOBOCAN2018estimatesofcancerincidenceandmortalityproducedbytheInternationalAgencyforResearchonCancer.Availableat:http://gco.iarc.fr/today/online-analysis-multi-bars中国早期胃癌诊治率低,远处转移预后差1.国家消化系统疾病临床医学研究中心,等.中国早期胃癌筛查流程专家共识意见(草案).中华健康管理学杂志.2018,12(1):8-14.2.WangH,etal.MolClinOncol.2018;9(4):423-431.3.WangH,etal.MolClinOncol.2018;9(4):423-431.中国早期胃癌诊治率低于日本和韩国1,2IV期患者5年生存率不足10%3早期胃癌诊治率(%)5年生存率(%)不同国家早期胃癌诊断率中国不同分期胃癌的5年生存率南方医院普外科2004年6月-2014年6月间活检确诊胃癌患者(n=1506)晚期胃癌治疗的发展:从化疗到靶向,到免疫治疗开始晚期或复发胃癌的化疗(5-FU)1,21991年:FAMTX成为标准治疗1997年:ECF成为标准治疗1,2曲妥珠单抗获NMPA批准3雷莫芦单抗在日本获批二线治疗6纳武利尤单抗获NMPA批准治疗三线及以上胃癌(无论PD-L1状态)71970-80年代FAM治疗成为标准治疗(欧美)1,22000年代2006年:DCF获FDA批准用于进展期胃癌的一线治疗2009年:S-1获中国NMPA批准上市2014年2020年纳武利尤单抗获日本批准三线治疗胃癌(无论PD-L1状态)7帕博利珠单抗获FDA批准三线治疗胃癌(PD-L1CPS≥1)82015年2012年1990年代1960年代2017年雷莫芦单抗获FDA批准4多西他赛mDCF方案获NMPA批准用于晚期胃癌一线治疗5阿帕替尼获NMPA批准用于晚期胃癌3线及以上治疗7.aiebJ,etal.CancerTreatRev.2018;66:104-113.8./Drugs/InformationOnDrugs/ApprovedDrugs/ucm577093.htm..1.徐瑞华,滕开原.癌症2009;28(10):1108-1113.2.日本胃癌学会编著:胃癌治疗指引医师用2014年5月修订第4版,p24-27,金原出版,2014.3.KuGY,IlsonDH.ExpertOpinEmergDrugs.2015;20(1):63-74.
4.JavleM,
etal.Clin
Cancer
Res.2014;20(23):5875-81.5./about_2225.html6.YamaguchiK,etal.GastricCancer.2018Nov;21(6):1041-1049.5-FU:5-氟尿嘧啶;FAM:氟尿嘧啶(F)+阿霉素或表阿霉素(A)+丝裂霉素(M);DCF:多西他赛+顺铂+氟尿嘧啶;FAMTX:氟尿嘧啶+阿霉素+氨甲喋呤;ECF:表柔比星+顺铂+5-FU;S-1:氟尿嘧啶衍生物;FDA:美国食品药品监督管理局;NMPA:国家药品监督管理局;PD-L1:程序性死亡配体1;CPS:综合阳性评分晚期胃癌治疗的演进免疫检查点抑制剂的治疗机制AlsaabHO,
etal.FrontPharmacol.
2017Aug23;8:561.APC与肿瘤细胞和T细胞释放的抗原结合,激活TCR和MHC结合。肿瘤基质的PD-L1与T细胞的PD-1相互作用,抑制T细胞介导的肿瘤细胞毒作用。TAM、MDSC等在PD-1/PD-L1介导的肿瘤免疫抑制中起重要作用。PD-(L)1抑制剂抑制这一过程发挥抗肿瘤作用各国指南对胃癌免疫治疗的推荐1.NCCNClinicalPracticeGuidelinesinOncology-GastricCancer(Version1.2020).
2.Pan-AsianadaptedESMOClinicalPracticeGuidelinesforthemanagementofpatientswithmetastaticgastriccancer.AnnOncol.2019Jan1;30(1):19-33.3.中国临床肿瘤学会(CSCO)胃癌诊疗指南(2019).4.Japanesegastriccancertreatmentguidelines2018(5thedition).GastricCancer.2020Feb14.PD-L1/PD-1抗体治疗用于微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)胃癌患者的二线或后续治疗;PD-L1表达水平(CPS≥1)胃癌患者的三线或后续治疗PD-L1/PD-1抗体治疗可作为晚期胃癌三线及以上的治疗选择推荐PD-1单抗治疗作为晚期胃癌的三线治疗鼓励患者积极参与临床研究推荐PD-1单抗治疗作为晚期胃癌的三线治疗2020V1指南12019ESMO指南22020CSCO指南32018JGCA指南4目录01PD-1抑制剂治疗胃癌兴起02胃癌免疫治疗从后线推向一线03替雷利珠单抗在胃癌领域的临床研究布局及数据晚期胃癌免疫治疗探索三线及后线二线一线ATTRACTION-02:不论PD-L1表达状态都有生存获益1.ChenLT,etal.GastricCancer.2020May;23(3):510-519.2.Li-TzongChen,etal.etal.2020ASCO-GI.Abstract383.分层因素:国家/地区(日本vs.韩国vs.中国台湾);ECOGPS(0vs.1);转移器官数(≤2vs.≥2)纳武利尤单抗(n=330)安慰剂(n=163)中位OS,月5.264.14HR(95%CI)0.62(0.51-0.76),P<0.00011年OS率(%)27.3%11.6%2年OS率(%)10.6%3.2%3年OS率(%)5.6%1.2%中位PFS,月1.611.45HR(95%CI)0.60(0.49-0.75),P<0.00011年PFS率(%)9.3%1.5%生存结果≥20岁不可切除的晚期或复发G/或GEJ腺癌(n=493)≥2种方案难治/不耐受ECOGPS0-1主要终点:OS次要终点:有效性(PFS、BOR、ORR、TTR、DOR、DCR)、安全性探索性终点:不同PD-L1表达水平肿瘤的有效性主要入组标准纳武利尤单抗3mg/kgQ2W(n=330)安慰剂(n=163)纳武利尤单抗(n=268)安慰剂(n=131)BORCR(%)3(1.1)0PR(%)29(10.8)0SD(%)76(28.4)33(25.2)PD(%)124(46.3)79(60.3)NE(%)36(13.4)19(14.5)ORR(CR+PR)(%)32(11.9)0DCR(CR+PR+SD)(%)108(40.3)33(25.2)抗肿瘤疗效PD-L1<1%PD-L1≥1%中位OS,月(95%CI)纳武利尤单抗(n=114)6.05(4.8-8.6)安慰剂(n=52)4.19(3.0-6.9)HR=0.72(95%CI0.49-1.05)中位OS,
月(95%CI)纳武利尤单抗(n=16)5.22(2.8-9.4)安慰剂(n=10)3.83(0.8-5.0)HR=0.51(95%CI0.21-1.25)亚洲多中心、双盲、随机对照,III期研究三线III期KEYNOTE-059队列1:PD-L1≥1%者帕博利珠单抗三线治疗获益1.FuchsCS,etal.JAMAOncol.2018;4(5):e180013.&OnlineContent2.WainbergZA,etal.etal.2019ASCO.Abstract4009.年龄≥18岁复发性或转移性G/GEJ(n=259)既往≥2线化疗可评估疾病HER-2阴性ECOGPS评分0-1帕博利珠单抗(200mg,Q3W)电话随访存活者直至死亡、停药或研究终止治疗达到35个周期(~2年)或直至疾病进展、不耐受毒性或其他原因停止治疗主要终点:安全性、ORR次要终点:DoR、DCR、OS探索性终点:生物标记物(PD-L1阳性定义为CPS≥1)注:CPS即PD-L1阳性细胞(肿瘤细胞、淋巴细胞、巨噬细胞)的数量/肿瘤细胞的总数×100生存情况中位OS:5.6个月中位PFS:2.0个月PD-L1表达和生存情况:1年OS率2年OS率队列124.6%12.5%PD-L1+28.2%15.1%PD-L1-20.2%9.2%OS率(%)PD-L1+PD-L1-时间(月)抗肿瘤疗效全球、开放标签、多中心、非随机、3队列、单臂II期研究主要入选标准相对基线改善,%SLD:最长径总和SLD相对基线的最佳改善情况帕博利珠单抗,%BORORR(CR+PR)11.6%PD-L1+15.5%PD-L1-6.4%DCR(CR+PR+SD)27%三线II期JAVELIN
Gastric
300:
国际、多中心、随机、开标标签III期研究BangYJ,etal.AnnOncol.
2018Oct1;29(10):2052-2060.主要终点:OS次要终点:PFS、ORR、安全性及耐受性Avelumab紫杉醇或伊立替康中位OS,月(95%CI)4.6(3.6-5.7)5.0(4.5-6.3)HR(95%CI),P值1.1(0.9-1.4),P=0.81中位PFS,月(95%CI)1.4(1.4-1.5)2.7(1.8-2.8)HR(95%CI)1.73(1.4-2.2),P>0.99ORR,%2.24.3JAVELINGastric300研究是全球第一项接受三线治疗的患者中开展的免疫检查点抑制剂与阳性化疗药物对照,而非与安慰剂对照的临床研究。该研究在OS、PFS及ORR方面未达到显著改善研究结果主要入选标准≥18岁复发、不可切除的局部进展或晚期或转移性G/GEJ(n=371)既往接受收两线系统治疗ECOGPS0或1BSC+Avelumab10mg/kgQ2WBSC+化疗(紫杉醇或伊立替康)治疗直至:疾病进展死亡毒性不耐受任意其他协议定义的治疗终止三线III期研究ATTRACTION-02KEYNOTE-059队列1JAVELIN300期IIIII(单臂)III治疗线数三线及以上三线及以上三线样本量,N493(330vs.163)259371(185vs.186)分组纳武利尤单抗
vs.安慰剂帕博利珠单抗Avelumabvs.紫杉醇/伊立替康主要终点OSORROSPD-L1筛选否否否OS(月)5.3vs.4.1HR=0.635.6(4.3-6.9)4.6vs.5.0HR=1.73PFS(月)1.61vs.1.45HR=0.602.0(2.0-2.1)1.4vs.2.7HR=1.73ORR11.9%vs0%11.6%(PD-L1+vsPD-L1-:15.5%vs.6.4%)2.2%vs.
4.3%DCR40.3%vs.25.2%31%22.2%vs.44.1%免疫三线治疗临床研究:不同的设计,不同的结局三线及后线二线一线晚期胃癌免疫治疗探索KEYNOTE-061:对于CPS≥1的人群,与紫杉醇相比,帕博利珠单抗未能显著改善PFS、OS及ORR,但安全性更好ShitaraK,etal.Lancet.
2018Jul14;392(10142):123-133.全球、多中心、开放标签、随机对照、III期研究主要入组标准主要终点:CPS≥1人群的OS和PFS次要终点:CPS≥1人群的ORR和DOR所有人群的安全性帕博利珠单抗单药200mgQ3W紫杉醇单药Q4W年龄≥18岁局部晚期、不可切除疾病或转移性GC/GEJ(n=592)PD-L1CPS≥1(n=395)经铂类和氟尿嘧啶(HER2阳性者采用曲妥珠单抗治疗)一线治疗后进展ECOGPS0–1病灶可测量研究结果帕博利珠单抗紫杉醇1年OS率,%40%27%中位OS,月(95%CI)9.1(6.2-10.7)8.3(7.6-9.0)HR(95%CI),P值0.82(0.66-1.03),单侧P=0.0421中位PFS,月(95%CI)1.5(1.4-2.0)4.1(3.1-4.2)HR(95%CI)1.27(1.03-1.57)ORR,%1614中位DOR,月(范围)18.0(8.3–不可估算)5.2(3.2-15.3)安全性结果二线III期KEYNOTE-061:CPS≥10、ECOGPS0分患者,免疫治疗OS获益优于化疗Presentat2020ASCO.OralAbstractsessionnumber4503.ZevA.Wainberg,etal.2020GastrointestinalCancersSymposium.Abstract#:427KEYNOTE-061研究全球、多中心、开放标签、随机对照、III期研究研究方案:帕博利珠单抗vs.紫杉醇研究人群:经铂类和氟尿嘧啶(HER2阳性者采用曲妥珠单抗治疗)一线治疗后进展或转移性GC/GEJ(n=592)PD-L1筛选:PD-L1CPS≥1(n=395)主要终点:CPS≥1人群的OS和PFSCPS≥10OS率(%)时间(月)12个月OS45.3%23.6%中位OS事件/患者HR(95%CI)P值帕博利珠单抗10.4个月44/530.69(0.46-1.05)0.04紫杉醇8.0个月51/55CPS≥1,ECOGPS0中位OS事件/患者HR(95%CI)帕博利珠单抗12.3个月78/880.69(0.50-0.95)紫杉醇9.3个月87/92数据截止2019年10月7日/ct2/show/NCT02370498CharlesS.Fuchs,etal.ASCO2020.PosterAbstract4512.KEYNOTE-061:高tTMB者接受帕博利珠治疗有更高的ORR和OS帕博利珠单抗(n=218)紫杉醇(n=202)ORRPFSOSORRPFSOSn*2719917426184177P**0.0007<0.0001<0.00010.70.80.7tTMB与临床预后之间相关性*n为有响应的患者数(ORR),或发生PFS、OS的事件数;**预设的显著性为帕博利株组α单侧0.05,紫杉醇组α双侧0.05。tTMB亚组与临床疗效之间相关性tTMB≥175突变数/外显子组n=76tTMB<175突变数/外显子组n=344帕博利珠单抗(n=40)紫杉醇(n=36)帕博利株单抗(n=178)紫杉醇(n=166)ORR,%(95%CI)30(17-47)11(3-26)8(5-14)13(8-19PFS,中位值,(95%CI),月4.1(2.1-8.6)4.1(3.0-8.2)1.5(1.4-1.6)4.1(3.1-4.3)HR(95%CI)0.73(0.44-1.22)1.78(1.43-2.22)OS,中位值,(95%CI),月16.4(10.8-NR)8.1(6.8-12.1)5.7(4.7-8.7)8.8(8.3-9.9)HR(95%CI)0.46(0.27-0.81)1.12(0.89-1.41)tTMB≥175(A)和tTMB<175(B)亚组OSK-M曲线三线及后线二线一线晚期胃癌免疫治疗探索PresentedByCharlesFuchsat2017ASCOAnnualMeetingKEYNOTE-059队列2:Pembrolizumab+5-FUORR60%,PFS6.6个月,OS13.8个月主要终点:安全性次要终点:PD-L1阳性-肿瘤患者的客观缓解率(ORR)、缓解持续时间(DOR)、疾病控制率(DCR)、总生存期(OS)患者复发性或转移性胃癌或胃食管交界处(GEJ)腺癌未接受既往治疗晚期疾病可评估疾病HER-2阴性ECOGPS评分0-1不同PD-1表达状态的疗效差异Cohort2:PFSandOS6个月OS率:52%12个月OS率:48%6个月PFS率:68%总人群(N=25)PD-L1阳性(n=16)PD-L1阴性(n=8)ORR(95%CI)60(39-79)69(41-89)38(9-76)DCR*(95%CI)80(59-93)75(48-93)75(35-97)帕博利珠单抗200mg每周3次+顺铂80mg/m2每周3次+5-FU800mg/m2每周3次或卡培他滨1000mg/m2BID每周3次治疗达到35个周期(~2年)或直至疾病进展、不耐受毒性或其他原因停止治疗一线II期BokuNetal.AnnOncol.
2019Feb1;30(2):250-258.ATTRACTION-04Part-1:
纳武利尤单抗联合化疗一线治疗生存获益明显亚洲、多中心、开放标签、随机对照、II期研究主要入组标准纳武利尤单抗360mgQ3W+S-1+奥沙利铂(SOX)Q3W(n=21)纳武利尤单抗360mgQ3W+奥沙利铂+卡培他滨(CapeOX)Q3W(n=19)不可切除的晚期或复发的HER2阴性G/GEJCECOGPS评分为0或1分对于曾接受新辅助或辅助化疗的患者,如治疗结束时间距复发≥180天则允许入组治疗直至:疾病进展(RECISTv1.1标准)毒性不耐受撤回同意R1:1主要终点:安全性次要终点:ORR、OS、PFS、DoR、BOR、DCR、TTR以及靶病灶变化百分比ORROSPFSNivo+SOX(n=21)Nivo+CapeOX(n=17)66.7%(43.0-85.4)70.6%(44.0-89.7)OS(%)OS(月)方案中位OS(月)总人群NR(13.9-NR)纳武利尤单抗
+CapeOXNR(11.2-NR)纳武利尤单抗+SOXNR(11.9-NR)PFS(%)PFS(月)方案中位PFS(月)中位PFS(月)总人群9.7(6.8-12.5)9.5(6.9-11.1)纳武利尤单抗
+CapeOX10.6(5.6-12.5)9.8(6.8-NR)纳武利尤单抗+SOX9.7(5.8-NR)7.2(4.3-11.2)中心实验室评估研究者评估一线II期21ATTRACTION-04Part-2:纳武利尤单抗联合化疗一线治疗显著改善PFS和ORR,
尽管OS无显著改善,但该方案可作为晚期或复发性GC/GEJ的新一线治疗选择Nivolumabpluschemotherapyversuschemotherapyaloneinpatientswithpreviouslyuntreatedadvancedorrecurrentgastric/gastroesophagealjunction(G/GEJ)cancer:ATTRACTION-4(ONO-4538-37)study.ESMO2020.PresentationNumberLBA7_PR.一线III期ESMO2020亚洲、多中心、开放标签、随机对照、II/III期研究主要入组标准纳武利尤单抗+化疗(N+C)(S-1+奥沙利铂或奥沙利铂+卡培他滨)(n=362)安慰剂+化疗(C)(n=362)不可切除的晚期或复发的HER2阴性GC/GEJ治疗直至:疾病进展毒性不耐受共同主要终点:中心评估PFS和OS预先规定,如果主要终点无效假设中的至少一个被拒绝,则认为主要目标已实现R1:1中位随访11.6个月的PFS中期分析,达到主要终点;中位随访26.6个月的OS最终分析中,无统计学意义生存时间(月)HR=0.68(98.51%CI:0.51-0.90)P=0.0007HR=0.9(98.51%CI:0.75-1.08)P=0.257ORR(%)P=0.0088TaberneroJ,etal.2019ASCOAbstractLBA4007.KEYNOTE-062:
P+Cvs.C未达到预设终点,Pvs.C达到预设非劣效终点,CPS>10
OS获益更好随机、对照、多中心、III期研究主要入组标准ArmP:帕博利珠单抗200mgQ3Wb(n=256)ArmP+C:帕博利珠单抗200mgQ3W+顺铂+5-FU/卡培他滨Q3Wc(n=257)局部晚期,不可切除或转移性G/GEJ癌(n=763)HER2/neu阴性PD-L1阳性疾病(CPS≥1)ECOGPS0或1治疗持续35个周期;直至出现不可接受毒性,疾病进展;或患者/研究者决定停药ArmC:安慰剂+顺铂+5-FU/卡培他滨Q3W(n=25)R1:1:1分层因素:国家/地区;局部晚期或转移性;5-FU或卡培他滨Time(months)2主要终点:OS和PFS次要终点:ORR,DOR及安全性一线III期尚待进一步增加病例,调整化疗方案进行探索设计过于复杂,病例分散,统计学难度高Biomarker需要探索?TMB?与ATTACTION-04比,配伍的化疗方案主要差别在于顺铂还是奥沙利铂CPS≥10部分的患者免疫联合化疗生存数据比较诡异KN062研究的启示CPS≥1这部分患者的免疫联合化疗的生存数据与KN059相当,1年以上,相对可靠CPS≥10的患者可以从单药免疫治疗中显著OS获益CheckMate-649:纳武利尤单抗联合化疗一线治疗在PD-L1联合阳性评分(CPS)≥5的主要分析人群以及所有随机人群中,均观察到生存获益
纳武利尤单抗+伊匹单抗(4剂)→纳武利尤单抗单药纳武利尤单抗+化疗(XELOX或FOLFOX)既往未经治疗的无法手术的晚期或转移性G/GEJC(n=1581)治疗后随访化疗(XELOX或FOLFOX)主要终点:PD-L1+人群的OS及PFS次要终点:所有人群的OS,PFS,ORR及TTSDR1:1:1有效性纳武利尤单抗联合化疗化疗PD-L1CPS≥5N=473N=482中位OS,月(95%CI)14.4(13.1-16.2)11.1(10.0-12.1)
HR(98.4%CI;P值)0.71(0.59-0.86;P<0.0001)中位PFS,月(95%CI)7.7(7.0-9.2)6.1(5.6-6.9)
HR(98.0%CI;P值)0.68(0.56-0.81;P<0.0001)PD-L1CPS≥1N=641N=655中位OS,月(95%CI)14.0(12.6-15.0)11.3(10.6-12.3)HR(99.3%CI;P值)0.77(0.64-0.92;P=0.0001)总体N=789N=792中位OS,月(95%CI)13.8(12.6-14.6)11.6(10.9-12.5)HR(99.3%CI;P值)0.80(0.68-0.94;P=0.0002)一线III期ESMO2020KEYNOTE-659:S-1+奥沙利铂+派姆单抗三药联合一线治疗晚期G/GEJKawazoeA,etal.EurJCancer.2020Apr;129:97-106.非随机多中心,开放,II期研究OS尚未达到,目前已经超过13个月mPFS:9.4m(95%CI6.6-)6mPFS:67%,OS:87%PFSassessedbyBICR(ASaT;N=54)DORassessedbyBICR(ASaT;N=54)PatientswhodiscontinuedSOXorpembrolizumabcouldcontinuepembrolizumabmonotherapyorSOX,respectively,iftheyhadnotmetdiscontinuationcriteria.OSassessedbyBICR(ASaT;N=54)队列1(n=54)队列2(n=54)主要入组标准主要终点:ORR(BICR)次要终点:DOR、DCR、TTR、PFS、OS、AesSOX+派姆单抗200mgQ3WSP+派姆单抗200mgQ3W年龄≥18至≤75ECOGPS0-1既往无化疗HER2阴性PD-L1阳性(综合阳性评分,CPS≥1)≥1个可测量病灶ORR(%)39(72.2)DCR(%)52(96.3)CR(%)2(3.7)PR(%)37(68.5)SD(%)13(24.3)PD(%)2(3.7)中位PFS,月9.4中位DOR,月未达到中位TTR(月)15抗肿瘤疗效其他非III期探索PANTHERA:派姆单抗+曲妥珠单抗+化疗一线治疗HER2+晚期胃癌的多中心Ib/II期研究:ORR76.7%,DCR97.7%Presentat
2020ASCO.Posternumber3081.主要终点:ORR(RECISTv1.1)次要终点:PFSOSDOR安全性PFS时间(月)中位PFS:8.6个月(95%CI:7.2-22.0)时间(月)OS中位OS:18.4个月(95%CI:17.9-未评估)时间(月)DOR中位DOR:10.8个月(95%CI:7.2-未评估)中位随访16.1个月,≥3级TRAEs为74.4%,其中39.5%伴有中性粒细胞减少症,irAEs;OS与TMB、PD-L1表达无关抗肿瘤效果肿瘤缩小率:95.3%ORR:76.7%DCR:97.7%生存结局HER2阳性复发和/或转移性GC派姆单抗(200mg,IV,Q3W)+曲妥珠单抗[6mg/kg(初始负荷剂量为8mg/kg),D1]+化疗(n=43)化疗方案:卡培他滨1000mg/m2,D1-14,BID;顺铂80mg/m2,D1,Q3W其他非III期探索EPOC1706:派姆单抗+仑伐替尼治疗晚期胃癌的开放标签、II期研究AkihitoKawazoe,etal.JournalofClinicalOncology202038:4_suppl,374-374.nORR(%)肝转移13(45%)7(54%)腹膜转移7(24%)4(44%)一线14(48%)10(71%)二线15(52%)10(67%)错配修复基因无缺失27(93%)19(70%)HER2阳性5(17%)4(80%)EBV阳性1(3%)1(100%)PD-L1CPS≥119(66%)16(84%)PD-L1CPS<110(34%)4(40%)PD-L1CPS≥105(17%)5(100%)TMB-高*11(52%)9(82%)TMB-低*10(48%)6(60%)*中位(10.01)作为cut-off值ORR:69%(95%CI49~85)DCR:100%(95%CI88~100)中位PFS:6.9个月(95%CI4.4~9.4个月)中位OS尚未达到选定亚组的ORR自基线肿瘤最大变化(%)MSI-H(所有其他患者为MSS)EBV+(所有其他患者为EBV+)治疗直至疾病进展或不可耐受药物毒性病理确诊为晚期胃癌(n=29)ECOGPS0-1有可测量病灶(RECIST1.1标准)内脏和骨髓功能尚可仑伐替尼20mgQD派姆单抗200mgQ3W主要终点:ORR次要终点:DCR、PFS、OS、AEs发生率主要入选标准抗肿瘤疗效其他非III期探索总结:晚期胃癌免疫治疗进展二线一线ATTRACTION-02KEYNOTE-059JAVELIN-300阳性结果阴性结果KEYNOTE-061ATTRACTION-04KEYNOTE-062CheckMate-649三线目录01PD-1抑制剂治疗胃癌兴起02胃癌免疫治疗从后线推向一线03替雷利珠单抗在胃癌领域的临床研究布局及数据百济神州自主研发的PD-1抗体药物百泽安®(替雷利珠单抗)已于2019年12月获批上市,2020年4月已获批第一个实体瘤UC适应症百济神州官网百泽安®大事记6月在澳大利亚进入临床试验201512月在中国进入临床试验20164月启动替雷利珠单抗中国首个关键性研究20171月启动替雷利珠单抗首个全球Ⅲ期临床研究8月国家药品监督管理局(NMPA)受理替雷利珠单抗治疗经典型霍奇金淋巴瘤(
cHL
)新药上市申请11月替雷利珠单抗治疗cHL的新药上市申请被纳入优先审评20182月在北京研发中心启动PD-1研究项目,产品代号BGB-A317201220195月NMPA受理替雷利珠单抗用于治疗尿路上皮癌(UC)新药上市申请7月替雷利珠单抗治疗UC的新适应症上市申请被纳入优先审评9月替雷利珠单抗治疗复发或难治性经典型霍奇金淋巴瘤(r/rcHL)的RATIONALE203研究在Leukemia全文发表12月替雷利珠单抗治疗至少经二线系统化疗的r/rcHL获批百泽安®(替雷利珠单抗)获批适应症用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤用于治疗既往接受过治疗的局部晚期或转移性尿路上皮癌20204月替雷利珠单抗治疗既往接受过治疗的局部晚期或转移性UC获批NMPA受理替雷利珠单抗联合化疗一线治疗晚期鳞状NSCLC的新适应症上市申请百泽安®在胃癌领域布局广泛,一线治疗的III期研究值得期待31BGB-A317-205研究中国,共30例,其中GC/GEJ15例,ESCC15例一线,联合化疗(XELOX)随访中BGB-A317-001研究全球多中心,多种晚期实体瘤单药二线或二线后总共451例,GC50例ORR:13%,DCR:29.6%DoR:8.5mBGB-A317-102研究中国,多种晚期实体肿瘤单药二线或二线后总共245例,其中GC24例ORR:17%,DCR:29%mOS:4.7m;PFS:2.2mBGB-A317-305研究全球10个国家及地区GC/GEJ980例一线,联合化疗
入组中2018ESMOIO
PhaseIA/IBPhaseI/IIPhaseIII2019ESMOASIA2018ESMO2021.
7ORR:46.7%mPFS:6.1mmOS:15.4个月的中位随访期内,未达到RATIONALE205研究(II期)最新结果公布:替雷利珠单抗联合化疗一线治疗晚期胃癌,为患者带来新希望JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.HER2阴性GC/GEJ患者(n=15)初始阶段替雷利珠单抗+奥沙利铂+卡倍他滨(n=6)治疗拓展阶段替雷利珠单抗+奥沙利铂+卡倍他滨(增加至15例)GC/GEJ组化疗方案替雷利珠单抗(200mgIVQ3W),奥沙利铂(130mg/m2IVQ3W,最多使用6个周期),卡倍他滨(1000mg/m22次/天,每周期的D1-14Q3W)研究终点经RECISTV1.1评估的客观缓解率(ORR),缓解持续时间(DoR),疾病控制率(DCR),以及无进展生存期(PFS)无新发或显著不良反应RATIONALE205研究:患者基线特征G/GEJ腺癌年龄,年,中位数(范围)59.0(42,74)年龄组别,n(%)<65≥6510(66.7)5(33.3)性别,n(%)男女11(73.3)4(26.7)ECOG体能状态评分,n(%)011(6.7)14(93.3)TNM分期,n(%)III期(IIIA,IIIB,IIIC)IV期(IV)NA1(6.7)14(93.3)0原发肿瘤的组织学分级,n(%)GXG1G2G3其他
缺失3(20.0)1(6.7)2(13.3)9(60.0)00转移部位,n(%)淋巴结肝
肺纵隔
腹膜后肿块骨其他6(40)7(46.7)3(20.0)00012(80.0)JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.中位年龄为59岁(范围:42.0-74.0)大多数患者为男性(n=11;73.3%)93.3%的患者(n=14/15)为TNMIV期大多数转移部位位于内脏组织(例如淋巴结,肝脏)RATIONALE205研究结果显示:替雷利珠单抗联合化疗一线治疗,15.4个月的中位随访期内,mOS未达到JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.中位随访时间15.4个月中位总生存期未达到总生存期(月)
数据删失死亡G/GEJ腺癌组患者(n=15)RATIONALE205研究显示:替雷利珠单抗联合化疗一线治疗,mPFS达6.1月JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.完全缓解部分缓解病情稳定疾病进展无完全缓解或无疾病进展未评估数据删失疾病恶化死亡无进展生存期(月)
G/GEJ腺癌组患者(n=15)6.1个月G/GEJ腺癌组中位无进展生存期(mPFS)RATIONALE205研究结果显示:替雷利珠单抗联合化疗一线治疗,ORR可达到46.7%,DCR可达到80%,达到缓解中位时间为9.3周JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.46.7%客观缓解率(ORR)80%疾病控制率(DCR)9.3周达到缓解的中位时间为9.3周非CR/非PD.基线时非靶器官病变患者;无数据.基线后未进行肿瘤评估的患者;ORR=CR+PR;DCR=CR+PR+SD+非CR/非PDRATIONALE205研究结果显示:替雷利珠单抗联合化疗一线治疗,可显著减小胃癌患者肿瘤直径JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.PD-L1<1%PD-L1≥1%从基线的变化(%)肿瘤直径从基线的变化从基线的变化(%)靶病灶缓解RATIONALE205研究结果显示:替雷利珠单抗联合化疗一线治疗,总体安全性、耐受性均良好,未发现新的安全性信号JianmingXu,etal.TislelizumabPlusChemotherapyasFirst-lineTreatmentforAdvancedEsophagealSquamousCellCarcinomaandGastric/GastroesophagealJunctionAdenocarcinoma,ClinCancerRes.2020Jun19;clincanres.3561.2019.替雷利珠单抗联合化疗引起的不良事件概况通常是可控的,据报道与化疗相关的不良事件与已知与化疗相关的不良事件相一致联合治疗未观察到新的替雷利珠单抗安全性信号,并且据报道大多数不良事件的轻度至中度终止研究治疗和伴随用药后,所有AE均已消退或正在消退治疗过程中AE发生率为86.7%,发生率≥20%的不良反应多数为化疗相关,可进一步管理控制所有患者均出现治疗期间不良事件(TEAEs),3-4级TEAEs发生率为
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年度新能源项目投资合同履行的环保担保协议3篇
- 电气维保知识培训课件
- 船舶安全知识培训课件
- “520”荔枝电商法治讲堂2025年度电商合规指南3篇
- 《疾病与营养的关系》课件
- 2024年防水工程竣工验收合同
- 《白银投资》课件
- 浙江农林大学《现代农业建筑设计》2023-2024学年第一学期期末试卷
- 中南林业科技大学涉外学院《儿童画创作理论与应用》2023-2024学年第一学期期末试卷
- 2025年度公益组织与企业联合慈善捐赠合作框架协议范本3篇
- 2024年03月山东烟台银行招考笔试历年参考题库附带答案详解
- 河道综合治理工程施工组织设计
- 江苏省扬州市2024-2025学年高中学业水平合格性模拟考试英语试题(含答案)
- 广东省广州市番禺区2023-2024学年八年级上学期期末英语试题
- 2024-2025学年上学期广州初中英语九年级期末试卷
- 迪士尼乐园总体规划
- 惠州学院《大学物理》2021-2022学年第一学期期末试卷
- 2024年江苏省苏州市中考数学试卷含答案
- 2024年世界职业院校技能大赛高职组“市政管线(道)数字化施工组”赛项考试题库
- 2024消防安全警示教育(含近期事故案例)
- Starter Section 1 Meeting English 说课稿 -2024-2025学年北师大版(2024)初中英语七年级上册

评论
0/150
提交评论