



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
…………○…………内…………○…………装…………○…………内…………○…………装…………○…………订…………○…………线…………○…………※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※…………○…………外…………○…………装…………○…………订…………○…………线…………○…………第=page22页,总=sectionpages22页第=page11页,总=sectionpages11页2025年新世纪版必修2化学下册阶段测试试卷463考试试卷考试范围:全部知识点;考试时间:120分钟学校:______姓名:______班级:______考号:______总分栏题号一二三四五六总分得分评卷人得分一、选择题(共9题,共18分)1、O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。
。pH
t/min
T/℃
3.0
4.0
5.0
6.0
20
301
231
169
58
30
158
108
48
15
50
31
26
15
7
已知:O3的起始浓度为0.0216mol·L—1。
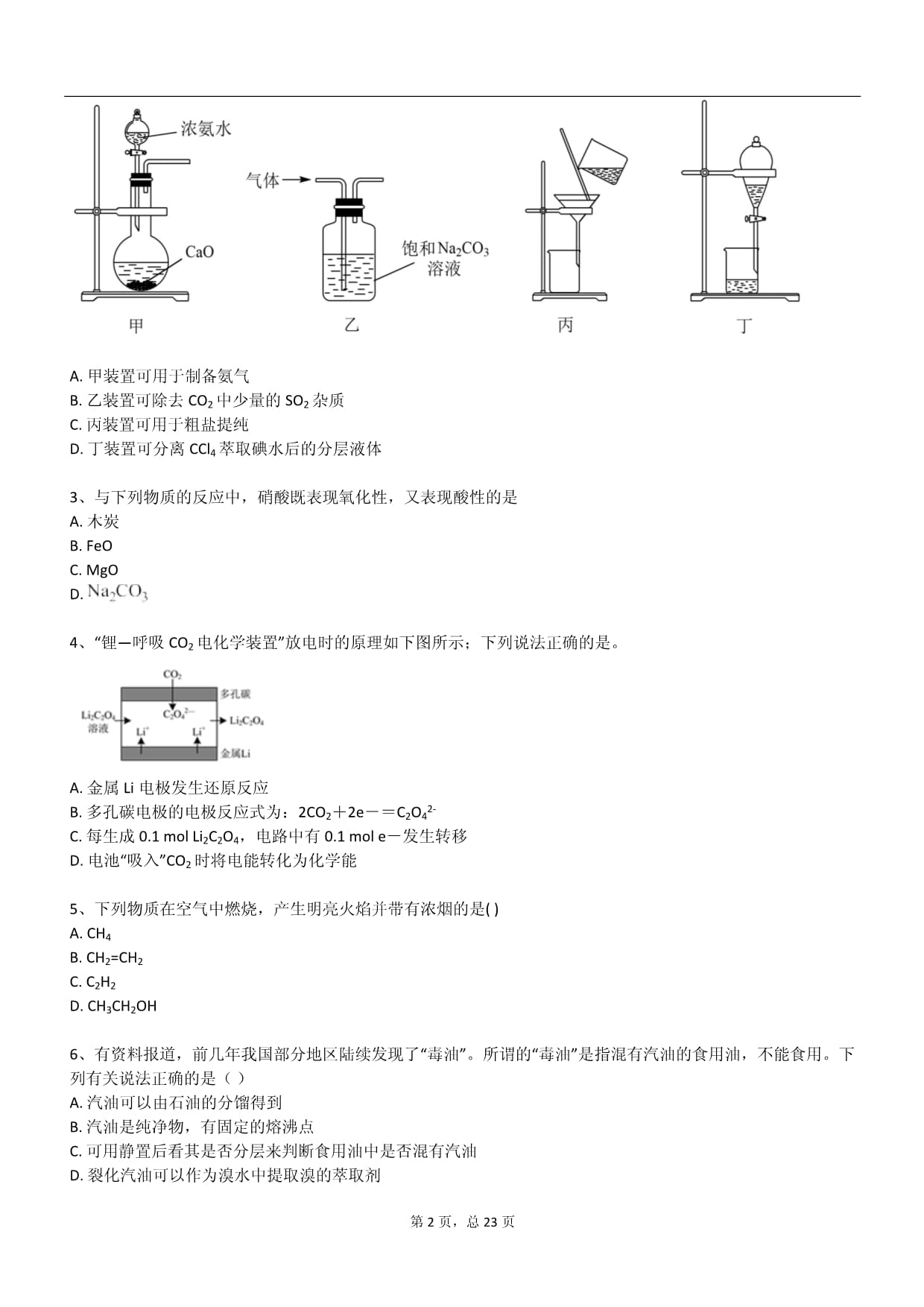
下列说法正确的是A.pH增大能加速O3分解,表明对O3分解起催化作用的是H+B.在30℃、pH=4.0条件下,O3的分解速率为1.67×10—6mol(L·s)—1C.根据表中数据可知,O3的分解速率随温度升高而增大,随pH增大而减小D.根据表中数据的递变规律,推测O3在下列条件下分解速率的大小关系为40℃、pH=3.0>30℃、pH=7.02、下列装置不能完成相应实验的是。
A.甲装置可用于制备氨气B.乙装置可除去CO2中少量的SO2杂质C.丙装置可用于粗盐提纯D.丁装置可分离CCl4萃取碘水后的分层液体3、与下列物质的反应中,硝酸既表现氧化性,又表现酸性的是A.木炭B.FeOC.MgOD.4、“锂—呼吸CO2电化学装置”放电时的原理如下图所示;下列说法正确的是。
A.金属Li电极发生还原反应B.多孔碳电极的电极反应式为:2CO2+2e-=C2O42-C.每生成0.1molLi2C2O4,电路中有0.1mole-发生转移D.电池“吸入”CO2时将电能转化为化学能5、下列物质在空气中燃烧,产生明亮火焰并带有浓烟的是()A.CH4B.CH2=CH2C.C2H2D.CH3CH2OH6、有资料报道,前几年我国部分地区陆续发现了“毒油”。所谓的“毒油”是指混有汽油的食用油,不能食用。下列有关说法正确的是()A.汽油可以由石油的分馏得到B.汽油是纯净物,有固定的熔沸点C.可用静置后看其是否分层来判断食用油中是否混有汽油D.裂化汽油可以作为溴水中提取溴的萃取剂7、氢氧燃料电池总反应为2H2+O2=2H2O,电解质为KOH溶液,则下列叙述中正确的是()A.此电池能产生蓝色火焰B.H2为负极,O2为正极C.工作时电解质溶液的碱性减弱D.正极反应为O2+4H++4e-=2H2O8、化学与生产生活关系密切。下列有关说法错误的是()A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一C.“玉兔二号”月球车使用的帆板太阳能电池的材料是D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜9、十氢萘()是具有高储氢密度的氢能载体其脱氢过程的反应为①②十氢萘脱氢过程的能量变化如图;下列说法正确的是。
A.萘()的储氢过程是吸热反应B.萘()的二氯代物有种C.十氢萘脱氢过程的反应①比反应②更容易进行D.十氢萘属于芳香烃评卷人得分二、填空题(共5题,共10分)10、某反应在体积为5L的恒容密闭的绝热容器中进行;各物质的量随时间的变化情况如图所示(已知A;B、C均为气体)。
(1)该反应的化学方程式为____。
(2)反应开始至2分钟时,B的平均反应速率为____。
(3)能说明该反应已达到平衡状态的是____。
A.v(A)=2v(B)B.容器内气体密度不变C.v逆(A)=v正(C)
D.各组分的物质的量相等E.混合气体的平均相对分子质量不再改变的状态。
(4)由图求得平衡时A的转化率为____。11、化学反应是人类获取能量的重要途径;我们可以通过化学反应实现化学能向热能;电能的直接转化。
Ⅰ.回答下列问题:
(1)从能量变化角度研究反应下图能正确表示该反应中能量变化的是___________(填字母)。
A.B.
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:。化学键H—H0=0H—O键能(kJ/mol)436496463
则常温常压下,1mol在空气中充分燃烧,生成1mol(g)放出热量___________kJ。
Ⅱ.各类电池广泛用在交通工具(如电动汽车;电动自行车等)上;实现了节能减排,也为生活带来了极大的便利。
(3)传统汽车中使用的电池主要是铅蓄电池;其构造如图所示。
①电池工作时,电子由___________流出(填“Pb”或“”)。
②该电池的工作原理为其工作时电解质溶液的pH将___________(填“增大”“减小”或“不变”)。
(4)2020年上海进博会展览中;诸多氢能源汽车纷纷亮相,氢氧燃料电池被誉为氢能源汽车的心脏。某种氢氧燃料电池的内部结构如图所示:
①a处通入的气体是___________;
②电池每消耗标准状况下5.6L氢气,电路中通过的电子数目为___________。
Ⅲ.为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。某温度下,向2.0L的恒容密闭容器中充入2.0mol和2.0mol发生反应,实验数据如下表所示:。t/s050150250350/mol00.240.360.400.40(5)0~50s内的平均反应速率___________。
(6)为加快反应速率,可采取的措施是___________(填字母)。
a.升高温度b.增大容器体积c.加入合适的催化剂。
(7)上述反应中,氢气的平衡转化率为___________。12、有下列3种有机化合物A:乙烯;B:乙醇、C:乙酸。
(1)写出化合物A、B、C中官能团的名称____、____、___。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是___(写结构简式);丙烯与乙烯具有相似的化学性质。丙烯通入溴水中的反应方程式为___;反应类型为___。
(3)B在铜和氧气中加热的方程式:___;反应类型为___。13、写出下列物质形成过程的电子式:(离子键;极性键、非极性键)
(1)Cl2__________________含有________键。
(2)HCl__________________含有________键。
(3)MgCl2__________________含有________键。
(4)H2O2______________含有________;________键。
(5)NaOH______________含有________、________键14、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=__,升高温度,K值__(填“增大”“减小”或“不变”),该反应是___反应(填“吸热”或“放热”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)__。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的下列有关该体系的说法正确的是__(填选项字母)。
A.氢气的浓度减小B.正反应速率加快;逆反应速率也加快。
C.甲醇的物质的量增加D.重新平衡时n(H2)/n(CH3OH)增大评卷人得分三、判断题(共6题,共12分)15、植物油氢化过程中发生了加成反应。(____)A.正确B.错误16、在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,说明溶液中含元素。(_______)A.正确B.错误17、用来生产计算机芯片的硅在自然界中以游离态和化合态两种形式存在。(____)A.正确B.错误18、天然气是一种清洁、不可再生的化石燃料。(____)A.正确B.错误19、农村用沼气池产生的沼气作燃料属于生物质能的利用_____A.正确B.错误20、的名称为3-甲基-4-异丙基己烷。(____)A.正确B.错误评卷人得分四、计算题(共2题,共16分)21、某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成;在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。22、锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO。则该电池的负极材料是________;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是________评卷人得分五、推断题(共2题,共8分)23、F是新型降压药替米沙坦的中间体;可由下列路线合成:
(1)A→B的反应类型是_________,D→E的反应类型是_____;E→F的反应类型是。
__________。
(2)写出满足下列条件的B的所有同分异构体______(写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应。
(3)C中含有的官能团名称是________。已知固体C在加热条件下可溶于甲醇,下列C→D的有关说法正确的是_________。
a.使用过量的甲醇,是为了提高D的产率b.浓硫酸的吸水性可能会导致溶液变黑。
c.甲醇既是反应物,又是溶剂d.D的化学式为
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是__________(写结构简式)。
(5)已知在一定条件下可水解为和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是____________________________。24、X;Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素;M是地壳中含量最高的金属元素。
回答下列问题:
⑴L的元素符号为________;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7mol·L-1b.+29.7mol·L-1c.-20.6mol·L-1d.-241.8kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。评卷人得分六、实验题(共1题,共4分)25、肼(N2H4)和偏二甲肼(C2H8N2)常用于火箭推进剂和燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_____________________;电池工作时OH-向____________移动(填“负极”或“正极”),整个溶液的碱性_________(填“减小”或“增大”)。
(2)火箭常用N2O4作氧化剂;肼作燃料,已知:
①N2(g)+2O2(g)=2NO2(g)△H1=-66.7kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-530.5kJ·mol-1
③2NO2(g)N2O4(g)△H3=-55.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______________。
(3)“长征二号”火箭所用的燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程中燃料发生反应C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关叙述正确的是_____________________
A.该反应中N2O4是氧化剂,偏二甲肼是还原剂B.每消耗1molC2H8N2,转移电子数目为16NA
C.CO2既不是氧化产物也不是还原产物D.N2既是氧化产物又是还原产物参考答案一、选择题(共9题,共18分)1、B【分析】【分析】
由表格数据可知;温度一定时,臭氧的分解速率随溶液pH增大而增大,说明对臭氧分解起催化作用的是氢氧根离子,溶液pH一定时,臭氧的分解速率随反应温度升高而增大。
【详解】
A.由分析可知;对臭氧分解起催化作用的是氢氧根离子,故A错误;
B.由表格数据可知,在30℃、pH=4.0条件下,臭氧的浓度减少一半所需的时间为108min,则分解速率为≈1.67×10—6mol(L·s)—1;故B正确;
C.由分析可知;温度一定时,臭氧的分解速率随溶液pH增大而增大,故C错误;
D.由分析可知;温度一定时,臭氧的分解速率随溶液pH增大而增大,臭氧的分解速率随反应温度升高而增大,则无法比较40℃;pH=3.0条件下和30℃、pH=7.0条件下的臭氧的分解速率大小,故D错误;
故选B。2、B【分析】【详解】
A.浓氨水中存在平衡NH3+H2ONH3·H2ONH+OH—;所以要利用浓氨水制备氨气则需要平衡向逆反应方向移动,因此浓氨水滴入生石灰中可以制备氨气,A正确;
B.碳酸钠溶液也吸收CO2生成碳酸氢钠,应该用饱和碳酸氢钠溶液除去CO2中的SO2;B错误;
C.粗盐提纯时需要过滤;C正确;
D.四氯化碳不溶于水,所以丁装置可分离CCl4萃取碘水后的分层液体;即分液,D正确;
答案选B。3、B【分析】【分析】
【详解】
A.木炭与浓硝酸反应生成二氧化碳;二氧化氮和水;酸中N元素的化合价全部降低,则硝酸表现出强氧化性,故A不正确;
B.FeO与浓(稀)硝酸反应生成硝酸铁;二氧化氮(一氧化氮)和水;酸中N元素的化合价部分降低,还生成盐,则硝酸表现出强氧化性和强酸性,故B正确;
C.MgO与硝酸反应生成硝酸镁和水;元素的化合价不变化,则表现出酸性,故C不正确;
D.与硝酸反应生成硝酸钠;二氧化碳和水;元素的化合价不变化,则表现出酸性,故D不正确;
答案选B。4、B【分析】【分析】
观察“锂—呼吸CO2电化学装置”可知,负极:Li→Li+,失电子,发生氧化反应;正极:CO2→C2O42-,得电子,发生还原反应;总反应:2CO2+2Li===C2O42-+2Li+。
【详解】
A.根据分析可知;金属Li电极发生氧化反应,A选项错误;
B.根据分析可知,多孔碳电极变化为CO2→C2O42-,所以电极反应式为:2CO2+2e-=C2O42-;B选项正确;
C.CO2→C2O42-,C化合价降低1,转移电子数等于总失电子数,所以,每生成0.1molLi2C2O4;电路中发生转移的电子为:0.1mol×1×2=0.2mol,C选项错误;
D.该电池为原电池;将化学能转化为电能,D选项错误;
答案选B。5、C【分析】【分析】
【详解】
A.甲烷燃烧产生淡蓝色的火焰;故A错误;
B.乙烯的最简式为CH2;含碳量高,燃烧时产生明亮火焰,冒黑烟,故B错误;
C.乙炔的最简式为CH;分子中含碳量最高,燃烧时产生明亮火焰并带有浓烟,故C正确;
D.乙醇燃烧产生淡蓝色的火焰;故D错误;
故选C。6、A【分析】【详解】
A.汽油是C5~C11烃类混合物;石油的分馏和重油裂化均能得到汽油,故A正确;
B.汽油是C5~C11烃类混合物;没有固定的沸点,故B错误;
C.食用油与汽油均为有机物;互溶性好,静置后不分层,不能通过静置是否分层来判断食用油中是否混有汽油,故C错误;
D.重油裂化后得到的汽油为裂化汽油;组成中含烯烃,能和溴水发生加成反应,不能用于溴水的萃取,故D错误;
故选A。7、C【分析】A项,该电池中H2不燃烧,所以不能见到浅蓝色火焰,故A项错误;B项,根据电极总反应方程式可知H2失电子化合价升高,H2做负极,O2得电子化合价降低,O2做正极,故B项错误;C项,反应过程中电解液中水不断增多,c(OH-)减小,PH减小,故C项正确;D项,氢氧燃料电池正极反应式是O2失电子生成OH-离子,即为O2+2H2O+4e-=4OH-;故D错误;综上所述,本题正确答案为C。
点睛:本题考查燃料电池的相关知识。根据氧化还原反应判断燃料电池的正负极,根据介质的不同判断电极反应方程式的正误。8、C【分析】【分析】
【详解】
A.聚乙烯纤维的相对分子质量在10000以上;为合成高分子化合物,故A正确;
B.质谱法是纯物质鉴定的最有力工具之一;其中包括相对分子量测定;化学式的确定及结构鉴定等,故B正确;
C.硅为良好的半导体材料;能制造太阳能电池板,所以“玉兔号”月球车上的太阳能电池的材料是硅,故C错误;
D.铜绿的主要成分是碱式碳酸铜;则绿色颜料铜绿的主要成分是碱式碳酸铜,故D正确;
答案选C。
【点睛】
硅位于金属和非金属分界线处,其单质属于半导体材料,常常用于制作太阳能电、硅芯片等,而二氧化硅一般做光导纤维,玻璃,玛瑙等。9、B【分析】【分析】
【详解】
本题主要考查化学反应机理分析;侧重考查学生分析和解决问题的能力。
A.十氢萘脱氢过程都需要吸收能量;则萘的储氢过程属于放热反应,A项错误;
B.萘()的二氯代物有种,故B正确;
C.由图可知,转化为的活化能显著大于转化为的活化能;反应②比反应①更容易进行,C项错误;
D.十氢萘()中没有苯环;不属于芳香烃,D项错误。
故答案为B二、填空题(共5题,共10分)10、略
【分析】【分析】
【详解】
(1)由图像可知,A、B的物质的量减小,C物质的量增加,所以A、B为反应物,C为生成物;当反应进行到2min时,A的变化量=5-3=2mol,B的变化量=2-1=1mol,C的变化量=4-2=2mol;化学反应中,各物质的物质的量的变化值与化学计量系数成正比,因此:=2:1:2;反应的方程式为:2A(g)+B(g)⇌2C(g);
(2)反应开始至2分钟时,B的变化量=2-1=1mol,浓度的变化量为=0.2mol/L,B的平均反应速率为=0.1mol/(L∙min);
(3)反应的方程式为:2A(g)+B(g)⇌2C(g);
A.v(A)=2v(B),没有指明正逆反应速率的关系,不能判定反应是否达到平衡状态,故不选;
B.反应前后气体的总质量不变,容器的体积不变,因此容器内气体密度恒为定值,不能判定反应是否达到平衡状态,故不选;
C.该反应中,A、C的计量数相等,当v逆(A)=v正(C)时;正逆反应速率相等,体现了正逆反应速率关系,且满足速率之比和物质化学计量数成正比的关系,能够判定反应达到平衡状态,故可选;
D.容器内各组分的物质的量相等;不能说明各组分的浓度不再发生变化,无法判定是否达到平衡状态,故不选;
E.反应前后气体的总质量不变;但是反应前后气体的总物质的量不相等,所以混合气体的平均相对分子质量也在发生变化,当混合气体的平均相对分子质量不再改变时,反应达到平衡状态,故可选;
故选CE;
(4)平衡时,A的变化量=5-3=2mol,A的起始量是5mol,所以平衡时A的转化率为×100%=40%。【解析】①.2A(g)+B(g)⇌2C(g)②.0.1mol/(L∙min)③.CE④.40%11、略
【分析】【详解】
(1)氢气与氧气反应为放热反应;反应物的总能量高于生成物的总能量,则A符合;
(2)反应该反应放出的热量为则生成1mol(g)放出热量242kJ;
(3)如图,为铅蓄电池,Pb作为电池负极,失电子被氧化,电子由Pb电极流出;放电时,总反应为放电过程中消耗了氢离子,产生了水,溶液的氢离子浓度下降,酸性减弱,pH增大;
(4)①如图,为氢氧燃料电池装置,放电时向右移动,则右端通入气体b的为正极,则b为氧气,a为氢气,在负极放电,电极反应为
故答案为:氢气();
②根据题意,负极电极反应为电池每消耗5.6L(标准状况下)氢气,电路中通过的电子数目为或
故答案为:或
(5))根据表格数据可知在0~50s内的物质的量增加了0.24mol,则由物质反应转化关系可知会同时消耗的物质的量为0.12mol,则的平均反应速率
(6)a.升高温度;能加快反应速率,a符合题意;
b.增大容器的体积,导致物质的浓度减小,反应速率减小,b不符合题意;
c.加入合适催化剂;反应速率加快,C符合题意;
故选ac;
(7)根据表格中的数据可知,平衡时生成氨气0.4mol,则消耗氢气0.6mol,的转化率(α)【解析】(1)A
(2)242
(3)Pb增大。
(4)(或氢气)0.5(或)
(5)0.072(或0.0012)
(6)ac
(7)30%(或0.3)12、略
【分析】【分析】
【详解】
(1)根据题给三种物质可知;化合物A;B、C分子中官能团分别为碳碳双键、羟基、羧基;
(2)乙烯含有碳碳双键,可与溴发生加成反应而使溴水褪色,A的结构简式为CH2=CH2;丙烯CH3CH=CH2含有碳碳双键,可发生加成反应,与溴反应的方程式为CH3CH=CH2+Br2→CH3CHBr-CH2Br;反应类型为加成反应;
(3)乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O22CH3CHO+2H2O,反应类型为氧化反应。【解析】碳碳双键羟基羧基CH2=CH2CH3CH=CH2+Br2→CH3CHBr-CH2Br加成反应2C2H5OH+O22CH3CHO+2H2O氧化反应13、略
【分析】略【解析】(1)非极性。
(2)极性。
(3)→离子。
(4)极性键;非极性。
(5)离子键、极性14、略
【分析】【分析】
(1)反应达到平衡时,平衡常数表达式K=从图中可以找出,升高温度与K值变化的关系,从而确定平衡移动的方向及该反应的热效应。
(2)在500℃,从反应开始到平衡,由CH3OH的物质的量,可求出参加反应的H2的物质的量,从而求出氢气的平均反应速率v(H2)。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的
A.氢气的浓度增大;A错误;
B.正反应速率加快;逆反应速率也加快,B正确;
C.平衡正向移动;甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2)/n(CH3OH)减小;D错误。
【详解】
(1)反应达到平衡时,平衡常数表达式K=从图中可以找出,升高温度,K值减小,则平衡逆向移动,正反应为放热反应。答案为:减小;放热;
(2)在500℃,从反应开始到平衡,n(CH3OH)=nBmol,则参加反应的H2的物质的量为2nBmol,从而求出氢气的平均反应速率v(H2)==mol·L-1·min-1。答案为:mol·L-1·min-1;
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的
A.氢气的浓度增大;A错误;
B.正反应速率加快;逆反应速率也加快,B正确;
C.平衡正向移动;甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2)/n(CH3OH)减小;D错误。
则有关该体系的说法正确的是BC。答案为:BC。
【点睛】
平衡体系体积压缩到原来的的瞬间,反应物、生成物浓度都变为原来的2倍,但随着平衡的正向移动,反应物中H2、CO的物质的量减小,生成物中CH3OH的物质的量增大,从而使得新平衡时,H2、CO的物质的量比原平衡时大,但比原平衡时的2倍要小;CH3OH的物质的量比原平衡时的2倍还要大。【解析】减小放热mol·L-1·min-1BC三、判断题(共6题,共12分)15、A【分析】【详解】
植物油氢化过程就是油脂与氢气发生加成反应,正确。16、B【分析】【详解】
由于玻璃棒的主要成分中含有钠元素,灼烧时会干扰Na元素的检验,应选择洁净的铁丝或铂丝蘸取待测液灼烧,故错误。17、B【分析】【分析】
【详解】
硅是一种亲氧元素,在自然界中全部以化合态存在,故错误。18、A【分析】【详解】
天然气的主要成分为甲烷,燃烧产物只有CO2、H2O,对环境无污染,属于清洁燃料,且属于不可再生的化石燃料,选项说法正确。19、A【分析】【详解】
农村用沼气池是动物粪便,产生的沼气作燃料属于生物质能的利用,正确;20、B【分析】【详解】
的名称为2,4-二甲基-3-乙基己烷,错误。四、计算题(共2题,共16分)21、略
【分析】【分析】
(1)根据相对密度得出混合气体的平均相对分子质量,混合气体中必定有甲烷,利用混合气体的总体积得出混合气体的物质的量,算出混合气体的总质量,加入溴水后,溴水的质量增加的的是烯烃的质量,即烯烃的质量是35g,甲烷的质量为65g-35g=31g,甲烷的总物质的量为=1.875mol,设烯烃的分子式为CnH2n,利用烯烃的质量关系,(2.5mol-1.875mol)×14ng·mol-1=35g;可以算出n的值;
(2)根据分析可以得到甲烷与丁烯的物质的量之比。
【详解】
(1)混合气体的平均相对分子质量为13×2=26,必有甲烷,混合气体的物质的量为=2.5mol,混合气体的质量为2.5mol×26g·mol-1=65g,甲烷的物质的量为=1.875mol;设烯烃的分子式为CnH2n,(2.5mol-1.875mol)×14ng·mol-1=35g,解得n=4,化学式为C4H8;
故答案为:CH4、C4H8;
(2)甲烷与丁烯的物质的量之比=1.875mol∶(2.5mol-1.875mol)=3∶1;
故答案为3∶1
【点睛】
烯烃与溴水反应而烷烃不反应,因此溴水质量增加,增加的是烯烃的质量。【解析】①.CH4、C4H8②.3∶122、略
【分析】【分析】
根据原电池工作原理和电子守恒进行分析。
【详解】
由电池的总反应式为:2Zn+O2═2ZnO知,锌发生氧化反应,做原电池负极,当导线中有1mol电子通过时,理论上消耗0.25mol的O2,所以理论上消耗的O2在标准状况下的体积为0.25mol22.4L/mol=5.6L。答案:锌;5.6L。【解析】锌5.6L五、推断题(共2题,共8分)23、略
【分析】【分析】
C与甲醇反应生成D,由D的结构可知C为B与浓硝酸发生取代反生成C,则B为A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F;据此分析解答。
【详解】
(1)根据以上分析,A到B反应为氧化反应,D到E是与H2反应;故为还原反应,E到F为氨基与羧基之间发生取代反应。
故答案为氧化反应;还原反应;取代反应;
(2)B为除苯环外,不饱和度为1。那么能与Cu(OH)2反应,即含有醛基,同时含有酯基,其同分异构体中则必须有剩下一个C可以选择连在其与苯环之间,以及直接连在苯环上形成甲基有邻、间、对,共4种。即为
故答案为
(3)C中官能团为硝基-NO2、羧基-COOH;此反应为可逆反应,加过量甲醇可使平衡正向移动,使得D的产率增高,对于高分子有机物浓硫酸有脱水性,反应中甲醇既能与C互溶成为溶剂,又作为反应物,故b错误;a;c、d项正确。
故答案为硝基;羧基;a、c、d;
(4)苯丙氨酸可推出其结构简式为
经聚合反应后的高聚物即为
(5)由题目已知条件可知F中的肽键和酯基会发生水解,所以化学方程式为【解析】氧化反应还原反应取代反应硝基、羧基a、c、d24、略
【分析】【详解】
M是地壳中含量最高的金属元素;则M是Al。又因为X;Y、Z、L、M五种元素的原子序数依次增大,且X、Y、Z、L是组成蛋白质的基础元素,所以X是H、Y是C,Z是N,L是O。
(1)L是O;铝元素的原子序数是13,位于周期表的第3周期第ⅢA族;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是Al>C>N>O>H。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B分别是氨气和肼(N2H4)。二者都是含有共价键的共价化合物,氨气(A)的电子式是肼(B)的结构式是
(3)氧元素位于第ⅥA族,原子序数是8,所以Se的原子序数8+8+18=3
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年注会考试演练题目试题及答案
- 运输管理系统的发展趋势试题及答案
- 亲子活动对关系的影响试题及答案
- 2025-2030中国高纯度钛粉行业现状调查与发展前景趋势研究研究报告
- 2025-2030中国高纯乙烯(C2H4)行业现状动态与投资价值评估报告
- 2025-2030中国高端装备制造行业市场发展现状分析及发展趋势与投资战略规划报告
- 华润燃气安全培训
- 2025-2030中国高温量子点激光器市场战略规划与投资潜力趋势研究报告
- 2025-2030中国高性能钢铁行业发展分析及投资风险预测研究报告
- 2025-2030中国高度传感器行业市场发展趋势与前景展望战略研究报告
- HJ 636-2012 水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法
- 《机场运行管理》考试复习题库(含答案)
- JBT 7248-2024 阀门用低温钢铸件技术规范(正式版)
- 2024专升本英语答题卡浙江省
- 2024年荆门市水务局事业单位公开招聘工作人员招聘历年公开引进高层次人才和急需紧缺人才笔试参考题库(共500题)答案详解版
- 反食品浪费及食品安全与健康
- 【劳动教育一等奖教学案例】-二年级劳动教育-《三股辫儿我会编》活动方案
- 校园模拟法庭剧本
- 水准测量记录数据自动生成表
- 肝门部胆管癌护理查房课件
- 公司经营合同-公司代持股份协议范本新

评论
0/150
提交评论