



下载本文档
版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
广东省揭阳市普宁实验中学2021-2022学年高一化学月考试卷含解析一、单选题(本大题共15个小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求,共60分。)1..“钴酞菁”分子(直径约为1.34×10―9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是A.“钴酞菁”分子在水中所形成的分散系属悬浊液B.“钴酞菁”分子既能透过滤纸,也能透过半透膜C.在分散系中,“钴酞菁”分子直径比Na+的直径小D.“钴酞菁”分子在水中形成的分散系能产生丁达尔现象参考答案:D略2.下列实验中,没有颜色变化的是A.葡萄糖溶液与新制的Cu[OH)2悬浊液混合加热B.淀粉溶液中加入碘酒C.淀粉溶液中加入稀硫酸并加热D.鸡蛋清中加入浓硝酸参考答案:CA.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热,产生红色沉淀,故A错误;B.淀粉溶液中加入碘酒变蓝色,故B错误;C.淀粉与稀硫酸不反应,没有颜色变化,故C正确;D.鸡蛋清中加入浓硝酸,鸡蛋清变黄,发生颜色反应,故D错误。3.下列各图为周期表中的一部分,原子序数与其位置不相符的是:A. B. C. D.参考答案:C【分析】同周期元素,原子的电子层数相同,从左到右原子序数依次增加1;同一主族,由上而下,电子层数依次增加1。据此判断元素在周期表中的位置。【详解】A项:2、8、10号元素分别是氦、氧、氖元素,A项位置关系正确;
B项:2、9、16号元素分别是氦、氟、硫元素,B项位置关系正确;C项:7、12、33号元素分别是氮、镁、砷元素,C项位置关系不正确;
D项:1、4、12号元素分别是氢、铍、镁元素,D项位置关系正确。本题选C。4.下列离子在溶液中可大量共存,形成无色溶液的一组是(
)A.Cu2+、NO3-、SO42- B.Na+、OH-、Cl- C.Ba2+、Na+、SO42- D.H+、NO3-、CO32-参考答案:BA中铜离子有颜色,所以不是无色溶液,故A错误;C中硫酸钡为固体沉淀,钡离子与硫酸根不能共存,故C错误;D中,氢离子与硝酸根可以变成强酸,不能一碳酸根共存,故D错误。5.下列推断正确的是()A.铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂参考答案:D【考点】常见金属元素的单质及其化合物的综合应用.【分析】A.铁在氧气中燃烧生成Fe3O4,不会生成Fe2O3;B.钠与硫酸铜溶液反应的实质为:钠先与水反应生成氢氧化钠和氢气,生成的氢氧化钠与铜离子反应生成氢氧化铜沉淀,不会生成铜单质;C.铝能够与氧气生成一层致密的氧化物保护膜,阻止了铝继续被氧化;D.金属的化合价为0价,化合物中金属的化合价为正价,所以金属单质在反应中一定做还原剂.【解答】解:A.铝粉在氧气中燃烧生成Al2O3,而铁在氧气中燃烧的方程式为:铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2Fe3O4,生成的是Fe3O4,不是Fe2O3,故A错误;B.钠与硫酸铜溶液的反应方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,钠与硫酸铜溶液反应不会生成铜单质,故B错误;C.钠化学性质比较活泼,需要隔绝空气保存,可以保存在煤油中;而铝表面容易形成一层致密的氧化物保护膜,阻止了铝继续被氧化,所以金属铝不需要专门保存,故C错误;D.Na与氧气、水等反应时钠均作还原剂,金属在化合物中的化合价都是正价,所以金属单质参与反应时金属均作还原剂,故D正确;故选D.6.下列叙述错误的是A.0.012kg12C中含有约6.02×1023个碳原子B.1mol任何物质都含有约6.02×1023个原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一参考答案:B略7.下列变化不能直接实现的是A(HCl)B(Cl2)C(Ca(ClO)2)D(HClO)E(CO2)A.A→B
B.B→C
C.C→D
D.D→E参考答案:D8.某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是(
)A.Cr2O72-中Cr化合价是+6
价
B.反应的氧化产物是NO3-C.消耗1mol氧化剂,转移电子6mol
D.反应中Cr3+被氧化参考答案:D根据图像可知随着反应的进行硝酸根的浓度逐渐增大,说明硝酸根是生成物,因此NO2-被氧化生成硝酸根,是还原剂,Cr2O72-是氧化剂,二者发生氧化还原反应,氧化剂和还原剂的物质的量之比为1∶3,所以发生的反应为:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O,则A.Cr2O72-中Cr化合价是+6价,A正确;B.N元素的化合价升高,被氧化,则反应的氧化产物是NO3-,B正确;C.反应中Cr的化合价从+6价降低到3价,则消耗1molCr2O72-,转移电子6mol,C正确;D.Cr2O72-是氧化剂,被还原,Cr3+是还原产物,D错误,答案选D。点睛:本题考查氧化还原反应,解答时注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质。根据图像判断出硝酸根是生成物是解答的关键,注意反应前后元素化合价变化的判断。9.下列有关硫酸的性质,叙述正确的是()A.浓硫酸因具有吸水性,所以能使蔗糖炭化B.实验室用浓硫酸与亚硫酸钠反应制SO2,体现浓硫酸的强氧化性C.常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜D.浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体参考答案:C【考点】浓硫酸的性质.【分析】浓硫酸具有吸水性、脱水性和强氧化性,可用作干燥剂,可使蔗糖等因脱水而碳化,可使铁、铝等发生钝化,浓硫酸沸点高,可用于制备挥发性气体等,以此解答该题.【解答】解:A.浓硫酸具有脱水性,可使蔗糖碳化,故A错误;B.浓硫酸酸性较强,且难挥发,可用于制备二氧化硫等气体,与氧化性无关,故B错误;C.浓硫酸具有强氧化性,可使铁发生钝化,故C正确;D.浓硫酸与氨气反应,不能用于干燥氨气,故D错误.故选C.10.几种短周期元素的原子半径及主要化合价如下表所示:下列叙述正确的是:元素代号LMJQRT原子半径/nm0.8160.1600.1430.1020.0890.074最高正化合价+1+2+3+6+2不常见负化合价无无无-2无-2
A.T、Q的氢化物在通常情况下均为无色气体
B.L、M、J的单质与水反应的速率:J>M>L
C.J的最高价氧化物及其对应的水化物均具有两性
D.L、Q、T形成的简单离子的半径:Q>L>T参考答案:C略11.下列装置或操作能达到实验目的的是
A.除去乙醇中的乙酸
B.证明醋酸是弱酸
C.制取乙酸乙酯
D.石油的分馏参考答案:D略12.下列变化中,不需要破坏化学键的是A.氯化氢溶于水
B.加热使冰融化
C.加热使氧化镁熔化
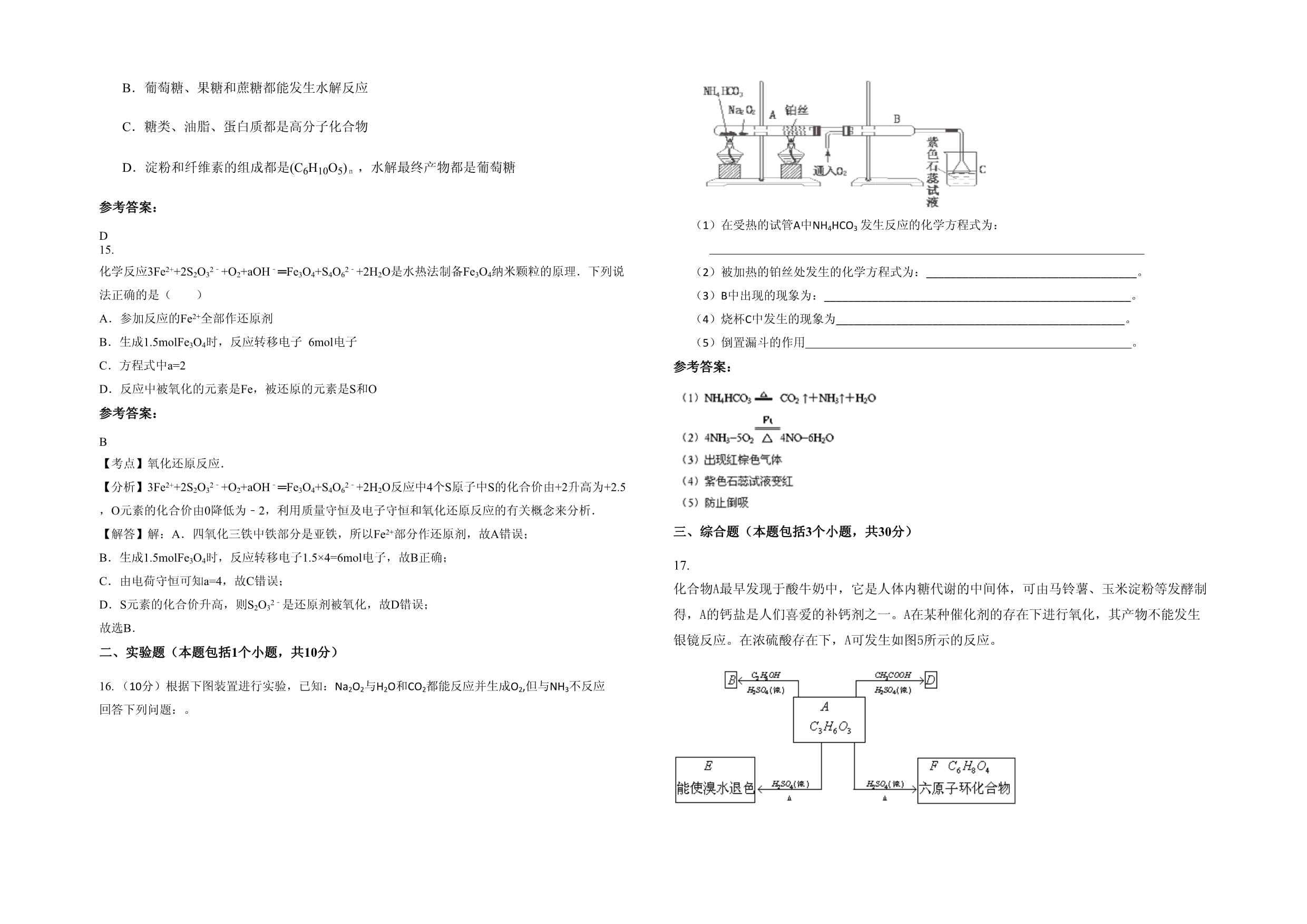
D.氯化钠溶于水参考答案:B略13.泡沫灭火器内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是() ①质量相同的两种钠盐,NaHCO3与足量的酸反应产生的CO2比Na2CO3多②质量相同的两种钠盐,与足量酸反应产生相同体积(同温、同压下)的CO2③NaHCO3与酸反应生成CO2比Na2CO3快得多④NaHCO3比Na2CO3稳定,便于长期保存. A.①③ B.②③ C.①②③ D.①②③④参考答案:A【考点】钠的重要化合物. 【分析】NaHCO3不稳定,加热易分解,NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,结合反应的方程式判断. 【解答】解:NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑, ①M(NaHCO3)<M(Na2CO3),质量相同的两种钠盐,NaHCO3物质的量较多,则与足量酸反应产生的CO2比Na2CO3多,故正确; ②由质量相同的两种钠盐,碳酸氢钠中含碳量高,生成的二氧化碳多,故错误; ③分别滴加HCl溶液,反应离子方程式为CO32﹣+H+═HCO3﹣,HCO3﹣+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故正确; ④NaHCO3不稳定,加热易分解,故错误. 故选A. 【点评】本题考查碳酸钠和碳酸氢钠的性质比较,是基础性试题的考查,试题注重基础,侧重能力的培养和训练,该题的关键是熟练掌握二者的化学性质,然后具体问题、具体分析即可,难度不大. 14.下列说法中正确的是A.油脂有油和脂肪之分,花生油、汽油、柴油都属于油脂B.葡萄糖、果糖和蔗糖都能发生水解反应C.糖类、油脂、蛋白质都是高分子化合物D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖参考答案:D15.化学反应3Fe2++2S2O32﹣+O2+aOH﹣═Fe3O4+S4O62﹣+2H2O是水热法制备Fe3O4纳米颗粒的原理.下列说法正确的是()A.参加反应的Fe2+全部作还原剂B.生成1.5molFe3O4时,反应转移电子6mol电子C.方程式中a=2D.反应中被氧化的元素是Fe,被还原的元素是S和O参考答案:B【考点】氧化还原反应.【分析】3Fe2++2S2O32﹣+O2+aOH﹣═Fe3O4+S4O62﹣+2H2O反应中4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为﹣2,利用质量守恒及电子守恒和氧化还原反应的有关概念来分析.【解答】解:A.四氧化三铁中铁部分是亚铁,所以Fe2+部分作还原剂,故A错误;B.生成1.5molFe3O4时,反应转移电子1.5×4=6mol电子,故B正确;C.由电荷守恒可知a=4,故C错误;D.S元素的化合价升高,则S2O32﹣是还原剂被氧化,故D错误;故选B.二、实验题(本题包括1个小题,共10分)16.(10分)根据下图装置进行实验,已知:Na2O2与H2O和CO2都能反应并生成O2,但与NH3不反应回答下列问题:。(1)在受热的试管A中NH4HCO3发生反应的化学方程式为:
(2)被加热的铂丝处发生的化学方程式为:___________________________________。(3)B中出现的现象为:___________________________________________________。(4)烧杯C中发生的现象为________________________________________________。(5)倒置漏斗的作用
。参考答案:三、综合题(本题包括3个小题,共30分)17.化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如图5所示的反应。图5
物质反应关系框图试写出:化合物的结构简式:A_________;B_________;D_________。化学方程式:__________________;__________________。反应类型:__________________;__________________。参考答案:
消去(或脱水)
酯化(或分子间脱水)18.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20℃)
Ag2SO4:0.796g(1)甲同学的实验如表:序号操作现象实验Ⅰ将2mL1mol?L-1AgNO3溶液加入到1mL1mol?L-1FeSO4溶液中产生白色沉淀,随后又有黑色固体产生取上层清液,滴加KSCN溶液溶液变红
注:经检验黑色固体为Ag。①白色沉淀的化学式是__________________。②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;②若该电池能维持稳定电流强度为1A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”)________g(已知F=96500C·mol-1,电量(C)=电流(A)×时间(s))。b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。③a中甲烧杯里的电极反应式是______________。④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。(3)由上述实验得出的结论为_________________________________________________。参考答案:(1)①Ag2SO4
②有黑色固体(Ag)生成,加入KSCN溶液变红
(2)①乙
②增重
0.67g
③Fe2+-Fe3+
④负
(3)Fe3+的氧化性与其浓度有关;或反应Fe2++Ag+Fe3++Ag为可逆反应(其它合理答案均可)【详解】(1)①溶液中Ag+和SO42-可生成白色沉淀Ag2SO4;②若反应发生,则有Ag和Fe3+的产生。根据有黑色固体(Ag)生成,加入KSCN溶液后变红可知产物中含有Ag和Fe3+,从而得出了Ag+氧化了Fe2+的结论。(2)甲烧杯中,Fe2+被氧化,作负极,电极反应式为Fe2+-Fe3+;乙烧杯中,Ag+被还原作正极,电极反应为:Ag++e-Ag;电解质溶液中阳离子向正极移动,阴离子向负极移动;①盐桥中钾离子向正极移动,即乙池移动;②乙烧杯中,Ag+被还原作正极,电极反应为:Ag++e-Ag,银电极质量增加,根据公式电量(C)=电流(A)×时间(s)得C=1A×600s,则增加银的质量为③甲烧杯中,Fe2+被氧化,作负极,电极反应式为Fe2+-Fe3+;④开始时Ag+被还原作正极,电极反应为:Ag++e-Ag,随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移说明银作负极,失去电子,电极反应为Ag-e-Ag+;石墨电极作
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 计算机二级JAVA考试的备考建议及试题及答案
- 消防文秘轮训方案(3篇)
- 浙江省永康市2024年八年级《语文》上学期期末试题与参考答案
- 汕头市金平区2024年八年级《语文》上学期期末试题与参考答案
- 10GWh锂电池生产项目实施方案(模板范文)
- 计算机二级C语言考试应试技巧试题及答案
- 软件缺陷分类方法试题及答案
- VFP编程重点知识复习策略试题及答案
- 了解Access的动态数据结构试题及答案
- 计算机二级JAVA字符串处理试题及答案
- 技术保障管理制度
- 【MOOC】中西医结合儿科学-河南中医药大学 中国大学慕课MOOC答案
- 2023年驾驶台资源管理真题模拟汇编(共873题)
- 2025中考英语作文预测:19个热点话题及范文
- 黑龙江省龙东地区2024-2025学年高二上学期阶段测试(二)(期中)英语试卷(含答案)
- 2024秋期国家开放大学本科《经济学(本)》一平台在线形考(形考任务1至6)试题及答案
- 2025年中考历史复习专项训练:中国近代史材料题40题(原卷版)
- 升职晋级与薪资调整管理制度
- 安徽省2024年中考数学试卷【附真题答案】
- 基层社区治理困境及化解路径研究分析-以XXX社区为例 行政管理专业开题报告
- 2024年甘肃省天水市中考地理试题卷(含答案)

评论
0/150
提交评论