



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
第三章蒸馏内容提要:介绍化工中的分离方法;用相对挥发度表示的气液平衡关系;阐明精馏的基本原理,然后通过物料衡算导出精馏塔的精馏段和提馏段操作线方程,讨论精馏塔理论塔板数和实际塔板数的计算原理和方法;回流比对精馏操作的影响与选择,最后对精馏设备作简单介绍。
第一节概述
蒸馏是低沸点组分由液相进入气相,高沸点组分留在液相的一种液气之间的传质过程,这个传质过程的理论依据就是各种物质的挥发性(液体能够挥发为蒸气的能力)的差异,或者就是沸点的差异。乙醇水体系的蒸馏分离乙醇水加热汽相:醇富集液相:水富集冷凝冷却乙醇产品废水
蒸馏操作实例:石油炼制中使用的250万吨常减压装置
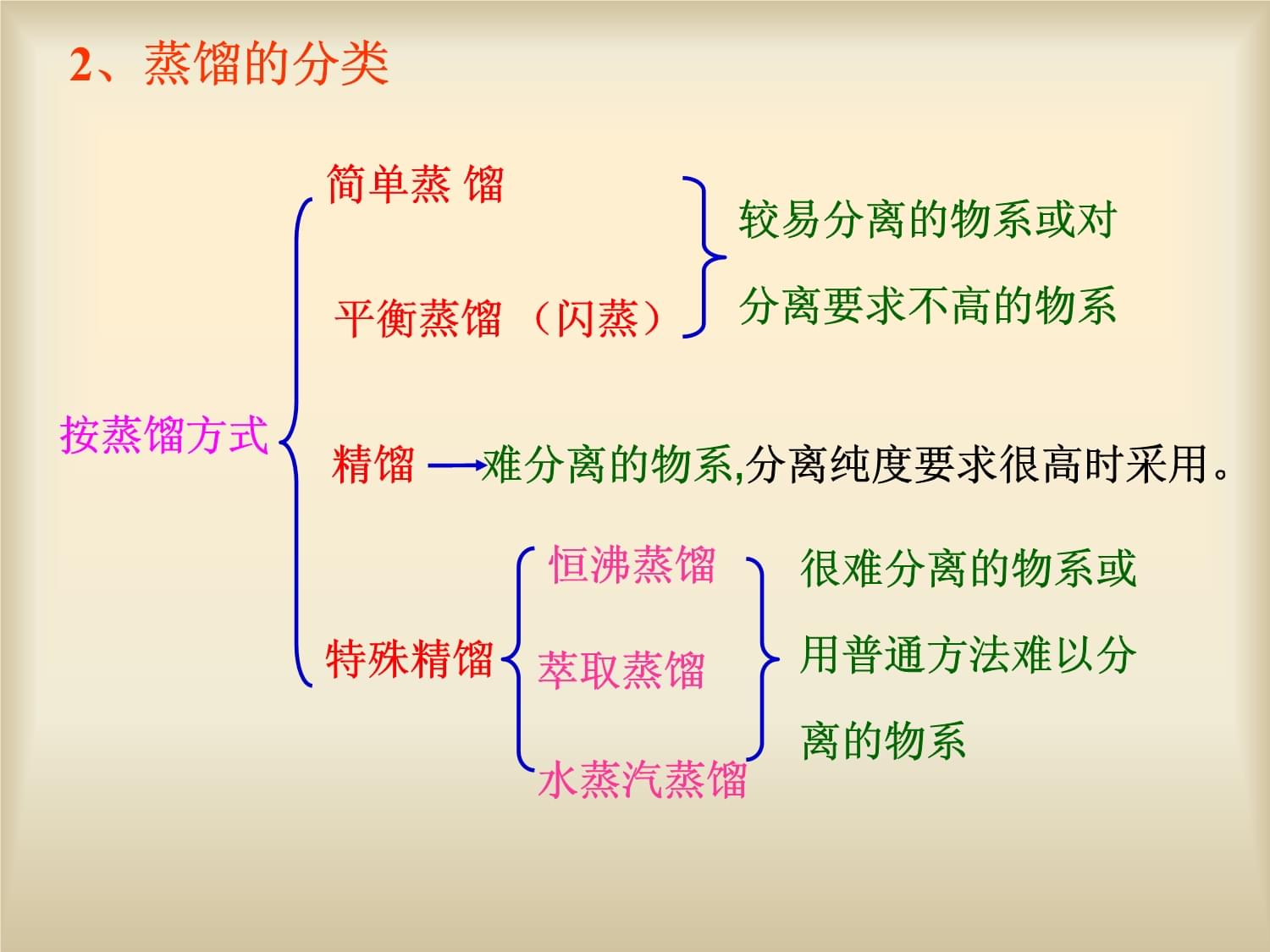
许多生产工艺常常涉及到互溶液体混合物的分离问题,如石油炼制品的分离,有机合成产品的提纯,溶剂回收和废液排放前的达标处理等等。分离混合液的方法有多种,工业上最常用的是蒸馏、精馏或萃取。1、蒸馏操作的用途2、蒸馏的分类难分离的物系,分离纯度要求很高时采用。按蒸馏方式
简单蒸馏
平衡蒸馏(闪蒸)精馏
特殊精馏
恒沸蒸馏
萃取蒸馏
水蒸汽蒸馏较易分离的物系或对分离要求不高的物系很难分离的物系或用普通方法难以分离的物系操作压强
常压下为气体的物系精馏分离常压下物系沸点较高或热敏性物质不能承受高温的情况常压
一般情况下多用常压
常压下不能分离或达不到分离要求
混合物的组分
双组分:如乙醇-水体系,苯-甲苯体系等。多组分:例如原油的分离。
操作方式
间歇:多用于小批量生产或某些有特殊要求的场合。连续:多用于大批量工业生产中。
加压减压第二节气液相平衡一、理想溶液的气液相平衡:1.理想溶液:理想溶液是混合液中指各组分的性质极相近、分子的结构相似,分子间无缔合作用、同种分子之间和异种分子间作用力相等的溶液。理想溶液在形成的过程中,既没有容积效应,又没有热效应。2.理想物系:理想物系是指由气液组成的一个体系,这个体系应符合以下条件:
(1)液相为理想溶液,各组分的蒸气压服从拉乌尔定律。
(2)气相为理想气体,遵循道尔顿分压定律。拉乌尔定律:拉乌尔定律主要描述理想溶液上方的气相中,各组分的蒸气压所遵循的规律。
Pi=Pi*xiPi
------理想溶液上方气相中某一组分的蒸气压;Pi*------同温下该纯组分的饱和蒸气压;Xi
------该组分在溶液中的摩尔分率。把拉乌尔定律应用在双组分理想溶液中,设双组分理想溶液由A、B两种组分组成,则PA=PA*xA;PB=PB*xB
,对双组分溶液
xB=1-xA
,设溶液上方蒸汽的总压为P,A、B组分的蒸汽分压为PA、
PB,则P=PA+PB=PA*xA+PB*xB,
P=PA*xA+PB*(1-xA)
P=(PA*-
PB*)xA+PB*
,2.1用饱和蒸气压表示气液平衡关系:在此式中,总压一定时,不同的温度,对应着不同的饱和蒸汽压,PA*、
PB*
,也就对应着不同的xA
,即此式反应了温度t和液相组成x之间的关系,即t-x
之间的关系。设yA是与液相平衡的蒸气中组分A的摩尔分率,则根据分压定律:yA=PPA=PPA*xA此式反映了在蒸汽总压一定时,一定温度下达到气液平衡时,气相组成与液相组成xA之间的关系。把以上两式结合起来,我们就可以得到双组分理想溶液在不同温度下的气相和液相组成。111页表4--1就是利用以上两式得到的苯—甲苯溶液的平衡气液相组成。xA=P-PB*PA*-
PB*则对纯液体,挥发度指该液体在一定温度下的饱和蒸汽压。(1)挥发度:混合液中某组分在气相中的平衡分压与该组分在溶液中的摩尔分数之比,就是该组分的挥发度,一般用v来表示。挥发度是对挥发性的定量描述。vA=PA/xA,vB=PB/xB饱和蒸气压越大,说明该液体越易挥发。2.2用相对挥发度表示气液平衡关系:(2)相对挥发度溶液中易(轻)挥发组分的挥发度与难(重)挥发组分的挥发度之比,用α表示。
相对挥发度的数值可由实验测得。理想溶液中组分的相对挥发度等于同温度下两组分的饱和蒸汽压之比。虽然两纯组分的蒸气压都在随温度变化,但其比值即α却几乎不受温度的影响,即理想溶液的αAB只与温度有关,而与溶液的浓度没有关系。
对理想溶液:对一般溶液,α除了与温度有关外,还与溶液的浓度有关,在xA从0~1的变化过程中,α也在不变地变化,所以一般可以将两个纯组分沸点温度下的相对挥发度的几何平均值作为溶液全部浓度范围内的平均相对挥发度。设α为溶液在组分A的沸点时的相对挥发度,α´为溶液在组分B的沸点时的相对挥发度,则AB溶液在全部浓度范围内的平均相对挥发度αm为:αm=αABα'AB(3)相对挥发度的意义可作为混合液能否用蒸馏方法分离以及分离难易程度的判据。
当α
>1时,yA/(1–yA)>xA/(1–xA),即yA
>xA,两组分的相对挥发度α越大,易挥发组分在气相中的浓度yA比它在液相中的浓度xA就越大,两种组分就容易分离。所以α可以用来判断混合液容易通过蒸馏的方法进行分离。当αAB=1时,yA=
xA,组分A在气液相中的浓度相等,混合液就不能用普通蒸馏的方法加以分离。(4)用相对挥发度表示气液平衡关系:α=yA/(1–yA)xA/(1–xA)将此式加以变形,则可写为:yA=αxA1+(α–1)xA-------用α表示的理想溶液的平衡气液关系-------一般溶液的平衡气液关系yA
=αmxA1+(αm–1)xAp112例题1.t-x-y图
t-x-y
图代表的是在总压P一定的条件下,相平衡时气液相组成与温度的关系。在总压一定的条件下,将组成为xf
的溶液加热至该溶液的泡点,产生第一个气泡的组成为y。继续加热,随温度升高tA
,物系变为互成平衡的气液两相,两相温度相同,组成分别为yA
和xA
。当温度达到该溶液的露点,溶液全部气化成为组成为y=xf
的气相,最后一滴液相的组成为x。二、双组分溶液的气液相平衡关系xA=P-PB*
PA*-
PB*yA=PPA*xAt/Cx(y)露点线泡点线露点泡点xAyAxf气相区液相区两相区x-y图可通过t-x-y
图作出,图中对角线(y=x)为一参考线。大多数溶液,两相平衡时,y总是大于x,平衡线位于对角线上方。平衡线偏离对角线越远,该溶液越易分离。恒沸点时,x-y线与对角线相交,该点处汽液相组成相等。2.y-x相图:
y-x相图表示在一定压力下,液相组成x和与x相平衡的气相组成y的关系。苯-甲苯气液平衡的t-x-y相图三、非理想溶液
:
相图见115页一、简单蒸馏
y原料液x蒸气xD1xD2xD3冷凝器第三节蒸馏方式简单蒸馏也称微分蒸馏,间歇非稳态操作,在蒸馏过程中系统的温度和气液相组成均随时间改变。简单蒸馏是分批(间歇)进行的,只适用于粗分,对相对挥发度大的溶液分离效果较好。
1.简单蒸馏的流程及特点
2.简单蒸馏的原理:简单蒸馏的特点是只存在物料平衡关系,一次气液平衡都没有达到,在蒸馏过程中,温度、组成随时间变化,是间歇不稳定过程。只获得一定沸程(即某个温度区段)的馏分(馏出液)。适用于轻工业和原料预处理。x2y2y1x1x1y1x2y2二、平衡蒸馏(Equilibriumdistillation)
使混合液体部分气化,并使气液两相处于平衡状态,然后将气液两相分开。又名闪蒸(flashdistillation)1、原理:平衡蒸馏是液体的一次部分汽化或蒸汽的一次部分冷凝的蒸馏操作。生产工艺中溶液的闪蒸分离是平衡蒸馏的典型应用。闪蒸操作流程:一定组成的料液被加热后经节流阀减压进入闪蒸室,液体因沸点下降变为过热而骤然汽化,汽化耗热使得液体温度下降,汽、液两相温度趋于一致,两相组成趋于平衡。由闪蒸室塔顶和塔底引出的汽、液两相即为闪蒸产品。
2、流程:闪蒸罐塔顶产品yAxA加热器原料液塔底产品
Q减压阀三、精馏:1.精馏的原理:设原料液的组成为x,经过一次简单蒸馏后,所得液体的组成为x1,则x1必然大于x,即易挥发组分的含量比原料液中的有了提高;把x1作为原料液进行二次蒸馏所得液体组成为x2
,则x2又会大x1
,……经过n次以后,所得液体中,易挥发组分的含量将会相当高,xn将会趋近于1,即接近于纯的低沸点组分。精馏塔就可以把馏分不断冷凝,再不断加热汽化,从而使混合液得到比较彻底的分量。p1172.精馏塔的工作过程:x1x03.精馏流程.预热到一定温度的原料液送入精馏塔的进料板,在每层塔板上,回流液体与上升蒸气互相接触,进行热和质的传递.提馏段:加料板及其以下的塔段.下降液体中轻组分向气相传递,气相中重组分向液相传递,完成下降液体重组分提浓。
塔顶冷凝器的作用:
获得塔顶产品及保证有适宜的液相回流.再沸器的作用:
提供一定量的上升蒸气流.精馏段:加料板以上的塔段.上升汽相中重组分向液相传递,液相中轻组分向气相传递,完成上升蒸气轻组分精制。第四节双组分连续精馏的计算连续精馏的优点:(1)操作条件稳定,使产品质量稳定,并且易实现生产过程的自动化控制;(2)节省时间,提高设备的利用率和生产能力;(3)便于回收热能,节约能量。一、关于精馏塔的三个假定:3.精馏塔已被充分保温,塔内蒸汽由蒸馏釜供给,回流液由塔顶冷凝器供给,在沸点温度下回流入塔,在塔的中间无热量损失,流体的混合热和相邻塔板的温度差可以忽略不计。1.气液两相在离开塔板时已达到平衡,这样的塔板就称为理论塔板。2.等摩尔汽化热假定(恒摩尔流假定):从每块塔板上升和回流的流体的流量不发生变化,就是恒摩尔流,即V1=V2=V3,L1=L2=L3。本章常用的符号:R=L/D------回流比n+1n-1V,ynL,xnD,xDF,xfnV`,yn+1L`,xn+1W,xw二、全塔物料衡算全塔物料衡算
对总物料:
对于易挥发组分:
F,xfW,xwn+1n-1D,xDn塔顶易挥发组分回收率:易挥发组分从塔顶采出的量占全部进料量中轻组分的百分数。
塔底难挥发组分回收率:书120页例题选精馏段n+1层以上为衡算范围:对所有的物料:
对易挥发组分:
1、精馏段操作线方程nV,ynL,xnD,xDn-1V,yn+1L,xn+1n+1即:
三、操作线方程:——回流比
——精馏段操作线方程
一定回流比时的操作线方程,其物理意义为:回流比一定时,任意塔板回流液组成xn与由下层塔板上升蒸气组成yn+1之间的关系,也就是上下层塔板气液组成之间的关系。2、提馏段操作线方程
选m层以下塔板为为衡算范围:对所有物料:
对易挥发组分:
提馏段操作线方程:mV`,ymL`,xmm-1m+1W,xwV`,ym+14.1.1进料的5种热状况
在实际生产中,引入精馏塔内的原料可能有五种不同状况,即:①低于泡点的冷液体;②泡点下的饱和液体;③气液混合物;④饱和蒸气;⑤过热蒸气。原料入塔时的温度或状态称为加料的热状态。进料热状况用进料热状态参数q值来表示,q值不同,将直接影响精馏和提馏段上升蒸气和回流液体的流量.4.1进料热状况的影响四、进料热状况和进料线方程精馏塔的进料热状况4.1.2进料热状况对操作的影响
1)定义式2)q的意义
进料液的kmol汽化潜热将1kmol进料变为饱和蒸所需热量q=泡点进料时
饱和蒸汽进料时
进料热状况也可看作进料中液相所占分数。冷液进料时汽液混合物进料时
过热蒸汽进料时
对于饱和液体、汽液混合物及饱和蒸汽三种进料而言,q值就等于进料中的液相分率。4.2q(进料)线方程
在进料板上,同时满足精馏段和提馏段的物料衡算,故两操作线的交点落在进料板上。联立两操作线方程式此式为精馏段和提馏段操作线交点的轨迹方程。因q为一常数,故一定状态进料时q线为直线.不同的加料热状态对应着不同的q值,也就对应着不同的q线.得q线方程两式相减五、理论塔板层数的求法1.逐板计算法
逐板计算法是由塔顶开始交替使用相平衡关系和操作关系进行逐板下行计算直至塔釜组成符合要求为止,计算过程每使用一次相平衡系,就代表需要一层理论板。逐板计算步骤如下:设精馏段操作线与提馏段操作线方程的交点为d(xd,yd)以精馏段为例,设气液相平衡关系为:精馏段操作线方程为:y=f(x)它表示同一层塔板上的气液相组成之间的关系它表示的是上下层塔板之间的气液相组成之间的关系
设塔顶冷凝器为全凝器(为已知值)从塔顶第一层塔板开始计算,因为塔顶为全凝器且回流为饱和液体,则有xD=y1,由此,如此重复计算,直到算出的小于等于xd,则说明第N1层为加料板。此时精馏段的塔板数为N1-1;此后,改用提馏段操作线方程与平衡方程进行交替计算,直到算出的液相组成Xm+1小于等于残液组成,因一般再沸器相当于一层理论塔板,故塔内所需要的总理论塔板数为N。2、图解法2)画操作线作法
a)精馏段操作线1)画出物系的平衡曲线和对角线yn+1=R+1Rxn+R+11xp当xn=xp时,yn+1=xp,即该线通过对角线上的P点R+1R该线的斜率为当xn=0时,y轴上截距为1xpR+1根据这三个条件中的任意两个都可把操作线画出来。b)q线方程求出两线的交点e(xf,xf),由e点及直线的钭率即可作出q线,此线与精馏段的交点为d(xd,yd)c)画提馏段操作线:ym+1=L’V’xm-V’Wxw当xm=xw
时,ym+1=L+F-WL+PxwF=P+W,则ym+1=xw即提馏段操作线要经过对角线上的C(xw,xw)点。连接C点与d点即可画出提馏段操作线。abyxxDxWcxFefdd)进料热状况对q线及操作线的影响
过冷液体:q>1,
,ef1
()饱和液体:
q=1,
,ef2
(↑)汽液混合物
:0<q<1,
,ef3
()饱和蒸汽:q=0,,ef4
(←)过热蒸汽:q<0,,ef5
()在给定回流比时,q值的变化不影响精馏操作线的位置,但明显改变了提馏段操作线的位置。f1f2f3f4f5图解方法:书126页例题
xDabefdxFxWc11‘234564.在平衡线、精馏段操作线、提馏段操作线之间画台阶,直到过W点为止,所得台阶数减1即为理论塔板数,最下的阶梯表示再沸器,加料板的位置就在跨过d点的那一层。六、回流比的影响及其选择
1、回流比对精馏操作的影响
R↑xD/R+1↓
abyxxDxWcxFefdxD/R+1
NT↓ab
下移R↑D、W不变L、V↑ab与ac重合R=∞NT=NminR↓xD/R+1↑ab、q线与平衡线交于dR=RminabyxxDxWcxFefdxD/R+1
N=∞d点夹紧点N↑ab上移Rmin<<R∞2、全回流及最少理论板层数
全回流时,D=0,F=0,W=0
;达到给定分离程度所需的理论板层数最少为Nmin,此时,没有精馏段与提馏段之分,它们都与对角线重合,为y=x。1)Nmin的求法
a)图解法
xWxDb)解析法——芬斯克(Fenske)方程式
全回流时操作线方程式为:yn+1=xn∴(yA)n+1=(xA)n,(yB)n+1=(xB)n离开任一层板的汽液组成间的关系,由相对挥发度的定义,为
若塔顶采用全凝器,(yA)1=(xA)D
,(yB)1=(xB)D
第一层板的汽液平衡关系为:第一层板和第二层板之间的操作关系为:yA2=xA1
,yB2=xB1
即同理,第二板的气液平衡关系为:将再沸器视为第N+1层塔板,重复以上过程,直到再沸器为止,可得:若令——芬斯克方程
3、最小回流比的求法
1)作图法a)对于正常的平衡曲线
xD/R+1
d(xq,yq)b)对于某些不正常的平衡曲线
由点a(xD,xD)向平衡线作切线,切线的斜率=Rmin/Rmin+1。
4、适宜回流比的选择
R=(1.1~2)Rmin5、理论板数的捷算法
(1)吉利兰图
(2)简捷法求理论板数的步骤根据物系性质及分离要求,求出Rmin,选择合适的R;求出全回流下所需理论板数Nmin
;使用吉利兰图,求出所需理论板数;确定加料位置,可把加料组成看成釜液组成求出理论板数即为精馏段所需理论板数,从而可以确定加料位置。
七、塔高和塔径的计算1、基本计算式板式塔:H=NphNp——实际塔板数h——实际塔板间距对于填料塔:H=N×HETPHETP:等板高度,指相当于一块理论塔板分离作用的填料层高度。2
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 水性涂装施工方案(3篇)
- 物资转运施工方案(3篇)
- 电力清障施工方案(3篇)
- 秋季节施工方案(3篇)
- 管道水井施工方案(3篇)
- 编施工方案价格(3篇)
- 船舱电路施工方案(3篇)
- 路肩干砌石施工方案(3篇)
- 通州花园施工方案(3篇)
- 木门及门套安装工程施工方案
- 宫颈息肉个案护理
- 新生儿感染护理查房
- 2026届高考语文专题复习-哲理诗
- (二调)武汉市2025届高中毕业生二月调研考试 生物试卷(含标准答案)
- 2024-2025学年天津市和平区高三上学期1月期末英语试题(解析版)
- 管理人员应懂财务知识
- ISO9001-2015质量管理体系版标准
- 翻建房屋四邻协议书范本
- 打桩承包合同
- 输煤栈桥彩钢板更换施工方案
- 农田水利施工安全事故应急预案

评论
0/150
提交评论