



下载本文档
版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
山西省太原市王答乡第一中学2021-2022学年高三化学下学期期末试卷含解析一、单选题(本大题共15个小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求,共60分。)1.下列有关化学用语的表示正确的是A.医用“钡餐”的化学式:BaCO3B.C1-的结构示意图:C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-D.N2的电子式:参考答案:D试题分析:A.医用“钡餐”为硫酸钡,化学式为BaSO4,故A错误;B.从Cl原子到C1-,质子数不变,所以C1-的结构示意图为,故B错误;C.NaHCO3在水中的电离方程式为NaHCO3=Na++HCO3-,HCO3-H++CO32-,故C错误;D.N2的电子式正确。故选D。6.4g铜与过量的硝酸(8mol·L一,6omL)充分反应后,硝酸的还原产物有N0、N02,反应后溶液中所含H+离子为nmol.此时溶液中所含N03一的物质的量为A.0.28molB.0.3lmolC.(n+0.2)molD.(n+0.4)mol参考答案:C3.足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与2.24LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入l0mol·L-1H2SO4溶液100mL,则继续溶解的Cu的质量为(
)A.0
B.32g
C.38.4g
D.48g参考答案:C【知识点】氧化还原反应原理的应用解析:2.24LO2(标准状况)的物质的量为0.1mol,故在反应中转移的电子数为0.4mol,在反应后的溶液中Cu(NO3)2的物质的量为0.2mol,NO3-的物质的量为0.4mol。当向溶液中加入H2SO4溶液时,H2SO4溶液会提供H+,使溶液中的NO3-具有氧化性,能继续氧化铜。根据反应:3Cu
+
8H+
+
2NO3-
==3Cu2++2NO↑+4H2On(Cu)
2mol
0.4moln(Cu)=0.3mol,质量为38.4g,故选C。【思路点拨】本题考查了NO3-在酸性条件下的氧化性,条件比较隐蔽,难度较大。4.[化学——有机化学基础](13分)PET是产量最大的合成纤维,它的化学式是:(1)PET的名称是
。(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA和EG(PTA分子量大于EG),PTA的结构简式是
;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有
种,其中一种的结构简式是
。(3)PET的水解产物EG是重要的有机化工原料。EG和有机物甲、乙、丙间存在如下的转化关系(无机反应物、生成物均已略去):
甲乙丙分子内均只含一种官能团。乙+EG→丙反应类型是
;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:参考答案:(1)聚对苯二甲酸乙二酯(2分)(“聚对苯二甲酸乙二醇酯”也给2分)(2)(2分)
2(2分)
(2分)(3)酯化反应(或取代反应)(2分)
(3分)5.中国科学家屠呦呦因创制了具有国际影响的新型抗疟药﹣﹣青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是()A.分子中含有3种官能团B.易溶于苯,难溶于水C.可与NaOH溶液发生水解反应D.其同分异构体不可能有芳香族化合物参考答案:D【考点】有机物的结构和性质.【分析】由结构简式可知分子式,含﹣COOC﹣、醚键及过氧键,结合酯、过氧化物的性质来解答.【解答】解:A.由结构简式可知有机物含有过氧键、醚基以及酯基,故A正确;B.有机物含有酯基,不溶于水,易溶于有机物,故B正确;C.含有酯基,可发生水解反应,故C正确;D.有机物含有5个环,1个C=O键,不饱和度为6,可能含有苯环,故D错误.故选D.【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、酚性质的考查,题目难度中等.6.下列叙述正确的是A.10g质量分数10%的盐酸蒸发掉5g水可得质量分数为20%的盐酸
B.25℃pH=12的Ba(OH)2溶液和0.001mol/L的硫酸溶液混合,当混合液的pH=11时,V[Ba(0H)2(aq)]:V[H2S04(aq)]=3:9
C.0.1mol/L的CH3COONa溶液中C(H+)=COH-)+C(CH3COOH)
D.常温下,0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液pH一定小于7。参考答案:B7.[2012·淮安市高三第三次统测]下列说法中正确的是(
)A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应B.升高NH4Cl溶液的温度,其水的离子积常数和pH均增大
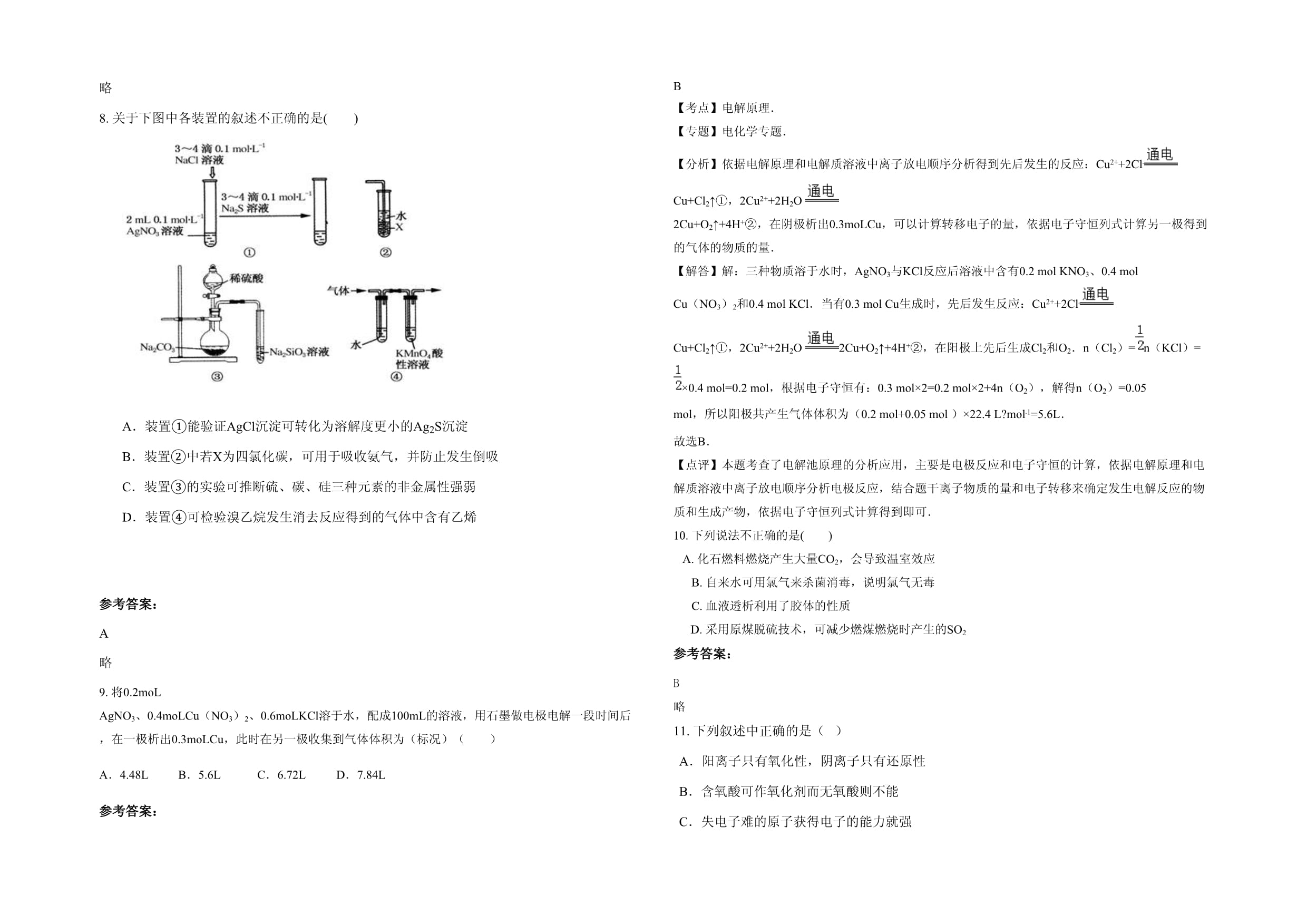
C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0D.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl参考答案:C略8.关于下图中各装置的叙述不正确的是()A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀B.装置②中若X为四氯化碳,可用于吸收氨气,并防止发生倒吸C.装置③的实验可推断硫、碳、硅三种元素的非金属性强弱D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯
参考答案:A略9.将0.2moLAgNO3、0.4moLCu(NO3)2、0.6moLKCl溶于水,配成100mL的溶液,用石墨做电极电解一段时间后,在一极析出0.3moLCu,此时在另一极收集到气体体积为(标况)()A.4.48L B.5.6L C.6.72L D.7.84L参考答案:B【考点】电解原理.【专题】电化学专题.【分析】依据电解原理和电解质溶液中离子放电顺序分析得到先后发生的反应:Cu2++2Cl﹣Cu+Cl2↑①,2Cu2++2H2O2Cu+O2↑+4H+②,在阴极析出0.3moLCu,可以计算转移电子的量,依据电子守恒列式计算另一极得到的气体的物质的量.【解答】解:三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2molKNO3、0.4molCu(NO3)2和0.4molKCl.当有0.3molCu生成时,先后发生反应:Cu2++2Cl﹣Cu+Cl2↑①,2Cu2++2H2O2Cu+O2↑+4H+②,在阳极上先后生成Cl2和O2.n(Cl2)=n(KCl)=×0.4mol=0.2mol,根据电子守恒有:0.3mol×2=0.2mol×2+4n(O2),解得n(O2)=0.05mol,所以阳极共产生气体体积为(0.2mol+0.05mol)×22.4L?mol﹣1=5.6L.故选B.【点评】本题考查了电解池原理的分析应用,主要是电极反应和电子守恒的计算,依据电解原理和电解质溶液中离子放电顺序分析电极反应,结合题干离子物质的量和电子转移来确定发生电解反应的物质和生成产物,依据电子守恒列式计算得到即可.10.下列说法不正确的是()
A.化石燃料燃烧产生大量CO2,会导致温室效应
B.自来水可用氯气来杀菌消毒,说明氯气无毒
C.血液透析利用了胶体的性质D.采用原煤脱硫技术,可减少燃煤燃烧时产生的SO2参考答案:B略11.下列叙述中正确的是(
)A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸则不能
C.失电子难的原子获得电子的能力就强D.氯气分子可作氧化剂,但也可被其他氧化剂所氧化参考答案:D略12.下列液体均处于25℃,有关叙述正确的是()A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)参考答案:B略13.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4参考答案:B略14.下列实验操作或对事实叙述正确的是A.蒸干AlCl3溶液可得纯净的AlCl3晶体B.用铜和浓度较大的硝酸反应,通过排水法可以收集到NO气体C.歆制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加KCl3饱和溶液并长时间煮沸D.为了除去NH4Cl溶液中混人的少暈FeCl3,可以加入足量的NaOH后,再过滤参考答案:B略15.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、A13+、CO32-、Cl-、OH-、NO3-。向溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有(
)A.3种
B.4种
C.5种
D.6种参考答案:C点睛:本题主要考查限定条件下的离子共存问题。解答本题的突破口是:向该溶液中加入铝粉,只放出H2,则酸溶液中不含NO3-,溶液为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,则离子可以大量共存,并结合溶液无色,则有颜色的离子不能存在来解答即可。二、实验题(本题包括1个小题,共10分)16.固体粉末X由Fe2O3、CuO组成,某研究性学习小组选用图17中装置(夹持装置已略去,实验前均已检查装置气密性)探究X与过量炭粉发生反应时,除生成外,是否还有其他气体产物。
图17请回答:
(1)若按甲→丙→丁的顺序连接装置,则____________________(填上图装置代号)装置和试剂需称量,开始反应,气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大于生成的质量,可能的原因除产生了外的其他气体产物,还可能是_________________.
(2)为使实验测得的数据更能准确说明问题,一些同学按乙→丁→戊的顺序连接装置进行实验,并且加热前先通一会气体M,停止加热后再通一会儿该气体。
①气体M可能是____________(填字母)。
a.
b.
c.
d.CO
e.
②停止加热后再通一会气体M的原因是_________________________________________。
(3)以上两套装置均存在的同样的明显缺陷是____________________________________。
(4)该小组同学设计实验(如图18)将X进行转化(每一步均反应完全):
图18
①生成气体B的化学方程式是___________________________________________。
②将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液。
写出当加入双氧水时溶液中发生反应的离子方程式:____________________________________________________________。
③若已知固体X的质量为7.2g反应中AI粉的质量是2.7g,气体B在标准状况下的体积为672ml,则固体D的质量是_________g.
参考答案:
(1)甲、丁
生成CO2气体残留在装置中(2)①c
②将装置中残留的CO2气体吹出;防止溶液发生倒吸(3)无尾气处理装置(4)①2Al+2NaOH+2H2O=2NaAlO+3H2↑
②2Fe2++H2O2+2H+=2Fe2++2H2O
③5.28三、综合题(本题包括3个小题,共30分)17.(2004·北京卷)29.有三种不同质量比的氧化铜与炭粉的混合物样品①②③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________________g。(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为____________。样品②中氧化铜质量为________________g(以
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 初中英语七年级下册统编教案 第五单元
- 以学为主教研活动方案
- 以诚相待活动方案
- 仲夏晚会活动方案
- 企业ktv活动方案
- 企业人文活动方案
- 企业全民健身活动方案
- 企业冬奥摄影活动方案
- 企业厨艺比拼活动方案
- 企业商品促销活动方案
- 2025年广东省东莞市大湾区教育研究院中考二模英语试题(含答案)
- 店铺招人合同协议
- 2025年江西赣州国有资产投资集团有限公司招聘笔试参考题库附带答案详解
- 成人患者经鼻胃管喂养临床实践指南解读
- GB/T 24477-2025适用于残障人员的电梯附加要求
- GB/T 45355-2025无压埋地排污、排水用聚乙烯(PE)管道系统
- 保险运营培训课件
- 2025年中国分布式光伏行业市场动态分析、发展方向及投资前景分析
- 江苏省无锡市2025年数学五下期末综合测试试题含答案
- 儿童青少年近视中西医结合诊疗指南解读课件
- 美国麻醉医师协会ASA困难气道管理xuli

评论
0/150
提交评论