



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
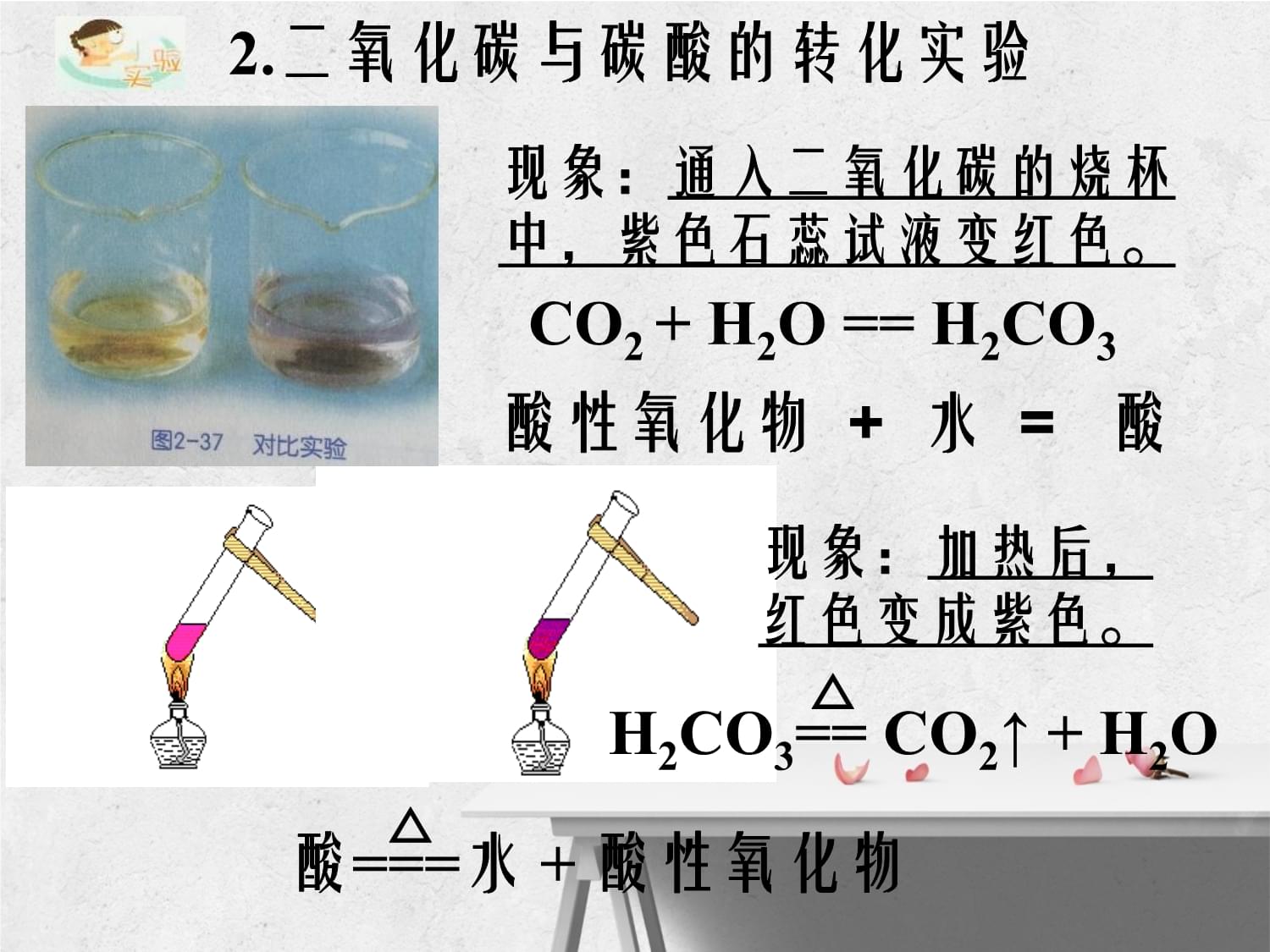
1、九年级上科学-2.5-物质的转化一、非金属及其化合物之间的转化火山喷射的产物-硫磺硫磺1、取一药匙硫黄,观察其外观: _。2、将硫黄放到燃烧匙中,在酒精灯上点燃硫黄,观察现象:_。3.把燃烧着的硫黄放进盛的氧气的集气瓶内,观察现象:_。用化学方程式: 1.硫的燃烧实验淡黄色粉末状固体微弱的淡蓝色火焰明亮的蓝紫色火焰S + O2 = SO2点燃非金属单质+氧气=非金属氧化物 (大多数是酸性氧化物)或点燃结论讨论:你还知道哪些单质可以转化为相应的化合物?(C、Fe、P、Mg)C+CO2=2CO高温C+2S=CS2高温现象:通入二氧化碳的烧杯中,紫色石蕊试液变红色。2.二氧化碳与碳酸的转化实验现象:
2、加热后,红色变成紫色。CO2 + H2O = H2CO3H2CO3= CO2 + H2O酸=水 + 酸性氧化物酸性氧化物 + 水 = 酸非金属单质酸 盐一、非金属与其化合物的转化总结:氧气水非金属氧化物碱或 盐或金属或碱性氧化物非金属氧化物 + 水 = 酸酸=水 + 非金属氧化物非金属单质+氧气=非金属氧化物 或点燃怎样用化学方程式表示下列物质的转化?CCO2H2CO3Na2CO3 想一想硫和氧气反应生成的SO2如何处理?SO2+2NaOH=Na2SO3+H2O SO2+ H2O =H2SO3 金属单质与其化合物的转化是否也和非金属相似?二、金属及其化合物的转化2、用磁铁接近混合物,你看到什么
3、现象:_。3、将混合物放进试管内,用酒精灯加热,有什么现象:_。5、生成物外观如何?_。 磁铁能否吸引生成物?_。6、用化学方程式: 铁粉被吸出生成黑色固体黑色固体不能吸引1.取少量铁粉和硫粉混合Fe + S = FeS点燃二、金属单质与其化合物的转化 金属单质+氧气=金属氧化物 (大多数是碱性氧化物)或点燃金属单质+非金属单质化合物在蒸发皿中放1小块生石灰,加水,搅拌,有什么现象?_。用化学方程式表示:变成白色粉末,放出大量热CaO + H2O = Ca(OH)2 生石灰和水的反应金属氧化物 + 水 碱怎样用化学方程式表示下列物质的转化?CaCaOCa(OH)2金属单质可溶性碱 盐氧气水酸或
4、 盐或酸性氧化物金属氧化物 + 水 =可溶性碱不溶性碱=水 + 金属氧化物总结:二、金属与其化合物的转化金属氧化物 金属单质+氧气=金属氧化物 或点燃不溶性碱(只有4种:CaO Na2O K2O BaO )一、非金属与其化合物的转化非金属单质酸盐氧气水非金属氧化物(大多数是酸性氧化物)碱或 盐或金属或碱性氧化物非金属氧化物 + 水 = 酸酸=水 + 非金属氧化物非金属单质+氧气=非金属氧化物 或点燃回顾不溶性碱=水 + 金属氧化物二、金属与其化合物的转化 金属单质+氧气=金属氧化物 或点燃金属单质可溶性碱盐氧气水酸或 盐或酸性氧化物金属氧化物不溶性碱金属氧化物 + 水 =可溶性碱(只有4种:C
5、aO Na2O K2O BaO )回顾金属还能与其化合物的转化?第二课时第5节 物质的转化回顾非金属和金属的纵向转变规律非金属单质非金属氧化物酸盐金属单质金 属氧化物碱盐?方铅矿赤铁矿孔雀石自然界中有现成的铁吗?三、金属的冶炼在自然界中,铁以化合态存在.如Fe2O3化合态(如CuO)游离态(Cu)金属单质金 属氧化物?金属的冶炼常用的方法是用碳等还原剂在高温下反应,夺取金属氧化物中的氧元素,得到金属单质信息资料具有夺取氧元素的能力的物质,初中常见的还原剂有碳、氢气、一氧化碳还原剂还原性还原剂具有的这种能具有夺取氧元素的能力注意金属的冶炼,一般先将其转化成金属氧化物特点固固加热型试管口略向下高温
6、加热可以改用酒精喷灯或用金属罩套在酒精灯上方集中火焰提高温度现象 色固体逐渐变成 色,澄清石灰水变 .黑红浑浊操作反应后应先将导管从石灰水中取出,再移去酒精灯目的防止试管降温气压减小,使石灰水倒吸导致试管炸裂一、碳还原氧化铜化学方程式C + 2CuO = 2Cu + CO2高温碳还可以在高温下与二氧化碳反应(夺取其中的氧),生成一氧化碳拓展思考如何除去一氧化碳中混有的少量二氧化碳?干燥的COC + CO2 =2CO(含有CO2)装置上注意:1.试管口略向下倾斜。2.导管要伸到试管底部。现象:黑色粉末变红,试管口有水珠.操作:停氢通氢点灯熄灯装CuO 固定试管氢气验纯通氢气停止加热 继续通氢气至
7、试管冷却 停止通氢气 加热CuOH2 + CuO = Cu + H2O3.化学方程式:二、氢气还原氧化铜思考:1.氢气还原氧化铜,为什么试管口要略向下倾斜?2.导管为什么要伸到试管底部?3.在实验前氢气为什么要验纯?4.实验开始时,为什么要先通氢气后加热?5.实验结束后,为什么要先停止加热后停止通氢气?防止生成的水倒流,使试管破裂防止氢气和空气混合加热时试管炸裂防止灼热的铜被空气中的氧气重新氧化成氧化铜让氢气与氧化铜充分接触防氢气不纯因加热而爆炸 实验要点:开始时先通氢气后加热,结束时先停止加热后停止通氢气,即: 通气加热停热停气。CO有毒,通风橱中进行,尾气处理.用燃烧法把有毒的CO转化为无
8、毒的CO2,防止污染空气,引起中毒;或用气囊收集进行再利用.1.先通一氧化碳以排尽空气防止爆炸.2.第二只酒精灯应该先点燃,确保CO不污染空气.操作:三、一氧化碳还原 氧化铜3.结束时,先熄灭第一只酒精灯通CO至试管冷却停通CO 熄灭第二只酒精灯先来后走,后来先走观察发生的现象:_化学方程式:(这个反应是炼铁的原理)红棕色变黑色,澄清石灰水变浑浊注意:这个反应要除尾气。用点燃的方法除尾气3CO +Fe2O3 = 2Fe + 3CO2高温一氧化碳还原氧化铁怎样把铁矿石炼成铁?例题:100吨含Fe2O3的质量分数为85%的铁矿石中,可炼出含铁96%的生铁多少吨?纯净物质量=混合物质量纯度1.分别写
9、出H2、C、CO还原氧化铜的化学方程式,并指出反应类型。氢气 + 金属氧化物金属 + 水碳+金属氧化物金属+二氧化碳一氧化碳+金属氧化物金属+二氧化碳练一练:H2 + CuO = Cu + H2OC + 2CuO = 2Cu + CO2 高温CO + CuO = Cu + CO2 高温置换反应置换反应由氧化铜,稀硫酸,锌粒制取铜,还可用其它什么方法?用稀硫酸和锌反应,生成氢气。再与氧化铜反应。 Zn+ H2SO4 = ZnSO4 + H2H2 + CuO = Cu + H2O用稀硫酸和氧化铜反应,生成硫酸铜,再用Zn置换。CuO + H2SO4 = CuSO4 + H2OZn+ CuSO4 =
10、 ZnSO4 +Cu金属冶炼的原理:与还原剂共热C、H2、CO金属氧化物游离态金属1.还原法(火法炼金)2.置换法(湿法炼金)活泼金属比盐中金属活泼金属盐溶液游离态金属小结:如:湿法炼铜的原理:Fe + CuSO4 = FeSO4 + Cu碳及其氧化物的三角转化关系:CCOCO2O2(不足)O2(充足)CuO等O2、CuO等C1.下列反应中是置换反应的是 ( ) A.CuO+CO=Cu+CO2 B. C.Fe3O4+4CO=3Fe+4CO2 D.Fe2O3+3CO=2Fe+3CO22.由下列实验现象可知,黑色粉末是( )A.CuO B.C C.CuO和C D.Fe2O3和C巩固练习BCC+2C
11、uO =2Cu+CO2高温3.以CuO、Fe、H2SO4为原料用两种方法制取铜,并比较优缺点。火法炼铜(商代):Fe+H2SO4=FeSO4+H2 H2 +CuO = Cu +H2O 湿法炼铜(西汉):CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu优点:比好:安全、不需加热、操作简单、 节约Fe、H2SO4原料;缺点:但制得的铜不纯,含少量铁。6464808022152985698160160561522.5 物质的转化(3) 瑶林仙境景区溶洞内的石柱、石笋等挺拔矗立,争奇斗艳,景象万千。你可知它们是如何形成的吗?瑶琳仙境位于浙江省桐庐县境内富春江畔,系一大型石灰岩
12、溶洞,规模宏大,气势壮观,瑶琳洞主洞长约900余米,面积约为28000平方米,洞内钟乳累累,气温宜人,常年保持在18度左右。 CaCO3+H2O+CO2=Ca(HCO3)2易溶于水钟乳石、石笋和石柱的形成Ca(HCO3)2=CaCO3+H2O+CO2实验:1、将一只生鸡蛋放到盛有稀盐酸的容器中,观察实验的现象:2、2分钟后,将生鸡蛋从酸中取出,用水冲洗干净,蛋壳发生了什么变化?3、解释上述变化的原因:产生气泡,一会下沉,一会又浮上来,不断地上下沉浮。 蛋壳变白,变薄。CaCO3+2HCl = CaCl2+H2O+CO2用化学方程式表示下列物质间的转化:C CO2 H2CO3 Na2CO3CaC
13、aOCa(OH)2CaCO3单质氧化物酸 碱盐研究表明:单质 氧化物 酸碱盐之间在一定条件下可以相互转化。你能找出它们之间相互转化的规律吗?金属盐 金属氧化物碱盐非金属非金属氧化物酸单质、氧化物、酸、碱、盐各类物质的相互关系:盐读图:根据此图来说说酸具有哪些性质?碱和盐呢?金属盐 金属氧化物碱盐非金属非金属氧化物酸盐盐和水盐和氢气盐和酸碱的性质?金属盐 金属氧化物碱盐非金属非金属氧化物酸盐盐和水盐和氢气盐和酸盐和碱读图:试分析制取盐的可能途径有几条?金属盐 金属氧化物碱盐非金属非金属氧化物酸盐盐和水盐和氢气盐和酸盐和碱金属和盐盐和盐提炼:十大成盐规律:一、四条横线:1、金属 非金属 盐2、金属
14、氧化物 非金属氧化物 盐3、碱 酸 盐 水4、盐 盐 新盐 新盐二、四条斜线:1、金属氧化物酸盐 水2、非金属氧化物碱盐水3、碱盐新碱新盐4、酸盐新酸新盐三、两条折线:1、金属 酸 盐 氢气2、金属 盐 金属 盐讨论:试设计制取ZnSO4四种方法:1.Zn + H2SO4 = ZnSO4 + H22.Zn + CuSO4 = ZnSO4 + Cu3.ZnO + H2SO4 = ZnSO4 + H2O4.Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O白色不溶白色溶白色溶红褐色溶蓝色溶1、沉淀的颜色物质的鉴别(熟记以下内容:)白色棕红色黑色绿色蓝色紫色2、固体的颜色颜 色 溶 液铜
15、盐(Cu2+)溶液,如CuSO4、CuCl2溶液铁盐(Fe3+)溶液,如Fe2(SO4)3、FeCl3溶液亚铁盐(Fe2+)溶液,如FeSO4、FeCl2溶液KMnO4溶液 钠盐(Na+)、钾盐(K+)、钙盐(Ca2+)、钡盐(Ba2+)等溶液 3、溶液的颜色蓝黄绿紫无色4、离子的鉴别 鉴定离子所用试剂现象 H+ OH- 紫色石蕊试液pH试纸活泼金属碳酸盐变红pH7蓝色沉淀红褐色沉淀4、离子的鉴别 AgNO3溶液和稀硝酸生成不溶于稀硝酸的白色沉淀BaCl2或Ba(OH)2或Ba(NO3)2和稀硝酸生成不溶于稀硝酸的白色沉淀4、离子的鉴别 稀盐酸和澄清石灰水有使澄清石灰水变浑浊的气体生成可溶性碱
16、溶液,湿润红色石蕊试纸有刺激性气体生成,可使湿润的红色石蕊试纸变蓝例:有一瓶未知溶液,其中可能含有H+、Cu2+、SO42-、CO32-、Cl-、OH-中的一种或几种,请你设计实验来鉴定其中所含的离子有哪些?首先考虑离子的物理性质,如:颜色其次考虑离子是否能够共存;最后考虑离子鉴定的先后顺序 (如:SO42-和Cl-共存时)。归纳与反思:含有多种溶质的溶液中离子的鉴定例题:1、不限试剂和方法的鉴别小红在厨房中看到两个装白色固体的瓶子,便问妈妈,白色固体是什么。妈妈说,一瓶是食盐,一瓶是纯碱。你能帮助小红利用多种方法对它们进行鉴别吗?主要成分:食盐 NaCI 纯碱 Na2CO3例1:用一种试剂鉴
17、别出HCl、NaCl、NaOH 三种无色溶液HClNaClNaOH紫色石蕊试液紫色红色蓝色HClNaClNaOHNa2CO3Na2CO3Na2CO3类型1:用紫色石蕊鉴别酸性、中性、碱性溶液用一种试剂鉴别:用一种试剂鉴别例2:用一种试剂鉴别K2CO3、gNO3、NaCl三种无色溶液K2CO3AgNO3NaCl稀HCl白色沉淀产生气体无变化gNO3K2CO3NaCl类型2:加一种试剂与各待测物可出现不同现象而加以鉴别用一种试剂鉴别例3:请用酚酞试液鉴别稀硫酸、Ba(OH)2、稀盐酸、NaCl四种无色溶液H2SO4Ba(OH)2HClNaCl酚酞Ba(OH)2变红无现象H2SO4HClNaCl变红
18、的Ba(OH)2溶液生成白色沉淀,且红色消失红色消失没有变化H2SO4HClNaCl类型3 :用一种试剂和待测物之间两两反应而加以鉴别例1:不用试剂如何鉴别出CuSO4、NaOH、BaCl2和HCl溶液?CuSO4 NaOH BaCl2 HClCuSO4不用试剂鉴别归纳与反思:不用任何试剂,可根据待测物的物理性质(如颜色、气味、溶解情况)先鉴别出其中的一种物质,再利用该物质鉴别其他物质。不用试剂鉴别例2:不用试剂鉴别稀盐酸、 Na2CO3、 KCl和Ca(NO3)2四种无色溶液(表示反应无现象或不反应)归纳与反思:若几种待测物没有明显特征,则可将待测物两两混合:根据相互反应的不同情况加以鉴别。(1) HCl、NaOH、 NaCl (2) BaCl2、Na2CO3、NaCl (3)HCl 、AgNO3、Na
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 承包混凝土泵送合同
- 新消防工程承包合同
- 保密协议与竞业禁止合同
- 工程测量分包合同
- 人力资源代理委托合同
- 弱电维护保养合同
- 冻品协议合同
- 贷款合同无效协议
- 光纤宽带协议合同
- 规划合同解除协议
- GB/T 4706.17-2024家用和类似用途电器的安全第17部分:电动机-压缩机的特殊要求
- 肿瘤专科护士考试题附有答案
- 河湖生态系统保护与修复工程技术导则
- 食品工厂机械与设备第二版许学勤课后习题答案
- 酒店工程部培训课件
- 省级一网统管网格化社会治理指挥手册(含事项清单)
- 高中数学选修一(人教A版2019)课后习题答案解析
- 总体国家安全观全民教育模板
- 成语故事-螳臂当车-守株待兔-历史典故讲解
- 上消化道出血病人的护理
- 转正合同模板6篇

评论
0/150
提交评论