



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
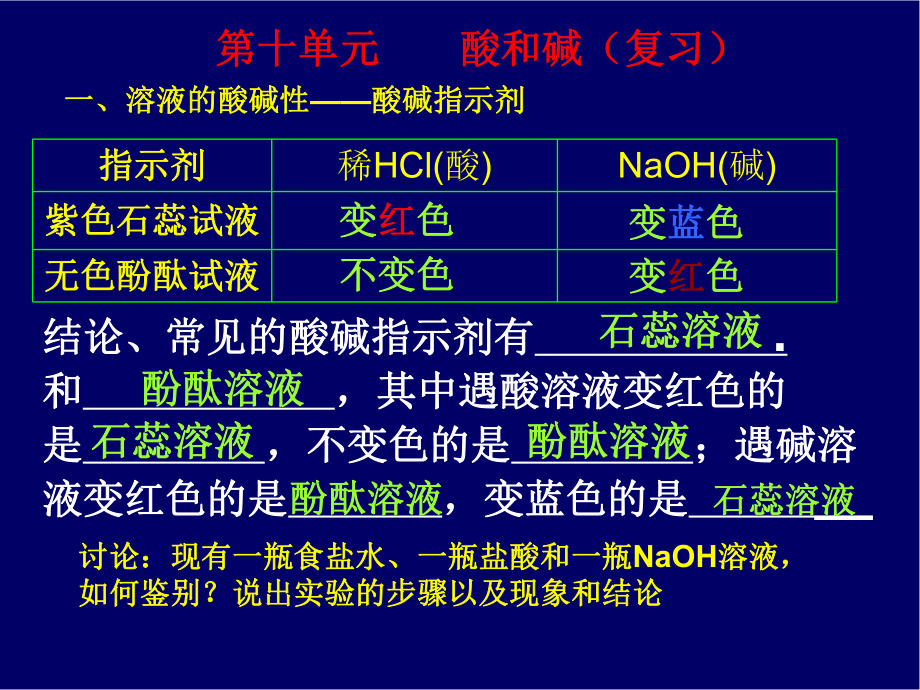
1、第十单元第十单元 酸和碱(复习)酸和碱(复习)执教:王家河中学执教:王家河中学 赵建明赵建明结论、常见的酸碱指示剂有结论、常见的酸碱指示剂有 . 和和 ,其中遇酸溶液变红色的,其中遇酸溶液变红色的是是 ,不变色的是,不变色的是 ;遇碱溶;遇碱溶液变红色的是液变红色的是 ,变蓝色的是,变蓝色的是 _石蕊溶液石蕊溶液酚酞溶液酚酞溶液石蕊溶液石蕊溶液石蕊溶液石蕊溶液酚酞溶液酚酞溶液酚酞溶液酚酞溶液指示剂指示剂稀HCl(酸)NaOH(碱)紫色石蕊试液紫色石蕊试液无色酚酞试液无色酚酞试液一、溶液的酸碱性一、溶液的酸碱性酸碱指示剂酸碱指示剂第十单元第十单元 酸和碱(复习)酸和碱(复习)变变红红色色变变蓝蓝
2、色色变变红红色色不变色不变色讨论:现有一瓶食盐水、一瓶盐酸和一瓶讨论:现有一瓶食盐水、一瓶盐酸和一瓶NaOH溶液,溶液,如何鉴别?说出实验的步骤以及现象和结论如何鉴别?说出实验的步骤以及现象和结论无色酚酞无色酚酞ABC装入装入C试管内的试管内的液体是液体是NaOH溶液溶液AB装入装入A试管内的试管内的 液体是液体是食盐水食盐水装入装入B试管内的试管内的液体是液体是盐酸盐酸讨论:现有一瓶食盐水、一瓶盐酸讨论:现有一瓶食盐水、一瓶盐酸和一瓶和一瓶NaOHNaOH溶液,如何鉴别?说出溶液,如何鉴别?说出实验的步骤以及现象和结论实验的步骤以及现象和结论二、盐酸(二、盐酸(HCl)1、盐酸是、盐酸是_的
3、俗称的俗称,是是_气体的水溶液。气体的水溶液。2. 纯浓盐酸是纯浓盐酸是_色液体色液体,有有_气味。气味。 工业盐酸因含有杂质(主要是三价铁离子)而带工业盐酸因含有杂质(主要是三价铁离子)而带_色。色。3.有有_性,挥发出性,挥发出_气体,因而把浓盐酸长期暴气体,因而把浓盐酸长期暴露在空气中露在空气中,溶液的质量会溶液的质量会_。 该气体在空气中为什该气体在空气中为什么会生成白雾呢?其原因是么会生成白雾呢?其原因是 _ _。 氢氯酸氢氯酸氯化氢氯化氢无无刺激性刺激性黄黄挥发挥发氯化氢氯化氢减少减少浓盐酸挥发出来的氯化氢跟空气中的水蒸气结合形成盐浓盐酸挥发出来的氯化氢跟空气中的水蒸气结合形成盐酸
4、的小液滴酸的小液滴三、硫酸(H2SO4)1、物理性质:、物理性质:浓硫酸是一种浓硫酸是一种_色、色、_的的_状状_体体,不易不易_。2、浓硫酸的特性、浓硫酸的特性 (1) 有强的有强的吸水性吸水性作作_剂(不能干燥剂(不能干燥_) 长期放在空气中质长期放在空气中质量会量会_,浓度会浓度会_。 (2)有强的有强的脱水性脱水性使有机物碳化使有机物碳化 (3)有强的有强的腐蚀性腐蚀性如不慎沾上浓硫酸如不慎沾上浓硫酸,应立即应立即: _ _。3、浓硫酸的稀释、浓硫酸的稀释 增加增加无无粘稠粘稠油油液液挥发挥发干燥干燥减少减少用干布抹去,然后用大量的水冲洗,用干布抹去,然后用大量的水冲洗,最后涂上最后涂
5、上3%5%的的NaHCO3溶液溶液氨气氨气归纳:浓硫酸正确稀释方法:归纳:浓硫酸正确稀释方法:只能把浓硫酸沿只能把浓硫酸沿烧杯壁慢慢地倒烧杯壁慢慢地倒进水中,并不断进水中,并不断地搅拌;地搅拌;禁止将水倒入浓硫禁止将水倒入浓硫酸里酸里盐酸(盐酸( )硫酸(硫酸( )颜色、状态颜色、状态打开瓶盖打开瓶盖后的现象后的现象气味气味挥发性挥发性特性特性无色无色黏稠油状液体黏稠油状液体无气味无气味有刺激性气味有刺激性气味无明显现象无明显现象瓶口附近有白雾瓶口附近有白雾出现出现不易挥发不易挥发易挥发易挥发无色无色液体液体盐酸和硫酸性质的比较盐酸和硫酸性质的比较HClH2SO4有吸水性、脱水性、有吸水性、脱
6、水性、 氧化性和强腐蚀性氧化性和强腐蚀性有强烈的腐蚀性有强烈的腐蚀性项目项目反应情况反应情况酸酸盐酸盐酸硫酸硫酸使石蕊试液使石蕊试液变变_色色 变变_色色跟活泼金属反应跟活泼金属反应生成生成_和和_Zn + HCl Fe + H2SO4跟碱性氧化物反应跟碱性氧化物反应生成生成_和和_Fe2O3 + HCl CuO + H2SO4跟碱反应跟碱反应生成生成_和和_(中和反应中和反应)Mg(OH)2 + HClCa(OH)2+ H2SO4跟盐反应跟盐反应生成生成_和和_Na2CO3 + HCl_ NaHCO3 + H2SO4四、酸的化学性质四、酸的化学性质红红红红新酸新酸盐盐氢气氢气盐盐水水盐盐水水
7、新盐新盐ZnCl2+H22_FeSO4+H2 _2FeCl3+3H2OMgCl2+2H2O2_2NaCl+H2O+CO2 CuSO4+H2OCaSO4+2H2ONa2SO4+2H2O+2CO2 2_62探究三、酸与金属氧化物的反应能反应吗?探究三、酸与金属氧化物的反应能反应吗?现象现象化学方程式化学方程式铁锈铁锈+盐酸盐酸铁锈渐铁锈渐 ,溶液由,溶液由_色变成色变成 色。色。铁锈铁锈+硫酸硫酸铁锈渐铁锈渐 ,溶液由,溶液由_色变成色变成 色。色。氧化铜氧化铜+硫酸硫酸黑色固体逐渐_,溶溶液由液由_变成变成_色色由此得出的结论是:酸能与某些由此得出的结论是:酸能与某些_反应,生成反应,生成_消失
8、消失消失消失消失消失黄黄黄黄蓝蓝无色无色无色无色无色无色Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2OCuO+H2SO4=CuSO4+H2O金属氧化物金属氧化物盐和水盐和水1)上述实验若与铁锈反应后,盐酸过量,将出现的现象是)上述实验若与铁锈反应后,盐酸过量,将出现的现象是 ,相应的化学方程为,相应的化学方程为 。铁钉表面有气泡产生铁钉表面有气泡产生 Fe+2HCl=FeCl2+H22)用酸可以清除金属制品表面的锈,除锈时能否将金属制品长)用酸可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么时间浸在酸中?为什么?_不能不能
9、, 因为金属能与酸反应而受到腐蚀因为金属能与酸反应而受到腐蚀七、氢氧化钠和氢氧化钙的物理性质及用途七、氢氧化钠和氢氧化钙的物理性质及用途碱碱俗名俗名物理性质物理性质用途用途氢氧化钠氢氧化钠( )是一种是一种_色色_体体,极极易易_,并放出并放出_;易吸收空气中的易吸收空气中的_而而_,因此因此可作某些气体的可作某些气体的_.是一种是一种_,广泛应用于广泛应用于_ _ _ _ 和和_等工业等工业.生生活中可用来活中可用来_.潮解潮解NaOH苛性钠苛性钠 火火 碱碱 烧烧 碱碱白白固固溶于水溶于水热量热量水蒸气水蒸气印染印染干燥剂干燥剂工业原料工业原料肥皂肥皂去除油污去除油污石油石油 造纸造纸 纺
10、织纺织氢氧化钙氢氧化钙 _是白色是白色_状固体、状固体、_溶于水、其水溶于水、其水溶液俗称溶液俗称_用于用于_、_ _, 改良改良_配制配制波尔多液波尔多液Ca(OH)2 消石灰消石灰熟石灰熟石灰石灰水石灰水粉末粉末微微建筑材料建筑材料制漂白粉制漂白粉 氢氧化钠氢氧化钠酸性土壤酸性土壤CaO +H2O=Ca(OH)2讨论八、碱的化学性质八、碱的化学性质实验操作实验操作现象现象反应反应方程方程式式结论结论与指示与指示剂的作剂的作用用紫色石蕊紫色石蕊与指示剂与指示剂的作用显的作用显示示酸碱性酸碱性无色酚酞无色酚酞与非金与非金属氧化属氧化物的反物的反应应Ca(OH)2 +CO2 (回忆)回忆)能与非
11、能与非金属氧金属氧化物的化物的反应,反应,生成生成 盐盐和和水水NaOH+CO2 NaOH+SO3变蓝色变蓝色变变红红色色变浑浊变浑浊2NaOH + CO2 =Na2CO3 + H2O2NaOH + CO2 =Na2SO4 + H2OCa(OH)2 +CO2 = CaCO3 +H2O故氢氧化钠必须故氢氧化钠必须_保存。如何检验放置在空气中的保存。如何检验放置在空气中的固体氢氧化钠是否变质呢?请你写出操作方法和现象。固体氢氧化钠是否变质呢?请你写出操作方法和现象。密封密封B(A)解析解析 往集满往集满CO2的瓶内倒入浓的瓶内倒入浓NaOH后,瓶内发生反应:后,瓶内发生反应:2NaOH + CO2
12、 = Na2CO3 + H2O反应后瓶内压强减小,瓶外大气压大于瓶内气体压强,使空反应后瓶内压强减小,瓶外大气压大于瓶内气体压强,使空气通过导管进入气球,气球膨胀变大。气通过导管进入气球,气球膨胀变大。例例3 如图所示如图所示,在烧瓶内收集满,在烧瓶内收集满CO2气体,气体,烧烧瓶用带导管(导管一端事先已绑好一个气球)的瓶用带导管(导管一端事先已绑好一个气球)的胶塞塞紧。当拔开胶塞迅速倒入浓氢氧化钠溶液胶塞塞紧。当拔开胶塞迅速倒入浓氢氧化钠溶液后,立即塞子紧瓶塞并振荡,可观察到气球后,立即塞子紧瓶塞并振荡,可观察到气球 _, 原因是原因是_。气球气球气球膨胀变大气球膨胀变大这一实验现象可以帮助
13、我们判断氢氧化钠与二氧这一实验现象可以帮助我们判断氢氧化钠与二氧化碳反应的发生化碳反应的发生 .瓶内气体压强小于瓶外大气压瓶内气体压强小于瓶外大气压。中和反应的探究中和反应的探究:五五.中和反应:中和反应:_跟跟_反应反应,生成生成_和和_的反应。的反应。1、下列反应属于中和反应的是、下列反应属于中和反应的是_. (1)Cu(OH)2 + 2HCl=CuCl2 + 2H2O (2)Fe2O3 + 6 HCl= 2 FeCl3 + 3 H2O (3)Zn + 2HCl = ZnCl2 + H2 (4)Fe(OH)3 + 3HCl = FeCl3 + 3H2O (5)CaO + H2O = Ca(OH)2 (6)HCl + AgNO3 = AgCl + HNO3 (7)CaCO3 高温高温 CaO +CO21、4酸酸碱碱盐盐水水1. 在使用在使用pH试纸测定某碱溶液的试纸测定某碱溶液的pH时,若时,若事先用蒸馏水把试纸润湿后再测,则实际测事先用蒸馏水把试纸润湿后再测,则实际测的值与真实质比较(的值与真实质比较( )A.偏大偏大 B.偏小偏小 C.相同相同 D.可能偏大、偏小或相同可能偏大、偏小或相同2,下列溶液酸性最强的是(下列溶液酸性最强的是( )A. pH=7 B. pH=1 C.
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 启发思维2025导游证资格考试试题及答案
- 2025年市场需求分析技巧试题及答案
- 理论结合实践的营养师试题及答案
- 演出经纪人资格证考试的成功案例:试题及答案
- 营养师资格证考试新手指南及试题答案
- 结合实际的营养师试题及答案
- 2024年营养师考试复习时的试题及答案
- 演出经纪人资格证全科知识布局与试题及答案
- 演出经纪人资格证考试全攻略与试题及答案
- 掌握导游证资格考试2025年试题及答案
- JT-T-445-2021汽车底盘测功机
- 2024光伏发电题库110道填空题含答案
- 2024中煤陕西能源化工集团有限公司招聘笔试冲刺题(带答案解析)
- 农村自建房包工包料合同范本
- 西游记偷吃人参果
- 中职生交通安全课
- 2024年大唐杯5G必考试题库 (带答案)
- 东北三省三校2024年高三二模(第二次联合模拟考试)英语试卷(含标准答案)
- (高清版)DZT 0279.30-2016 区域地球化学样品分析方法 第30部分:钨量测定 碱熔-电感耦合等离子体质谱法
- 从局部到整体:5G系统观-完整版
- 广东省华侨中学2023-2024学年高二下学期3月月考英语试卷

评论
0/150
提交评论