



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
化学能与电能
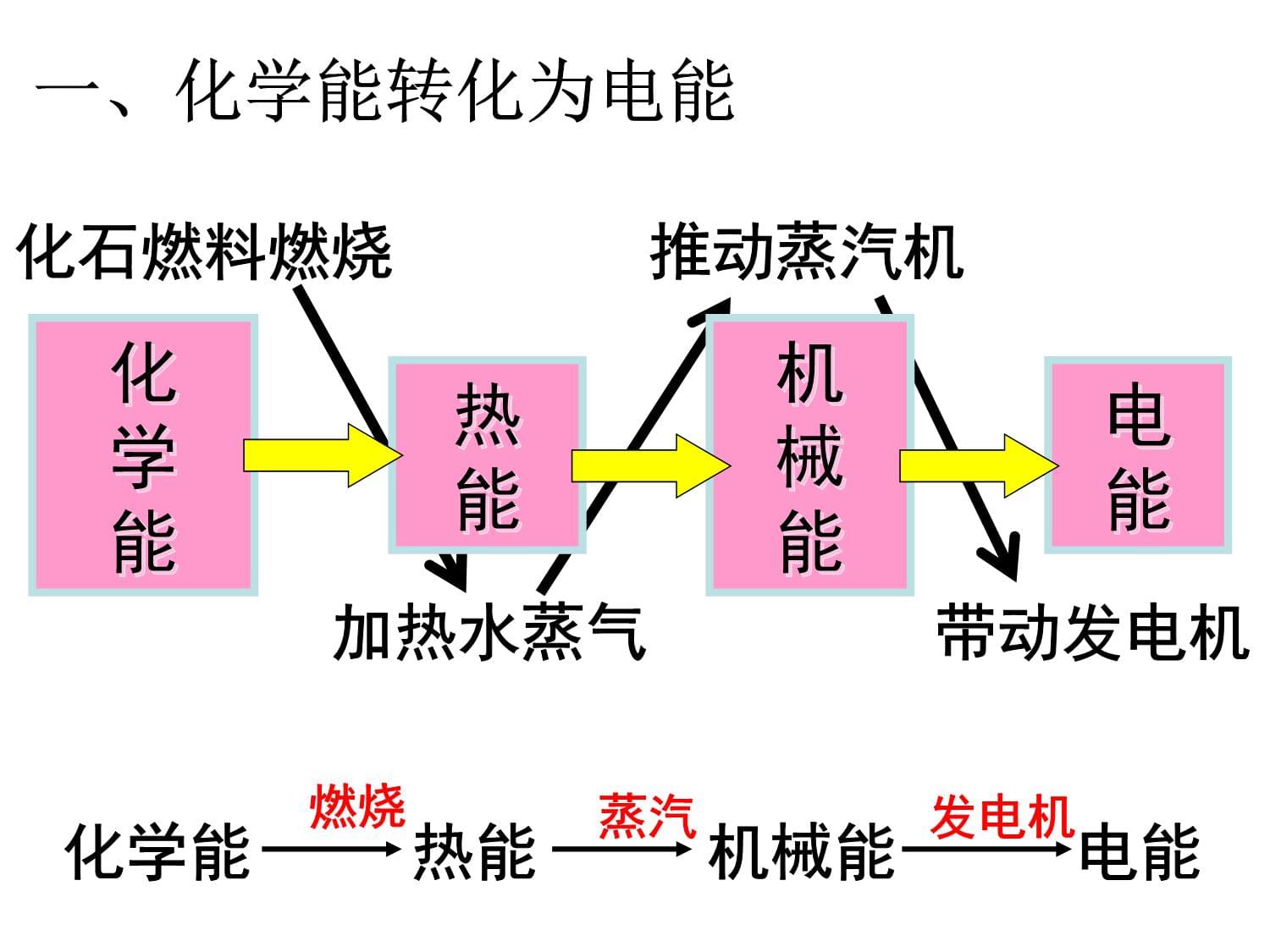
病例分析一位年轻的化学家来看望格林太太,并为格林太太揭开了病因。化学家发现了什么?你能为格林太太开个药方吗?1、火力发电原理及过程一、化学能转化为电能化石燃料燃烧推动蒸汽机加热水蒸气带动发电机化学能
热能
机械能
电能
一、化学能转化为电能化学能热能
机械能
电能燃烧蒸汽发电机2、火力发电的化学深层本质分析燃烧氧化还原反应氧化剂与还原剂之间发生电子的转移火力发电将化学能经一系列能量转化为电能旧键断裂和新键形成、体系能量变化过程关键本质本质引起我国煤炭资源丰富,廉价方便,又快捷方便.思考:火力发电有何弊端?①产生烟尘和废气,造成空气污染;②SO2形成酸雨;③CO2加剧温室效应;④煤炭储量有限,是非再生能源;⑤经多次转换,能量损耗大,燃料的利用率低。思考:假设你是电力工程师,面对这些利与弊,你会如何应对呢?a、改进火力发电b、研究新的发电方式
方式之一就是尝试将化学能直接转化为电能。就像电池。其好处就是减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便。燃烧蒸汽发电机化学能热能
机械能
电能?能否找到一种装置将化学能直接转化为电能呢?还原剂氧化反应氧化剂还原反应e-如何将氧化还原反应产生的能量直接转化为电能?元素化合价升高,失去电子,还原剂被氧化得到氧化产物,发生氧化反应;(升,失,还,还原剂被氧化,发生氧化反应)元素化合价降低,得到电子,氧化剂被还原得到还原产物,发生还原反应。(降,得,氧,氧化剂被还原,发生还原反应)背回忆:没有现象,因为Cu与稀硫酸不反应Cu片下面进行探究实验①将一Zn片平行插入稀H2SO4中,有什么现象?实验现象:锌片溶解,有气泡产生Zn+H2SO4=ZnSO4+H2↑Zn+2H+=Zn2+
+H2↑(还原剂)(氧化剂)Zn片实验现象:铜片上有气泡产生,锌片不断溶解电流表发生偏转
②若将Zn片,Cu片用一导线连接再插入稀H2SO4中,有什么现象?思考与交流:既然铜片上产生了气体(H2),哪么H+得到的电子是铜失去的还是锌失去的?如何检验?请设计出你的实验方案。方案1:称量实验前后铜片或锌片的质量。方案2:观察溶液的颜色,看有无Cu2+生成ZnCuA稀H2SO4e-e-III负极正极阴离子移向负极阳离子移向正极电子从负极流向正极电流从正极流向负极失电子得电子H+思考:你认为这个过程能量是如何转化的?化学能直接转化为电能锌片Zn-2e-=Zn2+(氧化反应)2.原电池电极反应式:负极:正极:总反应:Zn+2H+=Zn2++H2↑铜片2H++2e-=H2↑(还原反应)CuZnA稀硫酸三、原电池1、定义:把化学能转变为电能的装置.2、原电池的电极负极:失去电子,氧化反应。正极:得到电子,还原反应。正极负极4、原电池中电子的运动方向:从负极到正极3、原电池中电流方向:从正极到负极电子由Zn→导线→铜片→H+定向移动产生电流,故电流表的指针发生偏转如何书写电极反应方程式
书写电极反应式,注意几点:
(1)电极反应是一种离子反应,遵循书写离子反应式的一切规则;(2)负极失电子所得氧化产物、正极得电子所得还原产物,与溶液的酸碱性有关;(3)两极电极反应式中的电子得失数目(一般)保持相等。
(4)两极反应相加得到总反应,总反应减去负极反应得到正极反应、总反应减去正极反应得到负极反应。如何书写电极反应方程式负极(锌片):
Zn-2e-=Zn2+负极(锌片):
Zn-2e-=Zn2+正极(石墨):
2H++2e-=H2↑正极(铜片):
Cu2++2e-=Cu总反应:Zn+2H+=Zn2++H2↑总反应:
Zn+Cu2+=Zn2++Cu(Zn+H2SO4=ZnSO4+H2↑)(Zn+CuSO4=ZnSO4+Cu)(1)能自发地发生的氧化还原反应:(2)两导体作电极:①两种活动性不同的金属(或一种金属和
一种非金属导体---如石墨和Pt等)②两种非金属单质-石墨。(燃料电池电极)(3)电极插入电解质溶液(酸、碱、盐):参与电极反应或构成内电路
(4)
形成闭合回路。两电极用导线连接,或接触。3、原电池的构成条件:
稀硫酸探究:原电池的构成条件?条件一:有活泼性不同的两种金属或非金属
稀硫酸
稀硫酸×√
酒精溶液
稀硫酸
形成条件二:电极需插进电解质溶液中×
稀硫酸
稀硫酸×形成条件三:必须形成闭合回路4、正、负极的判断方法负极正极两极材料两极反应实验现象离子电子的移动方向离子移动方向e-I较活泼金属较不活泼金属/非金属失去电子;氧化反应金属溶解/质量减少得到电子;还原反应有气泡产生/质量增加负极正极阴离子移向负极阳离子移向正极2、将锌片和铜片用导线连接置于同一稀H2SO4溶液中,下列各叙述正确的是()A、正极附近SO42-的浓度逐渐增大B、负极附近SO42-的浓度逐渐增大C、电解质溶液的pH逐渐减小D、电解质溶液的pH逐渐增大BDAAAAAZnCuFe石墨
ZnCuFeCuCuAgCuSO4溶液稀H2SO4
稀H2SO4
①②③酒精溶液AgNO3溶液稀HCl
④⑤⑥√√练习AZnFe3、判断下列哪些装置构成了原电池?若是,指出正负极名称,并写出电极反应式和总反应。√√(1)锌片插入稀硫酸中,被腐蚀。(2)锌片在锌-铜-稀硫酸的原电池中作为负极,也被腐蚀。请问哪个反应速率更快?思考题14、原电池的应用:①加快氧化还原反应的速率Zn稀硫酸CuZnA有a、b、c、d四块金属片,浸入稀硫酸中,用导线两两相连组成原电池①a、b相连后,a极金属不断溶解②c、d相连后,外电路电流由d到c③a、c相连后,c极产生大量气泡④b、d相连后,d极发生氧化反应据此,判断四种金属的活动性顺序是a>c>d>b思考题24、原电池的应用:②比较金属的活动性强弱原电池化学能电能化学电池氧化还原反应二、发展中的化学电源干电池碱性电池蓄电池锂离子电池燃料电池1、干电池负极:锌筒2MnO2+2NH4++2e-=Mn2O3+2NH3↑+H2O一次性电池正极:石墨棒最早使用的电池:锌锰电池Zn-2e-=Zn2+碱性锌锰电池用湿的KOH代替NHCl4作电解质缺点:使用寿命短,易泄露碱性锌锰干电池正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-负极:Zn+2OH--2e-=Zn(OH)2电池总反应式:Zn+2MnO2+2H2O=Zn(OH)2
+2MnO(OH)
2.充电电池铅蓄电池最早使用的充电电池:(又称二次电池)铅蓄电池构造示意图电极反应式(放电时)负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
铅蓄电池PbO2+Pb+2H2SO42PbSO4+2H2O放电充电总反应:放电充电镍镉电池优缺点:密封式、体积小、寿命长。具有残留性记忆,可重复使用500次以上,体积小;但镉有致癌作用,如不回收,会产生严重污染负极:Cd正极:NiO(OH)电解质:KOH镍氢电池应用:广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等镉有致癌作用,有被镍氢电池取代的趋势。锂离子电池新一代可充电的绿色电池。是笔记本电脑,移动电话,摄象机等低功耗电器的主流电源。【练习】铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,电池放电时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列对电池放电时的分析正确的是(
)A.Pb为正极被氧化B.电子从PbO2
经外电路流向PbC.负极的电极反应式为:
Pb+SO42--2e-=PbSO4↓
D.电解质溶液pH不断减小C3、燃料电池特点:是一种高效,环境友好的发电装置原理:将和反应所放出的直接转化为燃料氧化剂化学能电能与其他电池的区别:反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂氢氧燃料电池电极:惰性金属Pt负极:通入H2正极:通入O23、燃料电池总反应式:2H2+O2=2H2Ob类:电解质溶液为30%的氢氧化钾溶液.负极:
2H2–4e-+4OH-
=4H2O正极:O2+4e-+2H2O=4OH-a类:电解质溶液为稀硫酸.负极:
2H2–4e-=4H+正极:O2+4e-+4H+
=2H2O总反应式:2H2+O2=2H2O1.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是(
) A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a D.该电池的总反应:2H2+O2=2H2O电极aH2O2电极bD2.以乙醇为原料制作的燃料电池,即乙醇燃料电池,相比于甲醇燃料电池在安全性方面具有很大优势。乙醇燃料电池的总反应式:C2H5OH+3O2=2CO2+3H2O。下列说法不正确的是(
)A.C2H5OH在电池的负极上参加反应B.1mol乙醇被氧化转移6mol电子C.在外电路中电子由负极沿导线流向正极D.电
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 非营利组织家庭教育推广计划
- 药品管理科年度医疗质量监控计划
- 教育机构微信公众号内容管理服务协议范文
- 工地安全与施工劳务合同
- 课题申报书:高职院校校园文化与企业文化的渗透融合问题研究
- 电力工程资金审核与管理计划
- 房屋买卖委托协议书范本
- 三方债权转让合同
- 家庭装饰装修合同新
- 公司工人股份协议书
- 建筑工地值班制度
- 《中央八项规定精神学习教育》专项讲座
- 2024年新人教版九年级上册化学教学课件 6.1.2 碳单质的化学性质
- Unit 6 Topic 2 Section C 课件 -2024-2025学年仁爱科普版八年级英语下册
- 2025年质谱分析考试题及答案
- 大一高数试题及答案(共16页)
- 吉林大学地球科学学院09版培养方案.doc(2010.11.30)
- 工程信号基础
- 某化工项目总承包合同(epc)范本
- 年度产品研发计划表
- 高校学生干部能力与素质的培养.ppt

评论
0/150
提交评论