



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
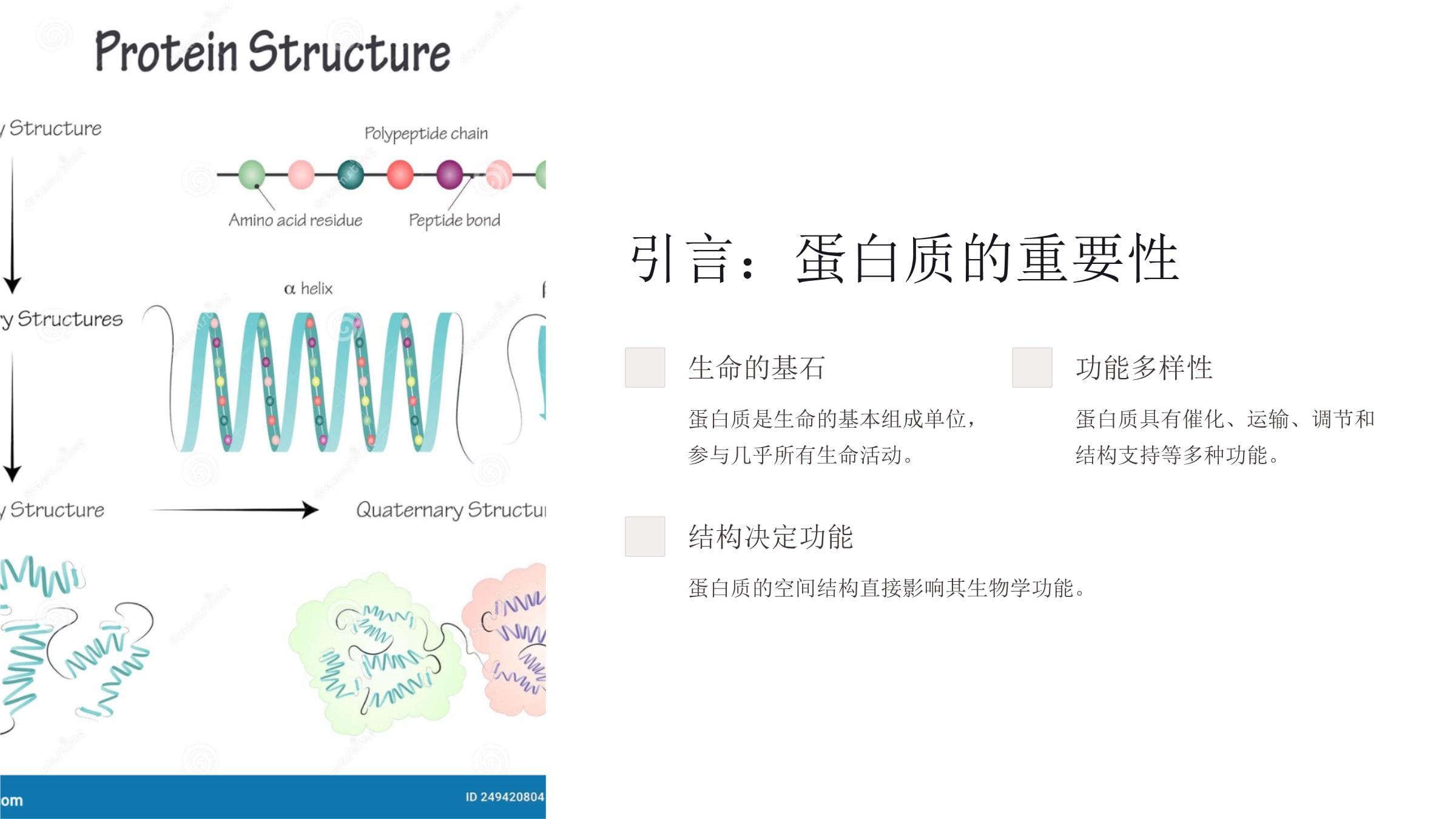
蛋白质的复性蛋白质复性是生命科学中的关键过程。本演示将探讨其原理、方法和应用。我们将深入了解蛋白质结构、折叠机制和复性技术的最新进展。引言:蛋白质的重要性生命的基石蛋白质是生命的基本组成单位,参与几乎所有生命活动。功能多样性蛋白质具有催化、运输、调节和结构支持等多种功能。结构决定功能蛋白质的空间结构直接影响其生物学功能。蛋白质的结构层次1四级结构2三级结构3二级结构4一级结构蛋白质结构层次从简单到复杂,每一层次都对蛋白质的功能至关重要。一级结构定义蛋白质的一级结构是指氨基酸残基在多肽链中的线性排列顺序。特点由肽键连接,决定了蛋白质的基本性质和后续折叠方式。二级结构α螺旋呈螺旋状,由氢键稳定。β折叠呈平行或反平行排列的片状结构。无规卷曲连接α螺旋和β折叠的松散结构。三级结构空间构象蛋白质分子的整体三维结构,由二级结构单元进一步折叠形成。稳定因素氢键、疏水相互作用、离子键和范德华力共同维持。功能关联三级结构直接决定蛋白质的生物学功能。四级结构1多亚基组装由两个或多个蛋白质分子(亚基)相互作用形成的复合体。2功能协同亚基间的相互作用可能产生新的生物学功能。3动态平衡四级结构可能受环境因素影响而发生可逆变化。蛋白质折叠的原理能量最小化蛋白质倾向于折叠成自由能最低的构象。疏水作用疏水氨基酸残基趋向于聚集在分子内部。氢键形成分子内氢键的形成有助于稳定二级结构。静电相互作用带电氨基酸残基间的吸引力和排斥力影响折叠。蛋白质的空间构象蛋白质复性的意义1功能恢复使变性蛋白质重新获得生物学活性。2研究工具为蛋白质折叠机制研究提供重要模型。3工业应用在生物技术和制药领域具有广泛应用前景。4疾病治疗为某些蛋白质错误折叠相关疾病提供潜在治疗方法。蛋白质复性的过程1变性状态蛋白质失去原有空间结构。2中间状态部分折叠的蛋白质,具有一定二级结构。3折叠核心形成局部结构开始稳定,引导后续折叠。4完全折叠蛋白质达到最终稳定的天然构象。变性因素温度高温或低温可破坏蛋白质结构。pH值极端pH环境影响蛋白质电荷分布。化学试剂某些化学物质可干扰蛋白质分子间作用。温度对蛋白质的影响高温效应打破氢键和疏水相互作用导致蛋白质结构松散可能造成不可逆变性低温效应减弱疏水相互作用影响蛋白质溶解度可能导致蛋白质聚集pH值对蛋白质的影响1电荷分布改变影响蛋白质表面电荷分布。2离子键断裂破坏蛋白质内部稳定的离子键。3构象变化导致蛋白质三级结构发生改变。4功能丧失极端pH可能导致蛋白质失活。化学试剂对蛋白质的影响尿素和盐酸胍破坏氢键和疏水相互作用,导致蛋白质展开。有机溶剂改变蛋白质周围的溶剂环境,影响疏水相互作用。还原剂如β-巯基乙醇,可破坏二硫键,导致蛋白质结构松散。去垢剂如SDS,可破坏蛋白质的疏水核心,导致变性。蛋白质复性的方法透析法缓慢去除变性剂,促进蛋白质重新折叠。稀释法快速稀释变性蛋白质溶液,降低变性剂浓度。层析法利用色谱柱分离和重折叠蛋白质。重氮化法变性用尿素或盐酸胍使蛋白质完全变性。还原加入还原剂破坏二硫键。氧化缓慢去除还原剂,允许正确形成二硫键。复性逐步去除变性剂,促进蛋白质重新折叠。透析法原理利用半透膜缓慢去除变性剂,同时引入复性缓冲液。这种渐进过程有助于蛋白质采取正确的折叠路径。优点操作简单适用于大量蛋白质可控制复性速度稀释法1快速稀释将变性蛋白质溶液快速加入大量复性缓冲液中。2浓度梯度变性剂浓度迅速降低,促进蛋白质重新折叠。3搅拌混合确保均匀混合,避免局部高浓度导致蛋白质聚集。4监测复性通过活性测定或结构分析评估复性效果。蛋白质复性的应用重组蛋白质生产在大肠杆菌等表达系统中生产的包涵体蛋白需要通过复性获得活性。蛋白质结构研究复性过程为理解蛋白质折叠机制提供重要信息。治疗蛋白开发某些生物制药需要通过复性步骤来获得正确的结构和功能。医药领域的应用抗体生产单克隆抗体的大规模生产常需要复性步骤。酶替代疗法某些遗传病治疗用酶需要通过复性获得。疫苗开发某些重组疫苗抗原需要正确复性才能诱导免疫反应。蛋白质药物胰岛素等蛋白质药物的生产过程中可能涉及复性步骤。工业生产中的应用生物催化剂工业用酶的大规模生产常需要复性步骤来获得活性酶。这些酶广泛应用于食品、纺织和清洁剂行业。生物传感器某些生物传感器中使用的蛋白质组件需要通过复性技术来维持其功能。这在环境监测和医疗诊断领域尤为重要。食品加工中的应用乳制品凝乳酶的复性用于奶酪生产。烘焙面包改良剂中的酶需要复性。果汁果胶酶的复性用于果汁澄清。蛋白质复性的研究进展11960sAnfinsen发现蛋白质可以自发复性。21980s工业规模复性方法开始发展。32000s高通量复性筛选技术出现。4现在人工智能辅助复性策略设计。分子动力学模拟原子级模拟通过计算机模拟蛋白质折叠过程中每个原子的运动。能量景观绘制蛋白质折叠的能量景观,预测可能的折叠路径。折叠瓶颈识别折叠过程中的关键中间态和瓶颈步骤。优化策略基于模拟结果设计更高效的复性方案。实验技术创新结构生物学的贡献X射线晶体学提供蛋白质高分辨率静态结构,为复性研究提供目标构象信息。核磁共振(NMR)研究蛋白质在溶液中的动态结构,揭示复性过程中的构象变化。冷冻电镜观察蛋白质复合物和大分子的结构,提供复性中间态信息。小结1应用前景2研究进展3复性方法4变性因素5蛋白质结构蛋白质复性是一个复杂而重要的过程,涉及多个科学领域,具有广泛的应用前景。蛋白质复性的重要性60%产率提升复性技术可将包涵体中的无活性蛋白质转化为有活性形式,大幅提高产量。30%成本降低通过优化复性过程,可显著降低生物制药和工业酶的生产成本。100+应用领域蛋白质复性技术在医药、食品、环保等超过100个领域有
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年-安徽建筑安全员B证考试题库及答案
- 2025年-甘肃省安全员知识题库及答案
- 绿色蔬菜创业计划书
- 2025年天津建筑安全员-C证考试题库
- 八年级上册物理知识
- 《踩雨》(教案)-2024-2025学年四年级上册湘艺版(2012)音乐
- 《7 玻璃》教学设计-2023-2024学年科学三年级下册青岛版
- 10 日月潭(教学设计)-2024-2025学年统编版语文二年级上册
- 课题开题报告:忻东旺农民题材油画艺术研究
- 课题开题报告:乡村学校从教30年教师留任坚守的口述史研究
- GB/T 44566-2024节水型企业建材行业
- 社区获得性肺炎(1)护理病历临床病案
- 主数据管理规划设计方案
- DB11T 1230-2015 射击场设置与安全要求
- 腰椎内固定术后并发症
- DB11T 1030-2021 装配式混凝土结构工程施工与质量验收规程
- 激光武器课件
- 缩窄性心包炎术后护理
- AIGC辅助教师作文评价的效果研究
- 《公共政策学(第二版)》 课件 第3章 政策模型;第4章 政策议程
- Lesson 10 Rain and Sun(教学设计)-2023-2024学年冀教版(三起)英语四年级下册

评论
0/150
提交评论