


下载本文档
版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
山西省临汾市孙堡学校2023年高一化学月考试题含解析一、单选题(本大题共15个小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求,共60分。)1.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是()A.浓硫酸可用来干燥某些气体(不挥发性)B.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)C.在加热条件下铜与浓硫酸反应(氧化性、酸性)D.浓硫酸在白纸上书写的字迹变黑(吸水性)参考答案:C试题分析:A、浓硫酸具有吸水性,可以用来干燥某些与浓硫酸不反应的酸性或中性气体,如氢气、二氧化碳等,表现的是浓硫酸的吸水性,错误;B、浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液的质量增大,表现的是浓硫酸的吸水性,错误;C、浓硫酸具有强氧化性,则在加热条件下铜与浓硫酸反应发生氧化还原反应生成硫酸铜和二氧化硫,表现的是浓硫酸的氧化性和酸性,正确;D、浓硫酸具有脱水性,能使有机物中的H、O元素以水的形式脱出,则浓硫酸在白纸上书写的字迹变黑,表现的是浓硫酸的脱水性,错误。2.A元素原子的核电荷数为11,B元素原子的核电荷数为8,A与B化合形成化合物Z,下列说法中错误的是()A.A形成正一价阳离子B.Z一定能与水反应C.Z一定能与CO2反应D.Z一定是M2O型离子化合物参考答案:D解析A为Na,B为O,二者化合可以形成Na2O或Na2O2,Na2O、Na2O2均能与H2O或CO2反应。3.下列各组元素中,按最高正价递增顺序排列的是(
)A.Na、Mg、Al、S
B.C、N、O、FC.F、Cl、Br、I
D.Li、Na、K、Rb参考答案:A略4.下列叙述不正确的是A.13C和14C属于同一元素,它们互为同位素B.1H和2H是不同的核素,它们的质子数相等C.14C和14N的质量数相等,它们的中子数不等D.6Li和7Li的电子数相等,中子数也相等参考答案:D试题分析:6Li和7Li的电子数相等,都为3,6Li中子数为3,7Li中子数为4,中子数不相等,D项错误。5.关于离子键、共价键的各种叙述中,下列说法中正确的是()A.在离子化合物里,只存在离子键,没有共价键B.非极性键只存在于双原子的单质分子(如Cl2)中C.在共价化合物分子内,一定不存在离子键D.由不同元素组成的多原子分子里,一定只存在极性键参考答案:C在离子化合物里,一定存在离子键,可以存在共价键,A错误;非极性键不只存在于双原子的单质分子中,如是含有极性键和非极性键的化合物,B错误;在共价化合物分子内,一定不存在离子键,C正确;由不同元素组成的多原子分子里,不一定只存在极性键,如是含有极性键和非极性键的化合物,D错误;正确选项C。点睛:不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键;由不同元素组成的多原子分子里,可能存在极性键、非极性键。
6.据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的
()A.第六周期ⅣA族B.第七周期ⅥA族C.第七周期Ⅷ族
D.第八周期ⅥA族参考答案:B略7.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。X与W同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21。下列说法不正确的是(
)A.W的氧化物既可以和酸反应又可以和碱反应B.Y的氢化物与其最高价氧化物对应水化物相遇生成白烟...C.气态氢化物的稳定性:Y>X>WD.Q可分别与X、Y、Z、W形成化学键类型相同的化合物参考答案:D短周期元素X、Y、Z、W、Q的原子序数依次增大,Z元素原子半径在短周期中最大(稀有气体除外),则Z为Na;Z、W、Q同周期,只有一种金属元素,故W、Q最外层电子数都大于3,W、Z之间与W、Q之间原子序数之差相等,则W最外层电子数为4,Q最外层电子数为7,可推知W为Si、Q为Cl;X与W处于同一主族,则X为C元素;五种元素原子最外层电子数之和为21,则Y的最外层电子数=21-4-4-1-7=5,原子序数小于Na,故Y为N元素。A.二氧化硅属于酸性氧化物,可以和碱反应,与酸一般不反应,可以与特殊的酸(氢氟酸)反应,故A正确;B.氨气与硝酸反应生成硝酸铵白色固体,故B正确;C.元素的非金属性越强,其氢化物越稳定,非金属性:Y>X>W,则气态氢化物的稳定性:Y>X>W,故C正确;D.Cl分别与C、N、Si形成的化合物含有共价键,与Na形成的NaCl含有离子键,化学键类型不相同,故D错误;故选D。点睛:本题考查结构性质位置关系应用,推断元素是解题关键,注意充分利用非金属元素最外层电子特点及W、Z之间与W、Q之间原子序数之差相等进行推断。本题的易错点是A。8.同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的①分子数
②密度
③质量
④质子数
⑤原子数
⑥电子数A.①④⑥
B.①②⑤
C.③④⑥
D.①②③参考答案:D【详解】①在同温同压下,相同体积的任何气体含有相同的分子数,C2H4与N2和CO的总分子数目相同,故①正确;②N2和CO的相对分子质量都是28,故混合气体平均相对分子质量为28,C2H4的相对分子质量为28,同温同压下,气体密度之比等于相对分子质量之比,故两容器内气体的密度相等,故②正确;③CO、N2和C2H4的摩尔质量都是28g/mol,C2H4物质的量与N2和CO的总物质的量相等时,质量一定相等,故③正确;④CO分子中质子数为14,N2分子中质子数为14,C2H4分子中质子数为16,故C2H4分子数目与N2和CO的总分子数相等时,质子数一定不相等,故④错误;⑤CO、N2是双原子分子、C2H4是6原子分子,C2H4分子数目与N2和CO的总分子数相等时,原子数一定不相等,故⑤错误;⑥CO分子中电子数为14,N2分子中电子数为14,C2H4分子中电子数为16,故C2H4分子数目与N2和CO的总分子数相等时,电子数一定不相等,故⑥错误;故答案选D。9.完全燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,同时消耗6molO2,试推断该有机物的分子式是()A.C2H4B.C2H4OC.C2H6D.C2H6O参考答案:D【考点】有关有机物分子式确定的计算.【分析】先计算出二氧化碳的物质的量,再根据C、H原子守恒确定有机物分子中C、H原子数目,最后结合耗氧量确定有机物分子中O原子数目.【解答】解:标况下89.6L二氧化碳的物质的量为:=4mol,完全燃烧2mol某有机物,生成4molCO2和6molH2O,同时消耗6molO2,则有机物分子中C原子数目==2、H原子数目==6,设有机物分子式为C2H6On,根据耗氧量,则:2mol×(2+﹣)=6,解得n=1,故该有机物的分子式为C2H6O,故选D.10.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2LB.25℃,1.01×105Pa,64gSO2中含有的原子数为3NAC.在常温常压下,11.2LCl2含有的分子数为0.5NAD.标准状况下,11.2LH2O含有的分子数为0.5NA参考答案:B略11.下列电离方程式中正确的是(
)
A.H2SO4
==H2++SO42-
B.Ca(OH)2
==Ca2++(OH)2-C.AlCl3==Al+3+3Cl-1
D.Fe2(SO4)3
==2Fe3++3SO42-参考答案:D略12.下述实验能达到预期目的的是
(
)编号实验内容实验目的A将SO2通入酸性KMnO4溶液中,使其褪色。证明SO2具有漂白性B将Cl2通入NaBr溶液中比较Cl2与Br2的氧化性强弱C除去CO2中混有少量的CO,点燃燃烧除去CO杂质D盐酸与Na2CO3反应生成CO2证明非金属性:Cl>C参考答案:B略13.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是A.16g
B.32g
C.64g/mol
D.32g/mol参考答案:D略14.用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的种类数为:(A)3
(B)
4
(C)5
(D)6参考答案:D15.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是A.H2
B.CO
C.C6H12O6D.C12H22O11参考答案:D略二、实验题(本题包括1个小题,共10分)16.某学习小组的同学在实验室研究Na2CO3与NaHCO3的性质。实验I:(1)产生气体的速率A___
B(填“>”或“<”或“=”),结合化学用语说明原因_________。(2)产生气体的体积A___
B
(填“>"
或“<”或“=”),标准状况下,A烧杯中产生气体的体积为____L。(3)任意写出一种将NaHCO3转变为Na2CO3的方法______________(用化学方程式表示)。实验Ⅱ:1mL0.1mol/LNaHCO3溶液与lmL.0.01mol/LCa(OH)2溶液混合产生CaCO3白色沉淀。(4)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:实验步骤实验现象i.取lmL0.1mol/LNaHCO3溶液。向其中加入1mL
0.0
1mol/L
CaCl2
溶液无明显现象ⅱ.向上述溶液中滴加______________________
参考答案:(1)>
Na2CO3与酸反应经历两步,而NaHCO3只有一步,因此A中产生气体速率快
(2)=
2.24
(3)2NaHCO3Na2CO3+H2O+CO2↑等
(4)Ca(OH)2
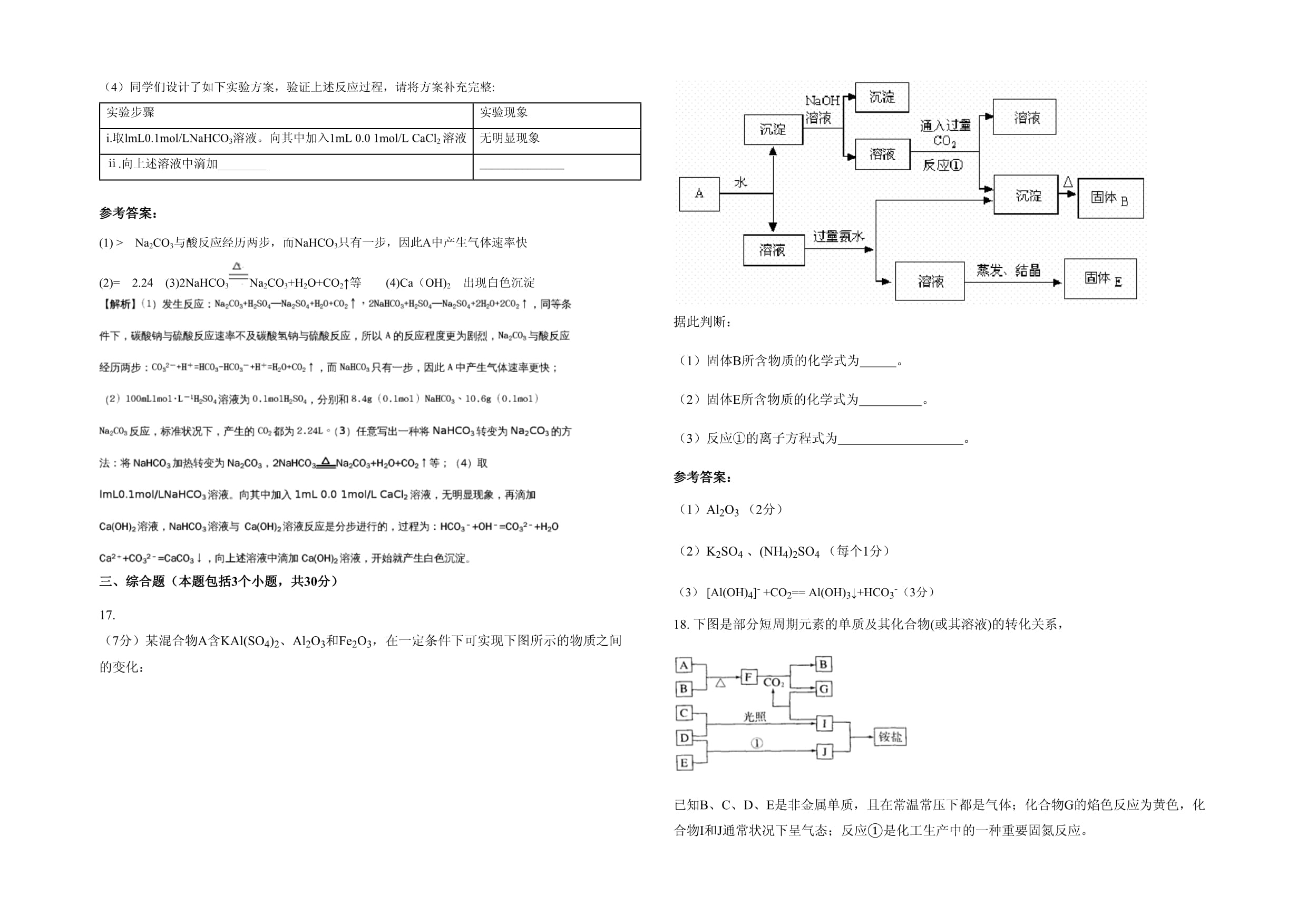
出现白色沉淀三、综合题(本题包括3个小题,共30分)17.(7分)某混合物A含KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此判断:(1)固体B所含物质的化学式为
。(2)固体E所含物质的化学式为
。(3)反应①的离子方程式为
。参考答案:(1)Al2O3(2分)(2)K2SO4、(NH4)2SO4(每个1分)(3)[Al(OH)4]-+CO2==Al(OH)3↓+HCO3-(3分)
18.下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。请回答下列问题:(1)I与J反应生成的铵盐中存在的化学键的类型
;(2)A~J物质中属于离子化合物的是
;(书写化学式)(3)F和CO2反应的化学方程式:
;(4)写出化合物G与I溶液完全反应的离子方程式:
。参考答案:略19.A、B、C、D、E、F是原子序数依次增大的六种短周期元素。其中A元素的原子半径是短周期元素中最小的,D元素的原子半径是短周期元素中最大的(不包括稀有气体元素);B元素的最外层电子数是其电子层数的两倍;C元素原子的最外层电子数是次外层电子数为3倍;E元素是地壳中含量最高的金属元素;F元素原子的最外层电子数等于其次外层电子数的一半。
回答下列问题(答题时涉及化学式的用具体元素符号表示):
(1)C元素的元素名称是
,F元素在元素周期表中的位置
(2)由A、B两种元素形成的,相对分子质量等于72的化合物存在三种同分异构体。请写出它们的结构简式
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 美容伤害处理与应急方案试题及答案
- 古代诗词的语言艺术与技巧试题及答案
- 求职技巧2024年二手车评估师考试试题及答案
- 浙江省宁波市余姚市2023-2024学年八年级下学期期中考试英语试题(含答案)
- 2024年汽车维修工基础知识试题与答案
- 营养师对宠物食品的审核标准考题及答案
- 药理学考题覆盖范围试题及答案
- 如何提升二手车评估的市场竞争力试题及答案
- 汽车美容行业竞争环境分析试题及答案
- 2024年二手车评估师考试重要信息获取渠道及试题答案
- 2024国有企业与私营企业之间的混合所有制改革合作协议
- 敦煌地区文化问题研究报告
- 2024年6月浙江省高考生物试卷真题(含答案解析)
- 小学女生生青春期心理健康教育五六年级(共14张课件)
- 【一等奖课件】《刑事摄像技术》比赛课题:现场照相内容及方法
- 幼儿园大班社会活动《认识交通工具》课件
- 肺结核护理教案
- 企业并购财务风险分析及控制
- 铝模工程劳务承包合同协议书
- 2024年高考数学1卷对高中数学教学的启发
- 2024年广西中考语文试卷真题(含官方答案及逐题解析)

评论
0/150
提交评论