



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
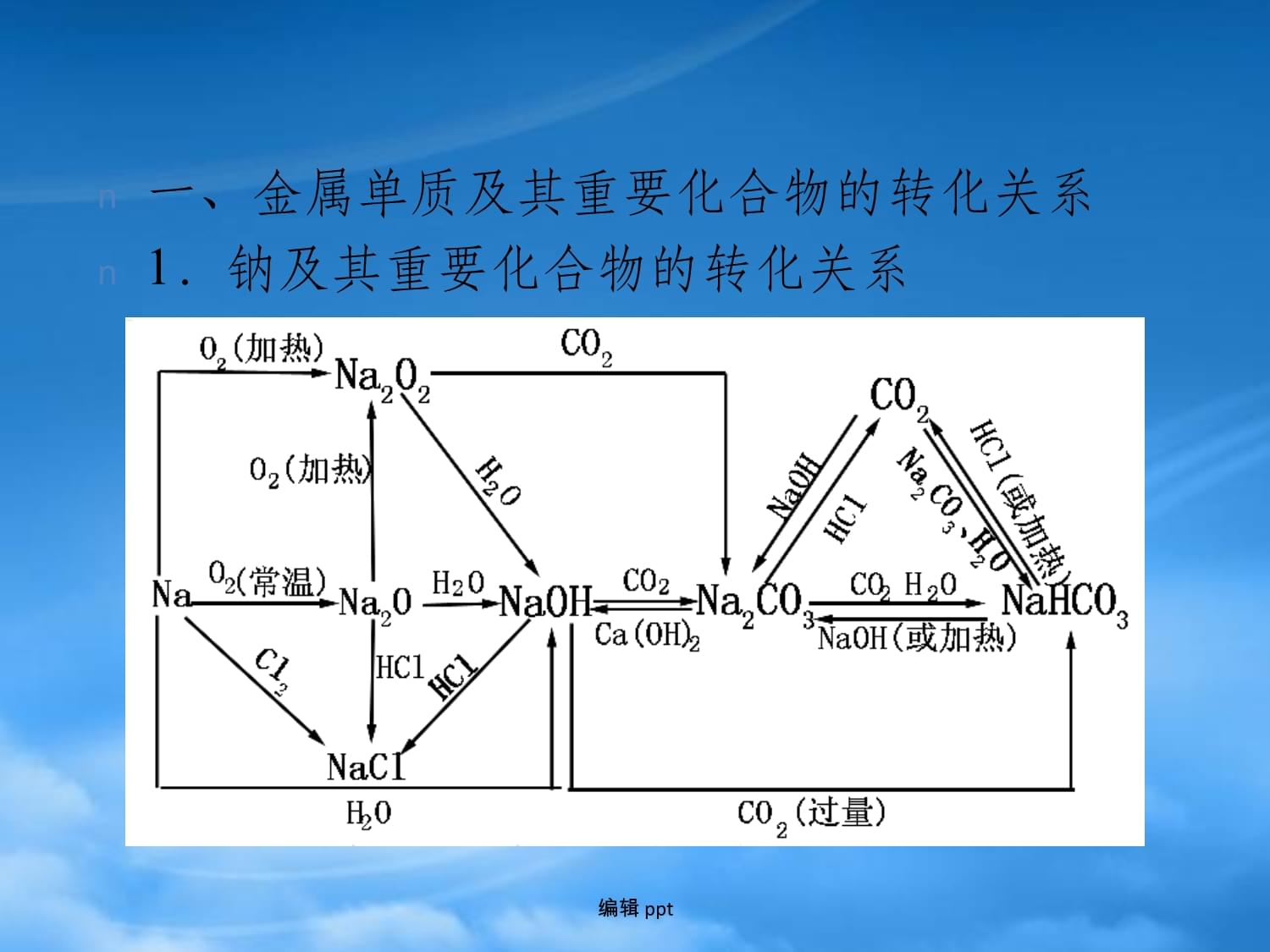
章末专题复习编辑ppt编辑ppt一、金属单质及其重要化合物的转化关系1.钠及其重要化合物的转化关系编辑ppt2.铝及其重要化合物的转化关系编辑ppt3.铁及其重要化合物的转化关系编辑ppt二、焰色反应1.焰色反应的实验操作2.掌握两种金属及其离子的焰色反应(1)钠或钠离子——焰色反应呈黄色(2)钾或钾离子——焰色反应呈紫色(透过蓝色钴玻璃观察)。编辑ppt编辑ppt钠及其化合物(Na2O、Na2O2、NaOH、Na2CO3、NaHCO3)的性质是高考考查的核心内容。常考查以下几个方面:(1)钠与水(或盐溶液)反应的原理和现象,(2)Na2O2与H2O、CO2反应,(3)NaOH的有关性质,(4)Na2CO3、NaHCO3在与酸反应的原理、快慢及消耗酸的量(或生成CO2的量)大小比较。考题除在选择题中对这些知识直接考查外,还利用这些知识结合其他元素及其化合物为载体,编制推断题、简答题和计算题。编辑ppt【例1】将等物质的量的Na2O和Na2O2分别投入到足够量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是 ()A.a=b B.a>bC.a<b D.无法确定【解析】Na2O+H2O===2NaOH,2Na2O2+2H2O===4NaOH+O2↑。等物质的量的Na2O和Na2O2与水反应时,生成等质量的NaOH,耗去了等质量的水,剩余水的质量相等,则溶液的质量分数相等。【答案】A编辑ppt【例2】(2009·全国理综Ⅰ卷·11)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将W1g样品加热,其质量变为W2g,则该样品的纯度(质量分数)是 ()编辑ppt【解析】设样品中含NaHCO3的质量为x。【解析】A编辑ppt近年来高考中,铝及其化合物的内容逐渐增多,如它们在离子共存、离子方程式、物质的鉴别与推断等题型中都大量出现。此外它们与酸反应的定量计算,Al3+与OH-,AlO与H+的相对量对反应产物、现象的影响和计算。Al2O3、Al(OH)3等的性质在无机推断题中的应用也常出现。预计在今后这部分还会增加图像的考查。学习时,要牢固掌握铝的性质及铝三角之间的转化关系。编辑ppt【例3】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实验下图所示的物质之间的变化:编辑ppt据此判断:(1)固体B所含物质的化学式为________。(2)固体E所含物质的化学式为________。(3)反应①的离子方程式为______________________。编辑ppt【解析】铝及其化合物的性质与一般活泼金属元素的性质有差异之处,这是因为铝的金属性不强,已表现出一定的非金属性,考生要紧紧围绕这一中心,展开思路,那么困难就迎刃而解了。加入水后,沉淀是Al2O3、Fe2O3,Al2O3是两性氧化物,溶于NaOH溶液生成NaAlO2,NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3,2Al(OH)3 Al2O3+3H2O;KAl(SO4)2溶于氨水,Al3++3NH3·H2O===Al(OH)3↓+3NH,溶液中的离子组成(NH4)2SO4、K2SO4,从而得出正确答案。编辑ppt【答案】(1)Al2O3(2)(NH4)2SO4、K2SO4【点拔】此题应注意利用Al(OH)3、Al2O3的两性来分析推断。编辑ppt【例4】根据下图的化学反应框图解图。编辑ppt(1)单质F是________,溶液H中所含的主要离子是______________________________________。(2)写出下列反应的化学方程式:C+L―→F+E:________________________;B―→F+H:__________________________。(3)写出下列反应的离子方程式:E+Cl2―→G:__________________________;G+C―→E:______________________________;D―→H:__________________________________。(4)由C―→E+F若改用浓酸,则不能选用的浓酸是(写化学式)________________________________。编辑ppt【解析】解答此类问题,一般地可以从正、逆双向思维入手。找到“突破口”,然后依图示逐渐扩展,直到“破译”整个网络,得到全部答案。若从正向思维开始。由化合物A、单质B反应生成单质C和化合物D出发,这种两种固体之间发生的反应,在中学学过的不多,印象最深当属“铝热法”,鉴于B还可以跟强碱溶液反应,可合理地假定单质B为铝,那么A应是一种不太活泼金属的氧化物,如铁的氧化物。也可从逆向思维开始。单质C与酸反应说明单质可能是金属;溶液E与Cl2反应及溶液G与单质C反应,说明为氧化还原反应,并且说明单质为变价金属,即为铁。编辑ppt编辑ppt1.铁及其化合物间的转化编辑ppt2.铁及其化合物的知识在高考及统考试题中屡见不鲜,主要考查:①铁的合金及钢铁的腐蚀与防护;②Fe的化合物的生成条件及Fe、Fe2+、Fe3+三种价态的相互转化规律;③Fe2+、Fe3+的检验,铁及其化合物的颜色、Fe3+的氧化性;④铁及化合物在社会生活中的实际应用。近几年高考试题和统考题对这部分的内容考查主要以选择题、填空题、推断题、实验题的形式出现,几乎每年都是出题的热点,特别是Fe2+、Fe3+的相互转化及Fe(OH)2、Fe(OH)3的制备等,学习时应重点对待。编辑ppt【例5】向15g铁和氧化铁的固态混合物中,放入一定物质的量浓度的稀硫酸150mL,固体全部溶解,同时放出气体(标准状况下)1.68L;再向所得溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗3mol/L的NaOH溶液200mL,则原硫酸溶流的物质的量浓度为 ()A.1.5mol/L B.2mol/LC.2.5mol/L D.3mol/L编辑ppt【答案】B编辑ppt【例6】往CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是()A.不溶物一定是铜B.不溶物一定含铜,但不一定含铁C.不溶物一定是铁D.溶液中一定含有 ,但不一定含有
编辑ppt【答案】B编辑ppt1.突破点(1)特殊颜色①焰色反应:Na+(黄色)、K+(紫色)②有色溶液含有的离子Fe2+Fe3+Cu2+颜色浅绿色黄色蓝色紫红色编辑ppt③有色固体红色:Cu、Fe2O3(红棕色)红褐色:Fe(OH)3绿色:Cu2(OH)2CO3、FeSO4·7H2O蓝色:Cu(OH)2、CuSO4·5H2O黑色:CuO、FeO、MnO2、炭黑浅黄色:Na2O2、AgBr白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)2编辑ppt(2)特殊性质①在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。②遇SCN-显红色的只有Fe3+。③常见的可溶于NaOH溶液的白色沉淀有Al(OH)3,可溶于NaOH溶液的金属氧化物有Al2O3。④不溶于水又不溶于稀盐酸或稀硝酸的化合物有:BaSO4(白色)、AgCl(白色)。编辑ppt(3)特征反应①能与强碱反应产生气体的物质:活泼的金属,如Na、Al、Zn等;不稳定的弱酸盐,如碳酸盐、碳酸氢盐等。②能与强碱反应产生气体的物质:单质,如Al等;盐类,如铵盐等。③既能与强酸又能与强碱溶液反应的物质:金属单质,如Al等;两性氧化物,如Al2O3等;两性氢氧化物,如Al(OH)3等;弱酸的铵盐,如NH4HCO3、(NH4)2CO3等;弱酸的酸式盐,如NaHCO3等。编辑ppt④能与水反应产生气体的物质:活泼的金属单质,Na、K、Mg(加热)、Fe(高温生成Fe3O4)等;金属过氧化物,如Na2O2等。编辑ppt(4)特殊的转换关系②三角转换编辑ppt2.方法由于无机推断题综合性强,涉及面广,按以下步骤分析题目,往往能迅速理清思想,高效解题。审题→挖掘、筛选信息→联系已学知识→寻找突破点→推理判断→得出结论→正向求证编辑ppt【例7】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。编辑ppt(1)写出化学式:A__________,B____________,C____________,D____________,E____________。(2)写出下列反应的离子方程式:A→B_______________________________________A→D_______________________________________编辑ppt【例8】有A、B、C、D四种物质的溶液,在进行焰色反应实验时,火焰都呈黄色,它们之间可发生如图所示的转化,则这四种物质分别为:编辑pptA___________________________________________。B__________________________________________。C__________________________________________。D__________________________________________。
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 南平2025年福建南平政和县中小学新任教师招聘17人笔试历年参考题库附带答案详解
- 融资顾问服务协议二零二五年
- 食堂档口租赁合同范例二零二五年
- 自然人股权转让标准协议范例二零二五年
- 二零二五股东股权代持协议
- 控制权转让协议二零二五年
- 组件采购合同范例
- 二零二五版员工分红合同
- 二零二五医院医师聘任合同
- 2025年上海市租赁合同范本(标准版)
- 非淹没矩形堰、三角堰、梯形堰流量计算
- 牛排培训大全课件
- 昆虫内部结构和生理教学课件
- 学校心理健康教育资料(全套完整版)
- 车站夜间吊装方案
- 医院药品评价与遴选量化评分表
- GB/T 8713-1988液压和气动缸筒用精密内径无缝钢管
- GB/T 22294-2008粮油检验大米胶稠度的测定
- GB/T 1449-2005纤维增强塑料弯曲性能试验方法
- 国家开放大学《民事诉讼法学》课后自测参考答案
- 建设工程总投资组成表

评论
0/150
提交评论