



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、水化学 水污染 溶液的通性及应用 可溶电解质在水溶液中的单相离子平衡 难溶电解质的多相离子平衡 水的污染及其处理 3-1 溶液的通性 讨论由难挥发性溶质B和溶剂A组成的溶液所引起溶液的蒸气压下降、沸点上升和凝固点下降,以及溶液渗透压等。 干燥剂抗凝剂、冷冻剂、反渗透、科学实验技术等都与这些性质有关。非电解质稀溶液的依数性(colligative properties dilute nonelectroiyte solution) 依数性的含义 难挥发的非电解质的稀溶液的性质与浓度(或者是与溶液中的“粒子数”的多少)有关而与溶质的性质无关. Ostwald 称其为“依数性” . 溶液的几种性质与
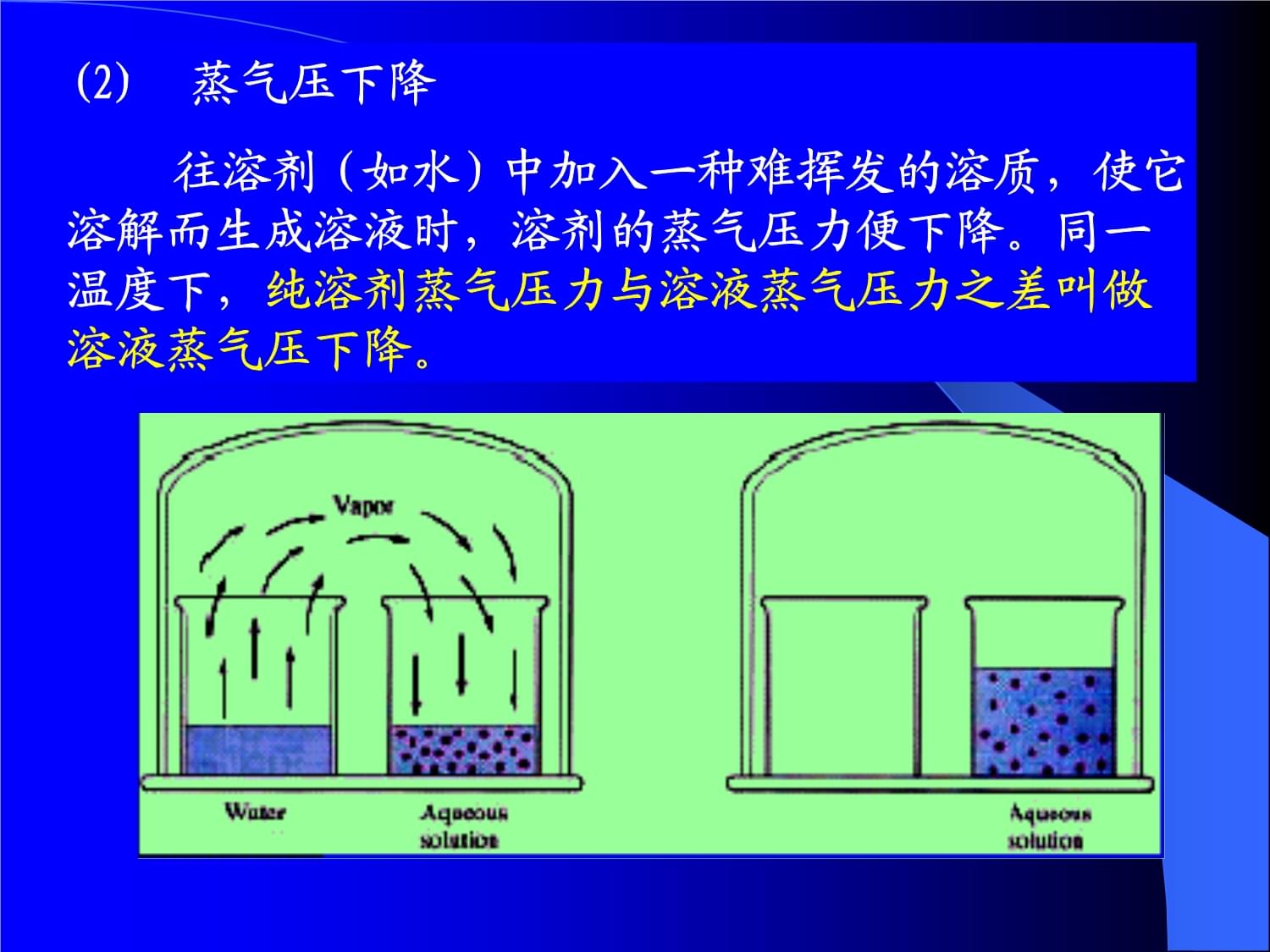
2、水的比较物质 Tb / Tf / 20/(gcm-3)纯水 100.00 0.00 0.9982糖水0.5molkg-1 100.27 -0.93 1.0687尿素溶液0.5molkg-1 100.24 -0.94 1.00121 蒸气压下降(1) 蒸气压 纯液体和它的蒸气处于平衡状态时,蒸气具有的压力叫做该温度下液体的饱和蒸气压。例如水: 20时,饱和蒸气压为2339Pa 100时,饱和蒸气压为101.325kPa。 (2) 蒸气压下降 往溶剂(如水)中加入一种难挥发的溶质,使它溶解而生成溶液时,溶剂的蒸气压力便下降。同一温度下,纯溶剂蒸气压力与溶液蒸气压力之差叫做溶液蒸气压下降。(3)拉乌
3、尔定律(Raoults law) 在一定温度下稀溶液的蒸汽压等于纯溶剂的蒸汽压乘以溶剂在溶液中的量分数。 ppAxA xAnA /(nA+nB), xBnB/(nA+nB) ppA-ppAxB 一定温度下,稀溶液的蒸汽压的下降与溶质B的量浓度成正比。例题1 已知20 时水的饱和蒸汽压为2.33 kPa. 将17.1g蔗糖C12H22O11 与3.00g尿素CO(NH2)2分别溶于100g水. 计算形成溶液的蒸汽压.解:两种溶液中水的量分数相同2溶液的沸点上升和凝固点下降 (1) 沸点与凝固点 沸点是液体的蒸气压等于外压时对应的温度; 凝固点是液相的蒸气压力与固相蒸气压力相等时对应的温度。 在外
4、压一定条件下,晶态的纯物质有一定的凝固点和沸点。向溶剂中加入溶质,溶剂的凝固点会下降、沸点会上升。(2) 非电解质溶液的沸点升高与凝固点降低 由于溶液的蒸汽压下降,要使其沸腾即蒸汽压达到外界压力就必须使其温度继续升高Tb达到新的沸点才能沸腾. 同理,蒸气压下降的结果导致溶液凝固点下降 沸点升高 TbKb.mb凝固点下降 TfKf.mb例题2 已知纯苯的沸点是80.2 ,取2.67 g萘(C10H8) 溶于100g苯中测得该溶液的沸点为80.731 试求苯的沸点升高常数.解 萘的摩尔质量m(C10H8)=128.0g.mol-1 mb(2.67/128)/(100/1000)mol.kg-1 =
5、0.2086 mol.kg-1由 Kb Tb/mb 0.531K/0.2086 mol.kg-1凝固点下降的应用 汽车的散热器(水箱)的用水,在寒冷的季节,通常加入乙二醇C2H4(OH)2使溶液的凝固点下降而防止冻结。 渗透压 (1)渗透现象与渗透压 只允许溶剂的分子通过,不能允许溶质分子通过的膜叫做半透膜。用半透膜将浓度不等的溶液隔开,浓度较低一边的溶剂分子透过半透膜进入浓度高的溶液一边,使其液面升高的现象叫做渗透现象。 渗透是溶剂通过半透膜进入溶液的单方向扩散过程。要使溶液的液面不上升,必须在溶液面上施加一定压力。 当施加的压力达到某一值时,能实现膜的内外液面高度相等,此时溶液液面上所增加
6、的压力就等于溶液的渗透压力。 因此,渗透压可理解为:为阻止溶剂分子透过半透膜进入溶液而维持两边液面等高必须在溶液一边需要施加的额外压力。 难挥发的非电解质稀溶液的渗透压与溶液的浓度(mol.dm-3)及绝对温度成正比。 以表示渗透压(Pa),c表示浓度(mol.m-3),T表示热力学温度(K),n表示溶质的物质的量(mol),V表示溶液的体积(m3),则 例题3 测得人体血液的冰点降低值Tf= 0.56 求在体温37 时的渗透压.解:cRT1000=1000 (0.56/1.86) 8.314(273+37)=7.756105Pa(2) 渗透压在生物学中的意义。 生物的细胞膜具有半透膜的性质,
7、渗透压是引起水在生物体中运动的基本推动力。 一般植物细胞汁的渗透压约可达2000kPa,水分可以从植物的根部被送到数十米高的顶端 二 电解质溶液的通性 电解质溶液,或浓度较大的溶液也具有溶液蒸气压下降、沸点上升、凝固点下降和渗透压等性质。 如海水不易结冰,其凝固点低于273.15K,而沸点则可高于373.15K。 工业上或实验室中常用某些易潮解物质,如氯化钙、五氧化二磷等作为干燥剂,就是因为这些物质能使其表面所形成的溶液的蒸气压力显著下降,即这些物质能不断地吸收水蒸气。 但是,稀溶液定律所表达的依数性与溶液浓度的定量关系不适用于浓溶液和电解质溶液。 因为在浓溶液中,溶质微粒之间的相互影响以及溶
8、质微粒与溶剂分子之间的相互影响大大加强。这些复杂的因素使其对稀溶液定律的定量关系产生了偏差。 在电解质溶液中,由于电解质的解离,溶液中溶质粒子数增加,其凝固点下降数值比相同浓度(m)的非电解质溶液的凝固点下降数值要大。 偏差的大小可用电解质溶液与同浓度非电解质溶液的凝固点下降的比值 i 表示 iTf/Tf 思考题: 排出下列溶液凝固点由高到低的顺序1. c(C6H6O6)=0.10mol.dm-32. c(CaCl2)=0.05 mol.dm-33. c(Na3PO4)=0.033 mol.dm-34. c(KNO3)=0.10 mol.dm-3参考答案; 1. C粒子(C6H6O6)=0.1
9、0mol.dm-3 2. c粒子(CaCl2)=0.15 mol.dm-3 3. c粒子(Na3PO4)=0.13 mol.dm-3 4. c粒子(KNO3)=0.20 mol.dm-3 凝固点下降高低顺序为4231 凝固点由高到低顺序为1、3、2、4 小结:非电解质稀溶液依数性: 蒸气压下降 PA=pAxB 沸点升高 TbKbmB KbR(Tb.A)2MA/VAPHm.A 凝固点下降 TfKfmB KfR(Tf.A)2MA/subHm.A 渗透压 V= nBRT 电解质溶液解离出的粒子个数愈多,偏离依数性规律也愈大。 作业: p157: 6 3-2 水溶液中的单相离子平衡 单相离子平衡可分为
10、酸、碱的解离平衡及配离子的解离平衡两类。 酸和碱在水溶液中的解离平衡 1. 酸碱理论A 电离理论 由Arrhenius提出(1)要点: 解离出的正离子全部是H+的物质叫酸; 离解出的负离子全部是OH-的物质叫碱。 酸碱反应的实质是 H+ + OH- = H2O(2)优缺点: Arrhenius电离理论简单,是第一个电解质溶液理论,对溶液理论的发展具有重要作用; 缺点是把酸碱的概念局限于水溶液系统内,难于解释非水系统进行的反应。例如, NH3与 HCl在气相或者在苯中反应也生成NH4Cl,电离理论就不能解释。 (1)要点 反应中任何能给出质子的分子或离子,即质子给予体叫做酸. 反应中任何能接受质
11、子的分子或离子,即质子接受体叫做碱. 酸碱反应是质子由质子给予体向质子接受体的转移过程.B 质子理论(J.N.Brnsted等人提出)水为两性物质(2)质子理论的特点 该定义不涉及发生质子转移的环境,故而在气相和任何溶剂中均通用. 质子理论中无盐的概念,电离理论中的盐,在质子理论中都是离子酸或离子碱,如NH4Cl 中的NH4+是离子酸, Cl是离子碱. 得失质子的物质组成共轭酸碱对 HB = H+ + B- 酸质子+共轭碱 酸碱反应的实质是两个共轭酸碱对之间的质子传递反应。 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 反应总是由相对较强的酸和碱向生成相对较弱的酸和碱的方向进行2. 弱酸弱碱的水
12、溶液中的离子平衡及pH值的计算(1) 弱酸与弱碱的解离常数 酸、碱溶液中存在着解离平衡,其平衡常数叫做解离常数,可分别用Ka及Kb表示。 例1:计算氨的离解常数Kb思考题:计算K有哪几种常用方法?(2) 一元弱酸、弱碱的解离度及溶液pH的计算 醋酸HAc HAc(aq) + H2O(l)= H3O+(aq) + Ac-(aq) HAc(aq) = H+(aq) + Ac-(aq) 解离度的定义设一元酸的浓度为c,离解度为,则 当很小时, 1- 1 溶液的解离度与其浓度平方根成反比。即浓度越稀,解离度越大,这个关系式叫做稀释定律。 和Ka都可用来表示酸的强弱,但随 c 而变,在一定温度时,Ka不
13、随 c 而变,是一个常数。例题3 已知25时, 0.200molL-1氨水的电离度为0.934%,求c(OH), pH值和氨的离解常数.解: 这几个关系式是弱酸溶液计算的基本关系式,要求初步掌握其计算 . 同理,一元弱碱的电离平衡 酸的酸性越强,其共轭碱的碱性就越弱,共轭酸碱的离解常数的乘积等于水的离子积KW.例4 计算0.100mol.dm-3的NH4Cl溶液的PH,已知NH4+的Ka5.6510-10解:7.510-6.mol.dm-3p H -lg(7.510-6)=5.12例题5 向1.0L浓度为0.10mol.L-1的HAc溶液中加入0.10mol的NaAc(s),溶液的pH变化多少
14、?(已知Ka1.810-5)解: 1.0L 0.10mol.L-1的HAc溶液的pH c(H+) p H(1)=2.87加入0.10molNaAc(s)后,设H+浓度为x HAc + H2O = H3O+ + Ac-平衡浓度 0.10-x x 0.10+x x很小,0.10+x0.10,0.10-x0.10 x1.810-5 p H(2)=4.75 p H=4.75-2.87=1.87 思考题 弱酸的浓度越低,其离解度越高,因而溶液的酸性也越强,pH越低。该说法对吗?为什么?参考答案 不对,因为酸性强弱由溶液中H+浓度确定,虽然弱酸的浓度越低,离解度越高,但由于浓度降低很多,溶液中氢离子浓度会
15、降低,溶液的pH升高。例题 6 计算0.10mol.dm-3的NaAc溶液的pH. 解 :反应为 Ac-1 + H2O = HAc + OH-1 ,查得 多元酸的解离平衡 多元酸的解离是分级进行的,每一级都有一个解离常数 溶液中的H+主要来自于弱酸的第一步离解,计算c(H+)或pH 时可只考虑第一步离解.计算式与一元酸相同。 例题7 计算0.100mol.dm-3的H2S溶液的pH解:二 缓冲溶液和pH的控制1 缓冲溶液(the buffered solution) 能抵抗少量外来强酸或强碱加入保持溶液的pH值基本不变的溶液叫做缓冲溶液.2. 缓冲原理 以HAc-NaAc系统为例, 加入少量强
16、酸,H离子与Ac离子结合形成HAc分子,平衡向左移动,溶液中H浓度不会有显著变化; 加入少量强碱,强碱会与H结合,平衡向右移动,H浓度仍不会有显著变化。 组成缓冲溶液的一对共轭酸碱,如HAcAc -,NH4+-NH3 , H2PO4HPO42-等叫做缓冲对。 2. 缓冲溶液pH值的计算(calculate the pH of buffered solutions) 缓冲溶液由共轭酸碱对组成:NH4+-NH3 , H2PO4HPO42- 计算公式很小(10-4)时,解:(1)HAc的离解度(2) 加入的1.00mo1.dm-3 HCl由于稀释,浓度变为 由于加入的盐酸离解出的H+与Ac-结合生成
17、HAc,因此3. 缓冲溶液的应用和选择原则 缓冲溶液可控制溶液的PH,应用很广。 金属腐蚀与防腐 在硅半导体器件生产过程中用氢氟酸腐蚀以除去硅片表面没有用胶膜保护的那部分氧化膜SiO2,反应为 Si02 十 6HF H2SiF6 十 2H20 单独用HF溶液作腐蚀液,H浓度大,随着反应的进行H浓度会发生变化,pH值不稳定,造成腐蚀的不均匀。因此需应用HF和NH4F的混合溶液进行腐蚀,才能达到工艺的要求。 金属电镀 电镀液中,常常采用H2PO4-1-HPO4-2来控制溶液的pH值。制革、染料 在制革、染料等工业以及化学分析中也需应用缓冲溶液。 土壤pH控制 土壤中由于含有H2CO3NaHCO3和
18、NaH2PO4Na2HPO4以及其他有机弱酸及其共扼碱所组成的复杂的缓冲系统,能维持一定的pH值。 血液pH控制 依赖H2CO3-NaHCO3等所形成的缓冲系统以维持pH值在7.4附近。如果酸碱度突然发生改变,当PH值的改变超过0.5时,就可能会危及生命。 选择缓冲溶液的基本原则 缓冲对中任一种物质的浓度过小都会使溶液丧失缓冲能力。因此两者浓度之比值最好趋于1。 缓冲范围: pKa1课堂提问:p155 13题;15题 三 配离子的解离平衡 1. 配合物与配离子 配合物可看成是由简单化合物生成的复杂化合物。 由一个简单正离子(称为中心离子)和几个中性分子或它种离子(称为配位体)结合而成的复杂离子
19、叫做配离子。2 配离子的解离平衡 Ag(NH3)2+配离子的总的离解 例题9解:查表3 配离子解离平衡的移动 实验:往深蓝色的Cu(NH3)4溶液中加入少量稀H2SO4,溶液会由深蓝色转变为浅蓝色。 解释:这是由于加入的H(aq)与NH3结合,生成了NH4(aq),促使Cu(NH3)42+进一步解离: 在配离子反应中,一种配离子可以转化为另一种更稳定的配离子,即平衡移向生成更难解离的配离子的方向。例如小结:缓冲溶液 配离子解离平衡与多元弱酸离解平衡类似。作业: p158159 8; 9; 11; 14; 17 3-3 难溶电解质的多相离子平衡 溶度积常数和溶解度(solubility prod
20、uct constant and solubility) 离子积和溶度积规则(ion product & rule of solubility product) 沉淀-溶解平衡的移动(mobile of precipitation dissolution equilibrium)一 多相离子平衡和溶度积常数Ksp 溶解度 (中学里)把某温度下100克水里某物质溶解的最大克数叫溶解度(g/100gH2O). 热力学中,把在一定温度和压力下固-液达到平衡时的饱和溶液里的物质浓度称为“溶解度”,用S(mol/dm-3) 表示. 温度一定时,难溶电解质的饱和溶液中,离子浓度的乘积为一常数,叫做溶度积常
21、数,计为Ksp 。 溶度积固体硫酸钡为纯物,无浓度变化 1. Ksp的热力学计算 计算公式: - RTlnKsprGm rGm 计算方法为 rGm=BfGm(B) rGm=rHm-TrSm rHm=BfHm(B) rSm=BS(B) 2 溶度积与溶解度之间的关系例题2 已知求Ag2CrO4在在水中的溶解度。解:课堂练习题参考答案 经计算可知选(C) 结论:同类电解质,Ksp愈小,s也愈小;不同类的电解质应根据算出的溶解度比较难溶程度。溶度积规则及其应用 1. 溶度积规则(rule of solubilit product) AnBm(s)nAm+ (aq) + mBn- (aq)离子浓度乘积Q
22、的表达式为 沉淀析出 饱和溶液 无沉淀析出(沉淀可溶)(1)利用同离子效应与溶度积规则判断判断沉淀是否完全,沉淀的生成或溶解。例3 求25时Ag2CrO4在0.010 mol L-1 K2CrO4 溶液中的溶解度。同离子效应 在难溶电解质饱和溶液中加入含有相同离子(即构晶离子)的易溶强电解质使难溶电解质的溶解度降低的现象.2.溶度积规则的应用例4 对已达到平衡的反应 分别给其加入HCl 、BaCl2 或Na2CO3 溶液,会产生怎样的结果?解;加盐酸HCl 加Ba+2或CO3-2因此能促使BaCO3的生成。例5 25 时,某溶液中C(SO42-)为6.010-4 molL-1. 若向40.0L
23、该溶液加入0.010 molL-1 BaCl2溶液10.0L,问是否能生成BaSO4 沉淀?解:查表得 KSP 有时需要将一种沉淀转化为另一种沉淀,如 锅垢的主要组分之一CaSO4用Na2CO3溶液处理,可使CaSO4转化为疏松而可溶于酸的CaCO3沉淀被清除。 (2) 确定沉淀的转化条件KSP(CaSO4)=7.110-5; KSP(CaCO3)=4.9610-9 据溶度积规则,设法降低难溶电解质饱和溶液中有关离子的浓度,使离子浓度乘积小于它的溶度积,就可使难溶电解质溶解。 a) 利用酸碱反应 (3) 确定沉淀溶解的条件 CaCO3(s)+2H+(aq)Ca2+(aq)+CO2(g)+H2O
24、(l)b) 利用配合反应 当难溶电解质中的金属离子与某些试剂(配合剂)形成更稳定的配离子时,能使沉淀溶解。例如 照相底片中未爆光的AgBr,可用硫代硫酸钠溶液洗去,反应为 c) 利用氧化还原反应 例6 在0.20L 的0.50mol L-1 MgCl2溶液中加入等体积的0.10 mol L-1的氨水溶液,问有无Mg (OH)2 沉淀生成?为了不使Mg (OH)2 沉淀析出至少应加入多少克NH4Cl(s) (设加入NH4Cl(s) 后体积不变)解:小结:溶度积规则作业;p160 18;19;21 3-4 水的污染及防治 水是人类社会极为宝贵的自然资源,是维持人民生活需要与保证国民经济发展的重要物
25、质基础之一。据联合国统计,地球上水的储存量总计约138.6亿亿立方米。但是,与人类生活密切相关的淡水资源河流、湖泊和浅层地下水等只有104.6万亿立方米,不到地球总水储量的万分之一。 当前,水的污染已成为全球的公害,是严重的社会问题。因此,合理地利用水资源,防治水的污染是是环境化学中的重要课题,也工程技术人员应予重视和值得研究的一个课题。一 水中的污染物 水的污染主要是人为造成的。近几十年来,人类社会的用水量与日俱增。一个工业城市每天从天然水体中取水数百万吨,在使用后溶入和挟持着许多有毒、有害物质以废水的形式排放出来,绝大部分未经处理最后流入了天然水体。此外,工矿废渣和生活垃圾倾倒在水中或岸边
26、,农田施用的农药和化肥等经降雨淋洗也使大量有毒、有害物质流入天然水体中。 1 无机污染物 毒性较显著的有汞、隔、铅、铬等重金属的离子,砷的化合物以及氰化物。重金属离子能使人体中的酶失去活性,它们的共同特点是即使含量很小也有毒性,它们能在生物体内积累,不易排出体外,危害很大.2 有机污染物 主要有天然有机物、农药(杀虫剂、杀菌剂、除草剂等)、 多苯环化合物、石油、人工合成的某些化工品,合成洗涤剂等。二 水污染的处理 1 混凝法 化学法 有以沉淀反应和氧化还原反应为主的处理方法。3 离子交换法 离子交换法的原理是利用离于交换树脂能与水中杂质离子进行交换反应,将杂质离子交换到树脂上去,原理为 4 电渗析法和反渗透法 三 评价水质的工业指标 水质的优劣取决于水中所含杂质的种类和数量。可以通过一些水质指标来评价水质的优劣,判断它是否能满足生活用水和各种不同工业用水对水质的要求。1. 浑浊度 水中含有悬浮物质就会产生浑浊现象,水的浑浊程度以“浑浊度”来量度,它是用待测水样与标准比浊液比较而得到的。浑浊度是从外观上判断水是否纯净的主要指标。2. 电导率 电导率表示水导电能力的大小,水中溶解的离子浓度越大,电荷越高,温度越高,则其导电能力越强,电导率较大。电导率的单位为Sm-1。 298K纯水的电导率约为5.510-6 Sm-1 ,蒸馏水的电导率
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026年物联网技术应用与发展趋势研究试题集
- 2026年知识产权保护与创新驱动发展策略题
- 2026年外贸出口实务知识与贸易风险规避题库
- 2026年软件架构师高级笔试模拟题集
- 2026年高层次人才评价测试题目集
- 2026年人力资源管理师职业资格考试管理案例题
- 安徽省霍邱县二中2026届高一下数学期末综合测试模拟试题含解析
- 2026年国学文化与哲学思考试题
- 2026年建筑项目管理与现场安全考核题
- 2026年电子商务师职业资格考试模拟试题
- (高清版)DB31∕T 1289-2021 户外广告和招牌设施安全检测要求
- 丁华野教授:上卷:幼年性纤维腺瘤与叶状肿瘤
- 输液导轨施工方案
- 货运行业安全责任意识培训计划
- 《肿瘤治疗相关心血管毒性中医防治指南》
- 《电力电子技术》复习资料
- 工作作风存在问题及整改措施
- JC╱T 529-2000 平板玻璃用硅质原料
- 肺结节科普知识宣教
- 脾胃论与现代医学的契合医学课件
- 钢结构安装合同

评论
0/150
提交评论