



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、2016年浙江省高考理综化学部分第 29题练习(4)1钴氧化物可制备锂离子电池正极材料,利用钴渣含 Co(OH) 、Fe(OH) 等制备钴33氧化物的工艺流程如下:(1)铁渣中铁元素的化合价为;写出沉钴过程中发生反应的化学方程式:。(2)119g CoCO 沉淀充分灼烧最多得到 CO 的体积(标准状况)为。32(3)取一定质量的碳酸钴分解后的钴氧化物(其中 Co 的化合价为2、3),用 300 mL5 molL1 盐酸恰好完全溶解固体,得到 CoCl 溶液和 336 L(标准状况)黄绿色气体。2试确定该钴氧化物中 Co、O 的物质的量之比。(写出计算过程)2高纯氧化铁是现代电子工业的重要材料。
2、以下是用硫酸厂产生的烧渣(主要成分为Fe O 、Fe O 、FeO、SiO )为原料制备高纯氧化铁(软磁 a-Fe O )的生产流程示意图:2334223(1)酸浸时,常需将烧渣粉碎、并加入过量 H SO ,其目的是;24滤渣的主要成分为(填化学式)。(2)加入 FeS 时,发生反应的离子方程式为。2(3)加入 NH HCO 目的是。“沉淀”时,pH 不宜过高,否则制备的。检验 FeCO 是否洗涤干净的方法43FeCO 中可能混有的杂质是33是。(4)煅烧时,发生反应的化学方程式为。第 1 页 共 11 页3兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。
3、以红土镍矿(主要成分为 NiS、FeS 和 SiO 等)为原料制备兰尼镍的工艺流程2如下图所示:(1)在形成 Ni(CO) 的过程中,碳元素的化合价没有变化,则 Ni(CO) 中的 Ni 的化44合价为_;(2)已知红土镍矿煅烧后生成 Ni O ,而加压酸浸后浸出液 A 中含有 Ni2+,写出有关镍元23素的加压酸浸的化学反应方程式_;(3)向浸出液 A 中通入 H S 气体,反应的离子方程式是_;2( 4) “高 温 熔 融 ”时 能 否 将 通 入 氩 气 换 为 CO 并 说 明 原 因_;(5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为_
4、。浸出反应所用的 NaOH 溶液的浓度要大,若 NaOH 溶液较稀时,则会产生少量的 Al(OH) 沉淀而阻止浸出反应的持续3进行,请用化学反应原理加以解释: _。(6)浸出液 B 可以回收,重新生成铝以便循环利用。请设计简单的回收流程:浸出液 B_。H+Fe(示例:CuOCu2+Cu)第 2 页 共 11 页4某校兴趣小组对 SO 与新制 Cu(OH) 悬浊液的反应进行探究,实验如下:22序号 试管中的药品现象15 mL 1 molL-1 CuSO 溶 开始时有砖红色沉淀 A 出现,一段时间4I液 和 3 5 mL 1 molL-1 后,砖红色沉淀消失,静置,试管底部NaOH 溶液混合有少量
5、紫红色固体 B,溶液呈蓝色15 mL 1 molL-1 CuCl 溶 开始时有浅红色沉淀出现,一段时间2II液 和 3 5 mL 1 molL-1 后,浅红色沉淀消失,静置,生成大量NaOH 溶液混合白色沉淀 C,溶液呈蓝色查阅资料如下:CuCl 为白色固体,难溶于水,乙醇、乙酸等,能溶于浓盐酸。也能溶于浓或稀硝酸溶液,CuCl 被氧化。(1)甲同学通过补充两个实验: 证明实验中观察到的砖红色沉淀 A 是 Cu O。取少量 Cu O 固体于试管中,加 5 mL22蒸馏水,向其中持续通入 SO ,一段时间后,静置,试管底部有少量紫红色固体,溶液呈2蓝 色 , 则 说 明 砖 红 色 沉 淀 是
6、Cu O。 其 反 应 的 方 程 式 是2_。 甲同学重新用实验 II 的方法制备新制 Cu(OH) 悬浊液,过滤,用蒸馏水洗涤干净。2向洗净后的 Cu(OH) 中加入 5 mL 蒸馏水,再持续通入 SO 气体,现象与实验 I 相同。22检验 Cu(OH) 洗涤干净的方法是_。2(2)同学们对白色沉淀的成分继续进行探究。 请帮助乙同学证明 C 为 CuCl,设计简单的实验方案:_。 丙同学向洗涤得到的 199g C 中加入足量的稀硝酸,得到蓝色溶液,此过程中反应的离子方程式为:_。向溶解后的溶液中加入足量的 AgNO 溶液,过滤、洗涤、干燥,得到 279g 白色沉淀。3这种实验结果_(偏小、
7、偏大或不变),可能原因是_。(3)工业上制备 CuCl 还可以用:将 Na SO 的水溶液逐滴加入 CuCl 的水溶液中,倾出部232分清液,抽滤出沉淀,沉淀依次用 36%的乙酸,无水乙醇洗涤多次,得白色粉末固体,真第 3 页 共 11 页空或者充氮气保存。 抽滤出沉淀操作时用到了抽滤瓶、布氏漏斗、_等仪器和用品。 沉 淀 依 次 用 36%的 乙 酸 , 无 水 乙 醇 , 无 水 乙 醚 洗 涤 多 次 的 目 的 是_。5氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。已知:氰化钠
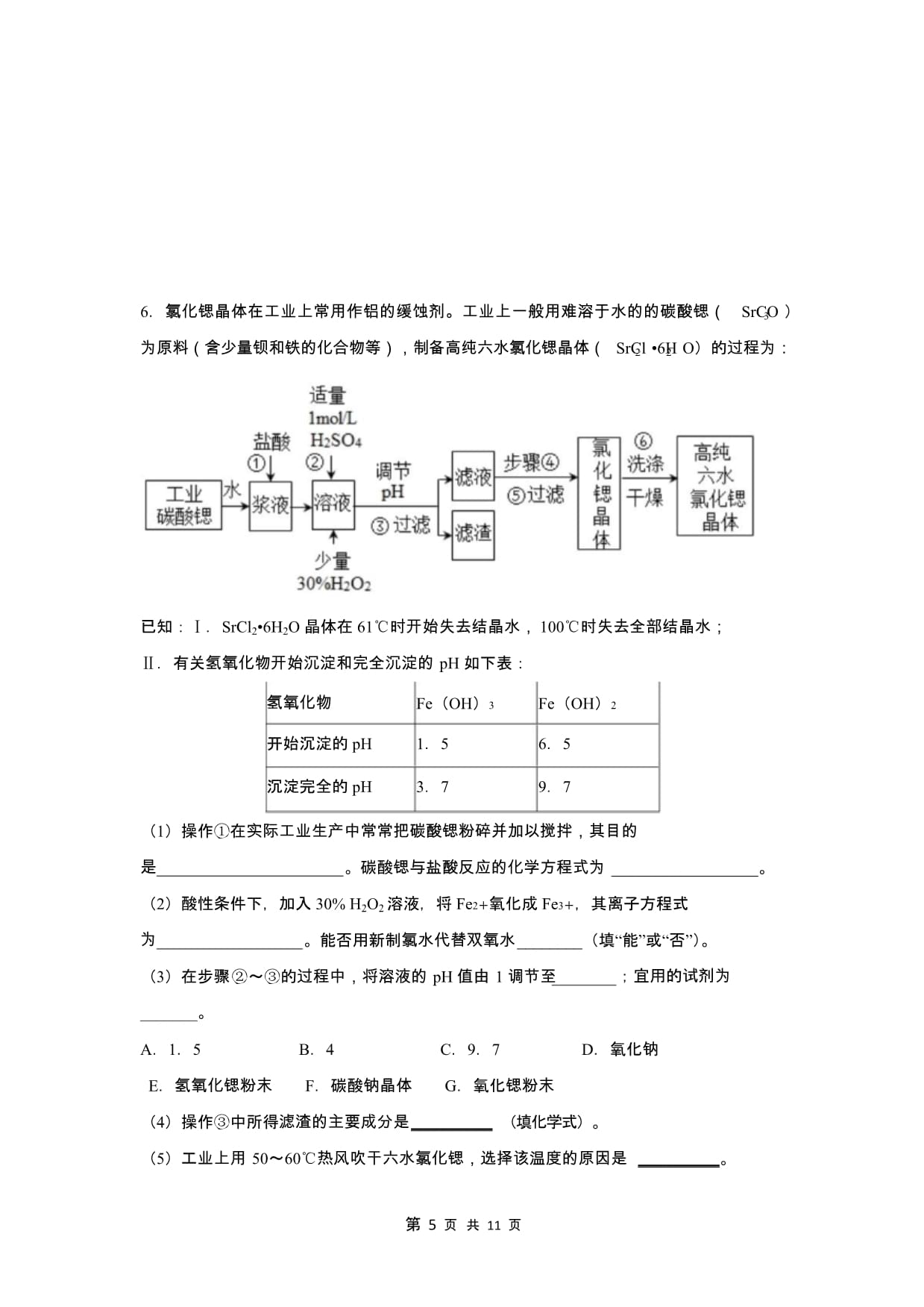
8、化学式为 NaCN(C 元素2 价,N 元素3 价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。(1)NaCN 用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是。(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na S O NaSCN+Na SO ;已知:NaSCN 中22323S 为-2 价,处理 1molNaCN,反应中转移电子的物质的量为_。(3)CN 中 C 元素显2 价,N 元素显3 价,则非金属性 N_“”或“”),请设计实验证明:_。_C(填“”、第 4 页 共 11 页6氯化锶晶体在工业上常用作铝的缓蚀剂。工业
9、上一般用难溶于水的的碳酸锶(SrCO )3为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl 6H O)的过程为:22已知:SrCl 6H O 晶体在 61时开始失去结晶水,100时失去全部结晶水;22有关氢氧化物开始沉淀和完全沉淀的 pH 如下表:氢氧化物Fe(OH)315Fe(OH)265开始沉淀的 pH沉淀完全的 pH3797(1)操作在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是。碳酸锶与盐酸反应的化学方程式为_。(2)酸性条件下,加入 30% H O 溶液,将 Fe2氧化成 Fe3,其离子方程式22为。能否用新制氯水代替双氧水_(填“能”或“否”)。(3)在步骤
10、的过程中,将溶液的 pH 值由 1 调节至_。;宜用的试剂为A15B4C97D氧化钠E氢氧化锶粉末F碳酸钠晶体G氧化锶粉末(4)操作中所得滤渣的主要成分是_ (填化学式)。(5)工业上用 5060热风吹干六水氯化锶,选择该温度的原因是_。第 5 页 共 11 页(6)步骤中,洗涤氯化锶晶体最好选用_。A水B稀硫酸C氢氧化钠溶液D氯化锶饱和溶液2016年浙江省高考理综化学部分第 29题练习(4)参考答案1(1) 3;(2)224L(3)由电子守恒:n(Co3)2n(Cl )03mol由电荷守恒:n(Co) n(Co2)溶液2总05n(Cl)05(15mol015mol2)06 mol所以固体中的
11、 n(Co2)06 mol03 mol03moln(O)(03mol303 mol2)2075mol故 n(Co)n(O)06 mol075 mol45【解析】试题分析:(1)浸取时亚硫酸钠把铁和钴的化合物还原为+2价的离子,加氧化剂除铁后钴的价态不变,所以亚铁离子被氧化为铁离子;反应的产物为 CoCO ,硫酸铵等,配平根据碳守恒确3定有二氧化碳;(2)n(CO )= n(CoCO )=119/119=1mol v(CO )=224L223(3)可以根据两个守恒处理;由电子守恒:n(Co3)2n(Cl )03mol;由电荷守2恒:n(Co)总 n(Co2)溶液05n(Cl)05(15mol01
12、5mol2)06 mol所以固体中的 n(Co2)06 mol03 mol03moln(O)(03mol303 mol2)2075mol故 n(Co)n(O)06 mol075 mol45考点:考查化学计算的有关问题2(1)提高铁元素的浸出率,同时抑制铁离子的水解。 SiO (2)FeS + 14Fe3+ + 8H O 22215Fe2+ + 2SO42-+16H+第 6 页 共 11 页(3)中和溶液中的酸,调节溶液的 pH,使 Fe2+全部转化为 FeCO Fe(OH)取最后32一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。(4)4FeCO +O32Fe O
13、 +4CO2 3 22【解析】试题分析:(1)将烧渣粉碎是增大接触面加快反应速率,增加硫酸量提高铁元素浸取率,同时抑制铁离子的水解。二氧化硅不溶解于酸,过滤分离;(2)根据流程得出还原后的产物为 Fe2+和 SO42-,根据氧化还原反应原理书写方程式;(3)煅烧产生二氧化碳可知沉淀为碳酸亚铁,沉淀时 pH过高会产生氢氧化亚铁沉淀;洗涤沉淀的操作是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。(4)煅烧时加入空气即氧气参与反应,生成氧化铁和二氧化碳。考点:考查化学工业流程的原理、实验操作等有关问题3(1) 0(2) 2Ni O +4H SO =4NiSO +
14、O +4H O42 32422(3)H S+2Fe3+=2Fe2+2H+S2(4)不能,因为冷却时,CO能与 Ni反应生成 Ni(CO)4(5)2Al2OH2H O=2AlO23H 22因为 Al溶于碱液生成 AlO2时在水中存在下列平衡:AlO2+2H2OAl(OH) +OH,OH3浓度过小,抑制 AlO2的水解程度过小,所以,产生的 Al(OH) 就会沉积下来进而阻止浸3出反应的持续进行。(6)Al(OH)3Al OAl。2 3【解析】试题分析:(1)在 Ni(CO) 中,碳元素的化合价与 CO相同,为+2价,故 Ni的化合价为 0;4(2)已知红土镍矿煅烧后生成 Ni O ,而加压酸浸后
15、浸出液 A中含有 Ni2+,说明 Ni元素被2 3还原,另外,在硫酸中反应只能是 O元素被氧化为 O ,故有关镍元素的加压酸浸的化学反2应方程式是 2Ni O +4H SO =4NiSO +O +4H O;42 32422(3)浸出液 A中含有大量的 Ni2+、少量的 H 和 Fe3+,通入 H S时,Fe3+发生还原反应:+2H2S+2Fe3+=2Fe2+2H+S;+第 7 页 共 11 页(4)“高温熔融”时不能将通入氩气换为通入 CO,因为冷却时,CO能与 Ni反应生成 Ni(CO) ;4(5)“碱浸”的目的是溶解镍铝合金中的 Al,使镍产生多孔结构,从而增强对氢气的强吸附性,Al溶于
16、NaOH溶液时发生反应的离子方程式为 2Al2OH2H O=2AlO23H ;浸2 2出反应所用 NaOH溶液的浓度要大,因为 Al溶于碱液生成 AlO2AlO2 +2H2O Al(OH) +OH ,OH 浓度过小,抑制 AlO2 的水解程度过小,所以,产生的Al(OH) 就会沉积下来进而阻止浸出反应的持续进行。时在水中存在下列平衡:-33(6)浸出液 B中存在 AlO2,首先要将 AlO2沉淀下来,一般是通入足量的 CO 生成 Al2(OH) ,然后脱水生成 Al O ,最后将 Al O 在熔融的状态下电解即可得到金属铝(加入冰32 32 3晶石可以降低 Al O 的熔点)。2 34.【答案
17、】(1)2Cu O+SO =CuSO +3Cu 取适量的最后一次洗涤液于试管中,向其中滴224加少量硝酸酸化的 AgNO 溶液,不出现白色沉淀,证明 Cu(OH) 洗涤干净23(2)白色沉淀 C白色沉淀溶解=3Cu2+ +NO+2H O+3Cl出现白色沉淀3CuCl+ 4H+NO32偏小AgCl在干燥过程中有少量分解(其它合理答案也可)(3)玻璃棒、滤纸36%的乙酸是为了除去 CuCl沉淀表面的酸和钠盐;无水乙醇是为了除去乙酸和水,快速干燥,防止氧化【解析】试题分析:实验 I和 II的不同点是配制 Cu(OH) 的溶液时铜盐的阴离子不同,导致现象2不同。在实验 II中,白色沉淀 C的生成一定与
18、 Cl-有关,试题给出了 CuCl的一些性质,是解决问题的关键。(1)Cu O固体加蒸馏水,通入 SO ,试管底部有少量紫红色固体 Cu,溶液呈蓝色 Cu2+,22说明 Cu O发生了歧化反应,同时 SO 被氧化。故反应的方程式是 2Cu O+SO =CuSO +3Cu;22224甲同学重新作实验 II的方法制备新制 Cu(OH) 悬浊液,过滤,用蒸馏水洗涤干净,防2止 Cu(OH) 中含有 Cl2,故适量的取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的 AgNO 溶液,不出现白色沉淀,证明 Cu(OH) 洗涤干净。23(2)由实验流程可知:后面实验加入蒸馏水得到白色沉淀分析铜盐只要 Cu
19、Cl,开始是第 8 页 共 11 页CuCl被溶解,能够溶解的试剂有浓盐酸和硝酸溶液;而 CuCl溶于硝酸后生成 Cu(NO )32溶液,再加入蒸馏水,不会白色沉淀溶解,故先加入的是浓盐酸。CuCl溶于稀硝酸,产生了气体 NO,CuCl中的铜元素被氧化;有 CuClAgCl可知:19.9g 143.5m(AgCl)=287g,而实际沉淀为 279g,偏小,说明 AgCl有损失,指99.5出损失的合理原因即可。(3)抽滤出沉淀操作时用到了抽滤瓶、布氏漏斗及玻璃棒、滤纸等;因为 Na SO 与 CuCl223反应为 Na SO +2CuCl +H O=Na SO +2CuCl+2HCl,故过滤后残
20、留在 CuCl表面是钠盐和酸,用22322436%的乙酸是为了除去这些杂质,而后无水乙醇是为了除去乙酸和水,快速干燥,防止氧化。5(1)CNH O H OHCO3NH (2)4mol2 2 2 3(3);取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性 NC;(4)安全瓶,防止倒吸;Na SO (5)NaOH溶液32(6)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(7)否【解析】试题分析:(1)常温下,氰化钠能与过氧化氢溶液反应,生成能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,根据原子守恒可知生成的酸式盐为碳酸氢钠,反应的离子方程式为 CNH O H OH
21、CO3NH ;2 2 2 3(2)处理 1molNaCN的同时消耗 1mol Na S O ,该反应中 S元素化合价由2价变为-2价,2 2 3得到 4个电子,则反应中转移 4mol电子;(3)CN中 C元素显2价,N元素显3价,说明 N非金属性强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,其检验方法为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性 NC;(4)二氧化硫易溶于水,b装置为安全瓶,防止倒吸;d装置吸收二氧化硫,d中溶质有NaOH、Na CO ,碱过量,还有亚硫酸钠生成;23(5)验结束后,装置 b中还有残留的二氧化硫,为防止污染空
22、气,应用氢氧化钠溶液吸收;,当 CN 反应结束时,滴入最后一滴硝酸银溶液,(6)Ag与 CN反应生成Ag(CN)2 第 9 页 共 11 页Ag与 I反应生成 AgI黄色沉淀,说明反应到达滴定终点;(7)消耗 AgNO 的物质的量为 15010-3L00001mol/L15010-7mol,根据方程3式 Ag+2CNAg(CN)2,处理的废水中氰化钠的质量为 15010-7mol249g/mol1.47 102 mg 0735mg/L050mg/L,所以14710-5g,废水中氰化钠的含量为0.0200L没有达到排放标准。考点:考查氧化还原反应、物质制备实验、物质含量测定等实验设计6(1)加快反应速率;SrCO 2HClSrCl H OCO 2322(2)2Fe2+H O +2H 2Fe3+2H O;能 (3)B;EG2 2 2(4)F
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 校园文化建设的策略与实践案例
- 2025年度电子加油卡定制化充值优惠方案合同
- 2025年度豪华别墅购买协议书分期付款及配套设施合同
- 2025年度银行贷款反担保合同履行监督合同
- 2025年度道路工程施工安全责任合同
- 2025年度商铺转租合同附带租赁区域品牌推广服务
- 2025年度货车司机劳动合同(附带物流配送服务协议)
- 2025年度销售团队激励机制及考核标准劳动合同补充协议
- 2025年度农家乐项目承包管理服务合同
- 2025年度网络安全短期技术支持人员劳动合同
- 2024-2030年中国产教融合行业市场运营态势及发展前景研判报告
- 2024年微生物检测试剂行业商业计划书
- 高中英语选择性必修一单词表
- 初中生物校本课程纲要
- 物业公司介绍
- JTGT H21-2011 公路桥梁技术状况评定标准
- 【永辉超市公司员工招聘问题及优化(12000字论文)】
- 中国直销发展四个阶段解析
- 2024届浙江省宁波市镇海区镇海中学高一物理第一学期期末质量检测试题含解析
- 部编版语文四年级下册 教材解读
- 《一次函数与方程、不等式》说课稿

评论
0/150
提交评论