



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
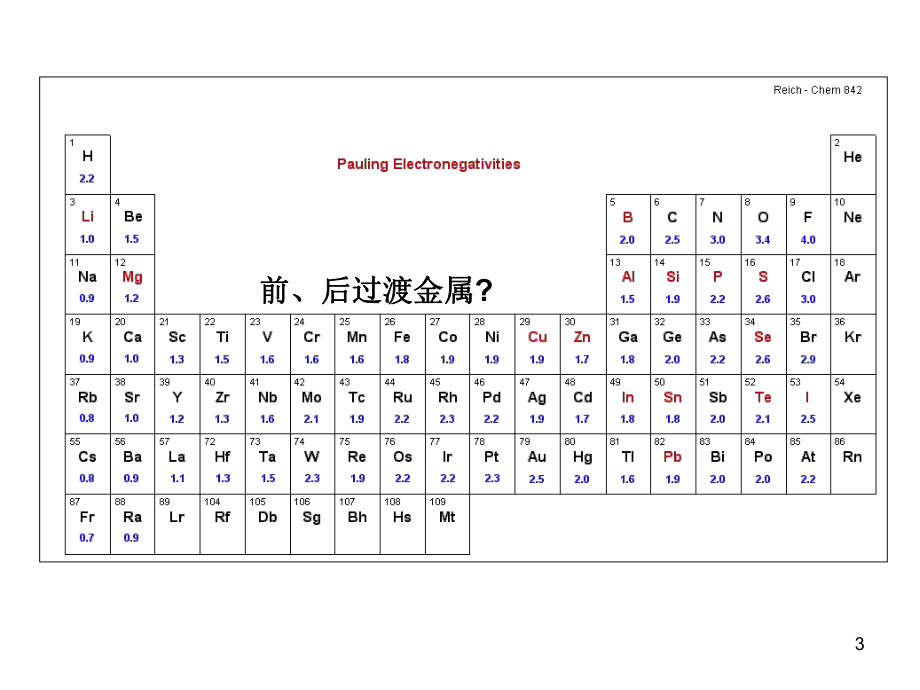
1、第四章第四章 过渡金属有机化合物过渡金属有机化合物本章要点:本章要点: 有效原子序数规则(有效原子序数规则(18电子规则);电子规则); 过渡金属有机化合物的主要合成方法和结构;过渡金属有机化合物的主要合成方法和结构; 过渡金属有机化合物的反应类型(基元反应)。过渡金属有机化合物的反应类型(基元反应)。1主要包括:主要包括:键配合物,键配合物, 键键配合物;也包括氢基配合物;也包括氢基配合物以及配合物以及N2, CO2, CS2, O2, NO,PR3配合物等。配合物等。前、后过渡金属前、后过渡金属?3八隅体规则和有效原子序数规则八隅体规则和有效原子序数规则 八隅体规则(八隅体规则(Octet
2、 rule):主要适用于主族金):主要适用于主族金属配合物。金属的价电子数与配体提供的电子数属配合物。金属的价电子数与配体提供的电子数总和等于总和等于8的分子是稳定的。如的分子是稳定的。如PbEt4、二茂铍二茂铍(Cp2Be) 有效原子序数规则(有效原子序数规则(effective atomic number rule):主要适用于过渡金属配合物。金属的全):主要适用于过渡金属配合物。金属的全部电子数与配体提供的电子数总和恰好等于金属部电子数与配体提供的电子数总和恰好等于金属所在周期中稀有气体的原子序数所在周期中稀有气体的原子序数(如果只考虑价电如果只考虑价电子,金属价电子数与配体提供的电子数
3、总和等于子,金属价电子数与配体提供的电子数总和等于18)的分子是稳定的。此时亦称为的分子是稳定的。此时亦称为18电子规则电子规则, 如二茂铁。当然,也有例外。如二茂铁。当然,也有例外。4 这个规则实际上是金属原子与配体成键时倾这个规则实际上是金属原子与配体成键时倾向于尽可能完全使用其九个价轨道向于尽可能完全使用其九个价轨道(五个五个d轨道、轨道、1个个s、三个、三个p轨道轨道)的表现。的表现。 有些时候,它不是有些时候,它不是18而是而是16。这是因为这是因为18e意意味着全部味着全部s、p、d价轨道都被利用,当金属电子过价轨道都被利用,当金属电子过多,负电荷累积多,负电荷累积, 此时如能以反
4、馈键此时如能以反馈键ML形式将形式将负电荷转移至配体,则负电荷转移至配体,则18e结构配合物稳定性较强结构配合物稳定性较强;如配体生成反馈键的能力较弱,不能从金属原;如配体生成反馈键的能力较弱,不能从金属原子上移去很多的电子云密度时,则形成子上移去很多的电子云密度时,则形成16电子结电子结构配合物。构配合物。 有效原子序数规则有效原子序数规则(18(18电子规则电子规则) )5配位数:配合物(包括络离子)与金属有机化合配位数:配合物(包括络离子)与金属有机化合物中,中心原子的配位数是指与它结合的物中,中心原子的配位数是指与它结合的配位配位的原子数或的原子数或配位的电子对数。(徐光宪)配位的电子
5、对数。(徐光宪)符合符合18电子规则的配合物称为电子规则的配合物称为配位饱和;反之,配位饱和;反之,称为配位不饱和。称为配位不饱和。后过渡金属一般遵守,一些前过渡金属化合物后过渡金属一般遵守,一些前过渡金属化合物和和稀土金属配合物一般不遵守此规则稀土金属配合物一般不遵守此规则。这个规则仅是一个经验规则,不是化学键的理论这个规则仅是一个经验规则,不是化学键的理论61818电子规则电子规则 如何计算价电子数如何计算价电子数: 过渡金属外层的过渡金属外层的d、s轨道能量相近,轨道能量相近,容易发生容易发生d/s跃迁,人们往往将跃迁,人们往往将d电子和电子和s电子的总和电子的总和称之为称之为d电子数。
6、电子数。金属的价态、配体的种类和电子数:共价模型或离子模金属的价态、配体的种类和电子数:共价模型或离子模型,但不可混用!可以互相验证。型,但不可混用!可以互相验证。离子模型指考虑金属的价态以及配体的形式电荷,而共价离子模型指考虑金属的价态以及配体的形式电荷,而共价模型则对金属和配体均以中性来处理。两种模型的不同之处模型则对金属和配体均以中性来处理。两种模型的不同之处在于考虑电子是在于考虑电子是“来自于来自于”金属还是配体。共价模型更适用金属还是配体。共价模型更适用于低价过渡金属特别是含有不饱和有机配体的配合物,而离于低价过渡金属特别是含有不饱和有机配体的配合物,而离子模型则对高价过渡金属特别是
7、含有氮、氧或卤素等配体的子模型则对高价过渡金属特别是含有氮、氧或卤素等配体的配合物更为适用。需要指出的是,在离子模型中,配体的价配合物更为适用。需要指出的是,在离子模型中,配体的价态是人为指定的,用不同的指定方法会有不同的价态。态是人为指定的,用不同的指定方法会有不同的价态。7中心金属的氧化态中心金属的氧化态 MLn (metal-ligand) 金属金属-配体配体 金属的氧化态:配体金属的氧化态:配体L以满壳层离开时,金属所以满壳层离开时,金属所保留的正电荷数保留的正电荷数 e.g. M-Cl 烃基一般表现为负离子,所以把它们看成是负离烃基一般表现为负离子,所以把它们看成是负离子时,贡献为子
8、时,贡献为1, e.g. M-CH3 中性配体中性配体(CO, H2C=CH2, PR3等等)的贡献为零的贡献为零 环戊二烯基环戊二烯基Cp为一价负离子为一价负离子 e.g. Cp2Fe, (Ph3P)3RhCl, Fe(CO)5, CH3Mn(CO)58常见的有机配体和常见的有机配体和齿合度齿合度MCR3MCCMCR2MCC9MCRCH2CHCH2MMMMM10+MMMMMM11有机配体按电子数的分类有机配体按电子数的分类12 茂茂 五甲基茂五甲基茂 茚茚 基基 芴芴 基基13 把配合物看成是给体把配合物看成是给体-受体的加合物,配体给予电子,受体的加合物,配体给予电子,金属接受电子;金属接
9、受电子; 对于经典单齿配体对于经典单齿配体,如胺、膦、卤离子、如胺、膦、卤离子、CO、H、烷基、烷基R和芳基和芳基Ar,都看作是二电子给予体。,都看作是二电子给予体。 Fe(CO)4H2 Ni(CO)4 Fe2+ 6 Ni 10 4CO 428 )4CO 428 )2H 224 10818 68418 在配阴离子或配阳离子的情况下,规定把离子的电荷算在配阴离子或配阳离子的情况下,规定把离子的电荷算在金属上。如:在金属上。如: Mn(CO)6: Mn+ 716, 6CO 6212, 61218 Co(CO)4: Co 9110, 4CO 428, 1081814 含含MM和桥联基团和桥联基团MC
10、OM。只计算其中一个金属只计算其中一个金属原子原子。规定一个化学键为一个金属贡献一个电子。规定一个化学键为一个金属贡献一个电子。 如如 Fe2(CO)9 其中有一个其中有一个FeFe金属键和金属键和3个个MCOM桥桥键键 Fe8,(93)/2 CO6, 3 CO 3,Fe 1, 86311815 对于对于 n 型给予体,如型给予体,如 1-茂基茂基( 给予体给予体), 5-茂基、茂基、 3-烯丙基、烯丙基、 6-C6H6( 给予体给予体)等等, n值一般代表了电子给予数目如:值一般代表了电子给予数目如: Fe(CO)2( 5-C5H5)( 1-C5H5) 2CO4, 5-C5H55(6), 1
11、-C5H51(2),Fe8(6), 电子总数电子总数4518(或或4626)18 Mn(CO)4( 3-CH2CHCH3) 4CO8, ( 3-CH2CHCH3)3(4), Mn7(6), 电子总数电子总数837 (或或846)18 Cr( 6-C6H6)2 2( 6C6H6)12,Cr 6, 电子总数电子总数12618162 EAN规则的应用规则的应用 估计化合物的稳定性估计化合物的稳定性 稳定的结构是稳定的结构是18或或16电子结构,奇数电子的羰基化合物可电子结构,奇数电子的羰基化合物可通过下列三种方式而得到稳定:通过下列三种方式而得到稳定: a 从还原剂夺得一个电子成为阴离子从还原剂夺得
12、一个电子成为阴离子M(CO)n; b 与其他含有一个未成对电子的原子或基团以共价键结合与其他含有一个未成对电子的原子或基团以共价键结合成成 HM(CO)n或或M(CO)nX; c 彼此结合生成为二聚体(金属彼此结合生成为二聚体(金属-金属键)。金属键)。 估计反应的方向或产物估计反应的方向或产物 如:如: Cr(CO)6C6H6 ? 由于苯分子是由于苯分子是6电子给予体,可取代三个电子给予体,可取代三个CO,因此预期其,因此预期其产物为:产物为: Cr(C6H6)(CO)3; 又如:又如:Mn2(CO)10Na ? Mn2(CO)10 7210234,平均为,平均为17,可从,可从Na夺得一夺
13、得一个电子成为负离子,即产物为:个电子成为负离子,即产物为:Mn(CO)5- 17烯烃烯烃- -配合物配合物Fe(CO)5+H2C=CHCH=CH2H2CH2CH2CCH2FeCOCOOCuv-COFe(CO)5+HCHCEtO2CCO2EtFeCOCOOCuv-COCHCO2EtCHCO2Et18 估算多原子分子中存在的估算多原子分子中存在的MM键数,并推测其结构键数,并推测其结构 如如 Ir4(CO)12 4Ir4936,12CO12224,平均每个平均每个Ir周围有周围有15e。 按按EAN规则规则,每个每个Ir还缺三还缺三个电子,因而每个个电子,因而每个Ir必须同另必须同另三个金属形成
14、三个三个金属形成三个MM键方键方能达到能达到 18e 的要求的要求, 通过形成通过形成四面体原子簇的结构四面体原子簇的结构, 就可达就可达到此目的。到此目的。需要指出的是,有些需要指出的是,有些配合物并不符合配合物并不符合EAN规则规则。以。以V(CO)6为例,它只有为例,它只有17个价电子个价电子, 预料它必须形成二聚体才能变得稳定,但实际上预料它必须形成二聚体才能变得稳定,但实际上 V2(CO)12 还不还不如如V(CO)6稳定。空间位阻妨碍二聚体的形成稳定。空间位阻妨碍二聚体的形成,因为当形成因为当形成V2(CO)12时,时,V的配位数变为的配位数变为7,配位体过于拥挤,配位体之间,配位
15、体过于拥挤,配位体之间的排斥作用超过二聚体中的排斥作用超过二聚体中V-V的成键作用。所以最终稳定的是的成键作用。所以最终稳定的是V(CO)6而不是二聚体而不是二聚体(只在只在10K能稳定能稳定)。 CO CO COCO Ir COCO Ir Ir COCO Ir CO CO CO CO19 Fe课堂练习:判断金属的氧化态,化合物是否符合课堂练习:判断金属的氧化态,化合物是否符合18电子规则?电子规则?Mo(CO)3Fe(CO)3OCFeCOFeCOOCVCOCOOCOCZrClCl20作业作业1Re+Fe+FeCOOCNa1、什么是八隅体规则和、什么是八隅体规则和18电子规则电子规则?计算下列
16、化合?计算下列化合物的价电子数。物的价电子数。V(CO)6, W(CO)6, Ir(CO)(PPh3)2Cl, Cp2Fe21什么是有效原子序数规则(什么是有效原子序数规则(1818电子规则)?电子规则)?(甲基环戊二烯基)羰基锰(甲基环戊二烯基)羰基锰(I)(I)是一种可用作是一种可用作汽油抗震剂的四乙基铅替代品。试写出其结汽油抗震剂的四乙基铅替代品。试写出其结构式,并计算其价电子数。构式,并计算其价电子数。分别写出二茂铁、三甲基铝和蔡斯盐的结构分别写出二茂铁、三甲基铝和蔡斯盐的结构. .课堂测验课堂测验(简答题简答题)含过渡金属含过渡金属M-C键配合物的合成键配合物的合成烷基过渡金属配合物
17、的分解过程烷基过渡金属配合物的分解过程消除消除还原消除还原消除2425含过渡金属含过渡金属M-CM-C键配合物的合成键配合物的合成26乙酰丙酮基乙酰丙酮基2,2-联吡啶联吡啶1,2-二二(二苯基膦基二苯基膦基)乙烷乙烷2728金属杂环配合物的合成金属杂环配合物的合成Ni(PR3)2Cl2+Li(CH2)4LiCH2CH2H2C(R3P)2NiH2CNi(cod)2+Br(CH2)4BrCH2CH2H2C(bpy)NiH2C+bpyPtCl2(cod)+BrMg(CH2)4MgBrCH2CH2H2C(Ph3P)2PtH2CPPh329芳基过渡金属配合物芳基过渡金属配合物30蔡斯盐蔡斯盐KPtCl
18、KPtCl3 3(C(C2 2H H4 4):): 丹麦药剂师丹麦药剂师乙醇乙醇不饱和烃配位化合物不饱和烃配位化合物 K2PtCl4 + C2H43119751975年中子衍射研究结果年中子衍射研究结果自由乙烯分子中自由乙烯分子中C=C 1.337(2) (配位碳碳(配位碳碳双键键长一般为双键键长一般为1.36-1.53 )C-C 1.375(4) 32C2H4的的 分子轨道与分子轨道与Pt2+的空的的空的dsp2轨道叠加成键,由轨道叠加成键,由C2H4提提供供 电子成电子成 配键,如图(配键,如图(b)所示;另一方面,)所示;另一方面,Pt2+的充满的充满电子的电子的d轨道(如轨道(如dxz
19、)和)和C2H4的的 *轨道叠加成键,由轨道叠加成键,由Pt2+提提供供d电子成电子成 配键,如图(配键,如图(a)所示。这样既可防止由于形成)所示。这样既可防止由于形成 配键使电荷过分集中到金属原子上,又促进成键作用。配键使电荷过分集中到金属原子上,又促进成键作用。 实验证据:键长,红外实验证据:键长,红外1623 1526 cm-1,核磁共振等,核磁共振等CCCCM+-M+-+-(a)(b)Dewar-Chatt-Duncanson (DCD) 模型模型Michael J. S. Dewar33炔烃配合物炔烃配合物 炔烃有两组相互垂直的成键和反键分子轨道,成键炔烃有两组相互垂直的成键和反键
20、分子轨道,成键 轨道和反轨道和反键键 *轨道都可以和对称性匹配的金属轨道都可以和对称性匹配的金属d 轨道发生重叠,即炔烃轨道发生重叠,即炔烃可以用两对可以用两对 电子同金属键合,因而可以加强金属与乙炔之间电子同金属键合,因而可以加强金属与乙炔之间的相互作用。除此之外,这两套轨道还可以各同各的金属相互的相互作用。除此之外,这两套轨道还可以各同各的金属相互作用,生成多核配合物,炔烃在其中起桥基的作用。作用,生成多核配合物,炔烃在其中起桥基的作用。PtCCPhPhPh3PPh3P132pm10339000140MMRRRRMRR34CO、N2、NO等配体,均为等配体,均为 电子对给予体,所以电子对给
21、予体,所以是路易斯碱。但同时又都有不同程度的接受反馈是路易斯碱。但同时又都有不同程度的接受反馈 电电子的能力,因而又都是路易斯酸。类似的配体还有子的能力,因而又都是路易斯酸。类似的配体还有CN-、PR3等。它们中有许多是以接受等。它们中有许多是以接受 电子形成反电子形成反馈馈 键为主,人们将这类配位体称为键为主,人们将这类配位体称为 酸配体酸配体。由这。由这类配体形成的配合物称为类配体形成的配合物称为 酸配合物酸配合物。 烯烃、炔烃配体:它们以烯烃、炔烃配体:它们以 键的电子云来和金属配键的电子云来和金属配位,所以通常将生成的配合物叫位,所以通常将生成的配合物叫 配合物配合物。该类配。该类配体
22、,即以体,即以 键电子云和金属配位的配体称为键电子云和金属配位的配体称为 配体配体。35一般合成方法:一般合成方法:1) C5H6 + Na (THF) C5H5 + Na+ + H2 FeCl2+ NaC5H5 (THF, 苯)苯) Fe( 5-C5H5)2 2) C5H6 + FeCl2 .4H2O (DMF) + KOH(s) Fe( 5-C5H5)23) C5H6 + FeCl2 + NHEt2 Fe( 5-C5H5)2环戊二烯基配合物的合成环戊二烯基配合物的合成3617gKOH+40ml4ml5gFeCl2 4H2O+17mlDMSO37Fluxional ferrocene 流变性
23、流变性,转动势垒低,转动势垒低, 3.8kJ.mol1固态:交错型固态:交错型d气相:重叠型气相:重叠型 室温时不规则室温时不规则金属茂化合物:例如二茂铁金属茂化合物:例如二茂铁 (Ferrocene)FeCp2 橘红色固体,溶于有机溶剂,和稀碱和酸不反应,橘红色固体,溶于有机溶剂,和稀碱和酸不反应,性质稳定,高于性质稳定,高于100 oC 升华升华 38金属茂的定金属茂的定性分子轨道性分子轨道能级图能级图配体群轨道配体群轨道39金属茂金属茂 ( metallocene)( metallocene)金属茂的合成金属茂的合成:MXn+NaC5H5 (THF or DMF) M( 5C5H5)2
24、M( 5C5H5)2 V Cr Mn Fe Co Ni价电子数价电子数 15 16 17 18 19 20其中,其中,Fe( 5C5H5)2为反磁性为反磁性, 其他茂金属为顺磁性其他茂金属为顺磁性40金属茂配合物金属茂配合物NiH+NiC5H6-Ni+Ni(C5H5)2NiNi(C5H5)2TiCl2(无水无水) + NaC5H5 (THF) Ti(C5H5)4TiTi( 5C5H5)2 ( 1C5H5)2 (深绿色固体深绿色固体)+41环戊二烯基环戊二烯基羰基混配化合物羰基混配化合物 Fe(CO)5+2 C5H6(二聚体二聚体) Fe2( 5C5H5)2(CO)4 + CO + H2 V(
25、5C5H5)2 +CO V( 5C5H5)(CO)4 OCFeCOFeCOOCFe2( 5C5H5)2( -CO)2 (CO)2 42金属茂的反应性金属茂的反应性 与亲电试剂反应与亲电试剂反应, 例如酰基化反应例如酰基化反应:+ CH3COClAlCl3FeCH3COClCOCH3FeFeCOCH3COCH3FeLiBu + FeLi+ C4H10与丁基锂的反应与丁基锂的反应: 锂化反应锂化反应43RCCR2MCR2CR2CR2MCR 3 1烯丙基配合物的两种结构形式烯丙基配合物的两种结构形式(C3H5)2Ni ?(C6H6)2Cr ?44氢基配合物的合成氢基配合物的合成45类羰基配合物:分子
26、氮配合物类羰基配合物:分子氮配合物MNNMNNMNNMNNMM end-on terminalend-on terminal end-on-bridging side-on terminal side-on bridging end-on-bridging side-on terminal side-on bridging46 配合物中的配合物中的N2可加合质子并被还原为氨或可加合质子并被还原为氨或肼肼.47二氧化碳配位化合物二氧化碳配位化合物48亚硝酰基配合物亚硝酰基配合物硫代羰基配合物硫代羰基配合物49作业2 过渡金属有机化合物的类型主要有哪些?以反应过渡金属有机化合物的类型主要有哪些?以
27、反应式举例说明过渡金属有机化合物的主要合成方法式举例说明过渡金属有机化合物的主要合成方法(两种以上)。(两种以上)。50金属有机化合物的基元反应金属有机化合物的基元反应 配体的配位和解离配体的配位和解离 氧化加成和还原消除氧化加成和还原消除 插入反应和消除插入反应和消除(反插入反插入)反应反应 与金属键合的配位体的反应与金属键合的配位体的反应必须指出,基元反应并非机理的分类,而只是反必须指出,基元反应并非机理的分类,而只是反应的类别。同一个基元反应可能有不同的机理。了应的类别。同一个基元反应可能有不同的机理。了解基元反应,可以阐明解基元反应,可以阐明配位催化配位催化的原理,设计新的的原理,设计
28、新的合成反应和催化反应合成反应和催化反应51Cross coupling: 交叉偶联反应交叉偶联反应 (RX + RM = R-R + MX) 黑克黑克 根岸英一根岸英一 铃木章铃木章金属有机化合物的基元反应金属有机化合物的基元反应52配位催化配位催化 配位催化配位催化:烯烃等简单分子与过渡金属离子配位,:烯烃等简单分子与过渡金属离子配位,形成一系列配位中间体,从而起到催化作用形成一系列配位中间体,从而起到催化作用 配位催化剂的配位催化剂的优点优点:反应条件温和、高活性、高:反应条件温和、高活性、高选择性【化学选择性,区域选择性,立体选择性,选择性【化学选择性,区域选择性,立体选择性,对映选择
29、性】对映选择性】53基元反应基元反应54基元反应基元反应55配体的配位和解离配体的配位和解离分子内配体的重新组合和电子转移,金属上包括溶分子内配体的重新组合和电子转移,金属上包括溶剂在内的配体分子或离子的配体或解离。剂在内的配体分子或离子的配体或解离。对有机合成反应有用的配合物:易于生成配位饱和对有机合成反应有用的配合物:易于生成配位饱和的配合物而易于分离和纯化;在特定的条件下又能的配合物而易于分离和纯化;在特定的条件下又能够发生配体解离而生成配位不饱和的物种。够发生配体解离而生成配位不饱和的物种。空的配位点空的配位点?配体的立体影响;电子影响;?配体的立体影响;电子影响;Pd(PPh3)4Pd(PPh3
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 委托协议和管理协议区别
- 2024一卡通系统定制开发与全国分销合作协议3篇
- 特种刮痧课程设计范文
- 病人传呼器课程设计
- 烧碱5万吨课程设计
- 心轴机械课程设计
- 手术室出科个人小结范文(5篇)
- 2025年山东济宁职业技术学院高层次(高技能)人才引进62人管理单位笔试遴选500模拟题附带答案详解
- 2025年山东济南平阴经济开发区管委会招聘3人管理单位笔试遴选500模拟题附带答案详解
- 2025年山东济南市水利局所属事业单位招考拟聘用人员管理单位笔试遴选500模拟题附带答案详解
- 2024年度上海市嘉定区工业厂房买卖合同2篇
- 2023-2024学年广东省广州市海珠区九年级(上)期末化学试卷(含答案)
- 青年应有鸿鹄志当骑骏马踏平川课件高三上学期励志主题班会
- 河北省唐山市2021-2022学年高三上学期语文期末试卷
- 华电甘肃能源有限公司华电系统内外招聘真题
- 员工宿舍管理条例
- 自动控制理论(哈尔滨工程大学)知到智慧树章节测试课后答案2024年秋哈尔滨工程大学
- 双减背景下基于核心素养小学语文阅读提升实践研究结题报告
- 新疆大学答辩模板课件模板
- 数值分析智慧树知到期末考试答案2024年
- 2024年浙江省新华书店集团招聘笔试参考题库附带答案详解

评论
0/150
提交评论