



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、2020-2021高考化学铜及其化合物推断题培优易错难题练习(含答案)一、铜及其化合物1.硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矶(CUSQ?5H2O)的生产流程示意图:胆矶和石膏(CaSQ?2H2O)在不同温度下的溶解度(g/100 g 水),见下表:温度(C)20406080100石膏0.320.260.150.110.07胆矶3244.661.883.8114(1)_ 浸出”操作中生成硫酸铜的总化学方程式是 _。(2)取样检验是为了确认 卩 63+是否除净。有同学设计了以下两种方案,在实验室分别对所取 样品按下列方案进行操作:方案一:取样于试管T滴加KSC
2、N溶液;方案二:径向层析T喷KSCN溶液1你认为上述两种方案设计更合理的是 _ ;2指出你认为不合理的方案存在的问题 _;(3)_ 操作1(蒸发浓缩、趁热过滤)趁热过滤的目的是 _ ;(4)_操作n具体方法是 _、(填操作方法)、洗涤后干燥,对产品进行干燥宜在 _(填 较高”或 不太高”)温度下,判断产品已经干燥的操作是_。(5)某实验小组模拟上述工业流程完成胆矶的制备,在整个实验过程中,使用的仪器除烧杯、酒精灯、玻璃棒、胶头滴管外,还有使用较频繁的玻璃仪器是_ (填仪器名称)。中学教材用胆矶而不用其它结晶水合物(如:FeSO?7H20、硝酸盐的结晶水合物、Na2SO?10H2O 等)来研究结
3、晶水含量测定实验,其优点可能是 _ (填字母)a.胆矶较易得到,其它结晶水合物较难得到b 胆矶较其它结晶水合物更易失去结晶水c. 胆矶失水后有较明显的特征即颜色变化d. CuSQ 不易分解,也不易与空气中物质反应含铁-廢铜J稀硝釀与稀硫酸混合液J Cui.Fey浸出-50?(浸出港)石灰浆调节pH I检验过滤-+操作1+操忙II亠产品|趁熱耳郵红棕鱼t 母海滤渣石口【答案】3Cu+2HNQ+3H2S04=3CuSQ+2N0f +4 出 0 方案二 C+的颜色对检验有干扰使CuSO4尽量溶解而石膏尽量析出冷却结晶 过滤 不太高 重复干燥冷却后称量直到连续两次称量相差不超过 0.001 g (或恒
4、重操作)漏斗 c d【解析】【分析】 含铁的废铜原料中加入稀硫酸和稀硝酸的混合溶液,溶解后得到浸出液,在浸出液中主要 含有 C/+、Fe3+、H+、SO42-,加入石灰浆调节溶液 pH,沉淀铁离子,过滤得到红褐色滤渣 为氢氧化铁沉淀,依据石膏和蓝矶的溶解度,控制100C,滤液中析出石膏,滤液中主要为硫酸铜,通过加热蒸发浓缩,冷却结晶,过滤、洗涤,干燥得到硫酸铜晶体,据此分析 解答。【详解】(1)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为 3Cu+2HNQ+3H2SO=3CuSC4+2NOf +4H2O,故答案为:3Cu+2HNOs+3H2SO=
5、3CuSO+2NOf +4H2O;方案一:取样于试管T滴加 KSCN 溶液,由于溶液中含有蓝色的铜离子会对现象有干 扰,不能检验铁离子的存在;方案二:径向层析T喷 KSCN 溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离的目的,不但可以分辨出铁离子还 能辨别出含有铜离子,故答案为:方案二;取样于试管T滴加 KSCN 溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验 铁离子的存在,故答案为:Cu2*的颜色对检验有干扰;(3) 由表中溶解度可知,胆矶的溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,因此操作I中趁热过滤可以使CuSQ 尽
6、量溶解而石膏尽量析出,故答案为:使 CuSO4尽量溶解而石膏尽量析出;(4) 从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;硫酸铜晶体受 热容易分解,因此干燥时温度不宜太高,当重复干燥冷却后称量直到连续两次称量相差不 超过 0.001 g,说明产品已经干燥,故答案为:冷却结晶;过滤;不太高;重复干燥冷却后 称量直到连续两次称量相差不超过 0.001 g;(5) 在整个实验过程中,除了滴加容易,蒸发浓缩、还有过滤操作,因此使用的仪器除烧 杯、酒精灯、玻璃棒、胶头滴管外,还有使用较频繁的玻璃仪器是漏斗,故答案为:漏 斗;(6) a 演示实验中选择试剂主要考虑操作是否简单,现象是否
7、明显,性质是否稳定等方面,不是因为胆矶较易得到,其它结晶水合物较难得到,故a 错误;b、加热含有结晶水的晶体,一般都容易失去结晶水,所以选用胆矶的原因不是胆矶较其它结晶水合物更易失去 结晶水,故 b错误;c、硫酸铜是无色晶体,含有结晶水的硫酸铜是蓝色固体,所以胆矶失 水后有较明显的颜色变化,便于观察,而Na2SQ?1OH2O 加热前后颜色没有变化,故 c 正确;d、硫酸铜比较稳定,不容易被氧化,便于通过质量差计算结晶水的质量,而硫酸亚铁 在空气中容易被氧化,影响测量结晶水含量,故d 正确;故答案为:cd。【点睛】本题的易错点和难点为( 1)中方程式的书写,要注意流程图中的浸出液中没有硝酸根离
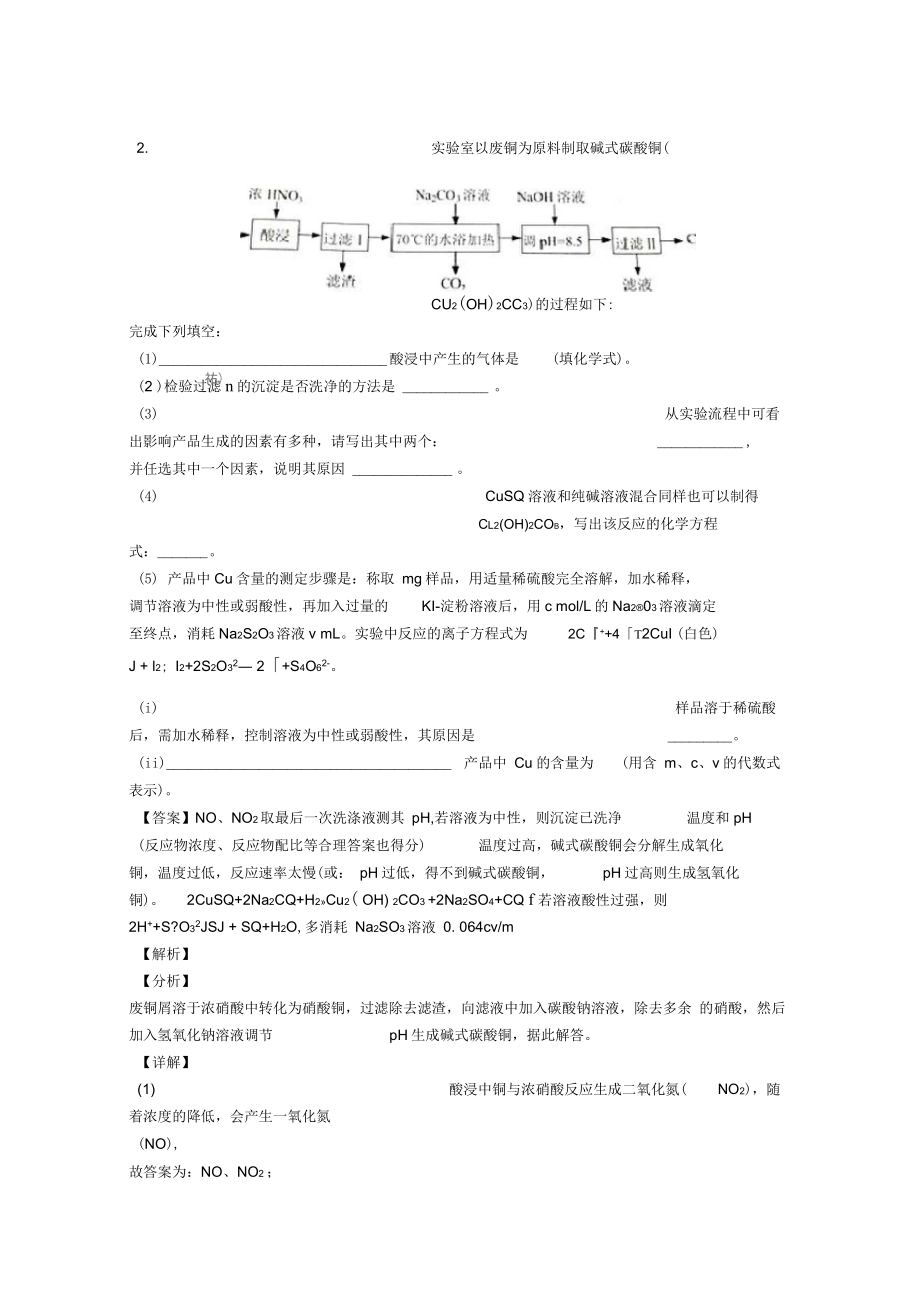
8、子,说明硝酸根离子完全反应,同时溶液为稀溶液。2.实验室以废铜为原料制取碱式碳酸铜(CU2(OH)2CC3)的过程如下:完成下列填空:(1)_酸浸中产生的气体是(填化学式)。(2 )检验过滤n的沉淀是否洗净的方法是 _ 。(3)从实验流程中可看出影响产品生成的因素有多种,请写出其中两个:_ ,并任选其中一个因素,说明其原因 _ 。(4)CuSQ 溶液和纯碱溶液混合同样也可以制得CL2(OH)2COB,写出该反应的化学方程式:_。(5) 产品中 Cu 含量的测定步骤是:称取 mg 样品,用适量稀硫酸完全溶解,加水稀释,调节溶液为中性或弱酸性,再加入过量的KI-淀粉溶液后,用 c mol/L 的
9、Na203溶液滴定至终点,消耗 Na2S2O3溶液 v mL。实验中反应的离子方程式为2C+4T2CuI (白色)J + l2; I2+2S2O32 2+S4O62-。(i)样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,其原因是_。(ii)_产品中 Cu 的含量为(用含 m、c、v 的代数式表示)。【答案】NO、NO2取最后一次洗涤液测其 pH,若溶液为中性,则沉淀已洗净温度和 pH(反应物浓度、反应物配比等合理答案也得分)温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢(或: pH 过低,得不到碱式碳酸铜,pH 过高则生成氢氧化铜)。2CuSQ+2Na2CQ+H2Cu2(
10、OH)2CO3+2Na2SO4+CQf若溶液酸性过强,则2H+S?O32JSJ + SQ+H2O,多消耗 Na2SO3溶液 0. 064cv/m【解析】【分析】废铜屑溶于浓硝酸中转化为硝酸铜,过滤除去滤渣,向滤液中加入碳酸钠溶液,除去多余 的硝酸,然后加入氢氧化钠溶液调节pH 生成碱式碳酸铜,据此解答。【详解】(1)酸浸中铜与浓硝酸反应生成二氧化氮(NO2),随着浓度的降低,会产生一氧化氮(NO),故答案为:NO、NO2;祐)(2) 根据流程分析可知,碱式碳酸铜是从含有碳酸钠的溶液中析出的,所以检验沉淀是否 洗净就是检验沉淀上有没碳酸根离子,操作方法是取最后一次洗涤液滴加氯化钡溶液,若 溶液中
11、没有出现沉淀,则沉淀已洗净,故答案为:取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净;(3 )从实验流程中可看出温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率 太慢,pH 过低,得不到碱式碳酸铜,pH 过高则生成氢氧化铜,所以影响产品生成的因素有温度和 pH,故答案为:温度和 pH;温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,或:pH 过低,得不到碱式碳酸铜,pH 过高则生成氢氧化铜;(4)CuSQ 溶液和纯碱溶液混合同样也可以制得Ci2( OH)2CO3,根据元素守恒可知反应 的化学方程式为 2CuSQ+2Na2CO3+H2OTCu2(OH)2
12、CQJ+2Na2SQ+CO2f,故答案为:2CuSQ+2Na2COs+H2O Cu2(OH)2CO3J +2Na2SQ+CC2f;(5) 样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,若溶液酸性过强,则2H+S?O32JSJ + SQ+H2O,多消耗 Na2S2O3溶液,故答案为:若溶液酸性过强,则2H+SO32-TSJ+SO2+H2O,多消耗 Na2SO 溶液;根据反应2CU2+4U2CuI (白色)J+I2. I2+2S2O32-T2I-+S4O62-可得关系式 C/+S2O32-,根据题意可知,Na2S2O3的物质的量为 cvxI0-3mol,所以样品中铜元素的质量为0.064c
13、vg,进而确定产品中 Cu 的含量为 0. 064cv/m,故答案为:0.064cv/m。3.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不 溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含Fe3、Cu2、Fe2、Cl)生产根据以上信息回答下列问题:(1)_生产过程中:X 是, Z 是。(均填化学式)(2)写出生成CuCl的离子方程式_。(3)_析出的CuCl晶体不用水而用无水乙醇洗涤的原因是 _。(4)在CuCl的生成过程中理论上不需要补充SC2气体,其理由是。712(5)已知:常温下KspCuCl 1.6 10,KspCuI 1.2 10,现向CuCl饱和溶
14、(6)实验探究 pH 对CuCl产率的影响如下表所示:pH1234567液中加入Nal固体至c I10.1mol L,此时溶液中c(Cu+)c(Cl-)CuCl产率/%70908278757270析出CuCl晶体最佳 pH 为_ ,当 pH 较大时CuCl产率变低的原因是 _。【答案】FeCl2或H2O2等合理答案亦可2Cc2+SQ+2C+2H2O=2CuCIJ+sO-+4H+减少产品CuCl的损失 Cu+2 H2SO(浓LCuSO+SQf+2H2O 反应中生成的 CuSO 和 SQ 为 1 : 1 ,CuC2+CuSQ+SQ+2H2O=2CuCIJ+2 HSO 反应中消耗 CuSQ 和 SO
15、2也为 1 : 1,所以理论上不需要补充 SQ 气体3 1082 pH 较大时,Cu2水解程度增大,反应生成CuCl减少【解析】【分析】根据流程图,蚀刻液为氯化铁溶液,则滤液为氯化亚铁,因此印刷电路的废液(含 Fe3+、C+、Fe2+ C)中应先加入过量的铁粉除去铜离子和铁离子,过滤后,在滤液1 中通入过量的氯气,可生成氯化铁,用于制作蚀刻液;滤渣含有铜、铁,加入过量的盐酸除去 铁,滤液为氯化亚铁,滤渣中含有铜,可与浓硫酸反应生成硫酸铜和二氧化硫,铜与 氯气反应生成氯化铜,调节溶液pH,可生成硫酸和 CuCl 晶体,据此分析解答。【详解】(1)由以上分析可知 X 是 Fe,Z 是 Cl2,故答
16、案为:Fe; Cl2;生成 CuCl 的离子方程式为2CLT+SQ+2C+2H2O=2CUCIJ+SO-+4H+,故答案为:2CiT+SQ+2C-+2H2O=2CuCIJ+S0-+4H+;(3)氯化亚铜微溶于水、不溶于乙醇和稀硫酸,析出的CuCl 晶体不用水而用无水乙醇洗涤,可减少产品 CuCl 的损失,同时乙醇易挥发,便于干燥,故答案为:减少产品CuCl 的损失;(4)依据图示可知:Cu+2 H2SC4(浓)/LCuSO+SQf+2H2O 反应中生成的 CuSO 和 SQ 为1 : 1,CUC2+CUSQ+SQ+2H2O=2CUCIJ+2 HSO4反应中消耗 CuSO 和 SC2也为 1 :
17、 1,所以理 论上不需要补充 SQ 气体,故答案为:Cu+2 H2SC4(浓)_CuSO+SC2f+2H2O 反应中生成的 CuSC4和 SC2为 1 : 1,CuCb+CuSQ+SQ+2H2O = 2CuClJ+2SO 反应中消耗 CuSC4和 SQ 也为1 : 1,所以理论上不需要补充SQ 气体;常温下 Ksp(CuCI)=1.6 文,CKsp(Cul)=1.2 乂勺 0 现向 CuCl 饱和溶液中加入 Nal 固体至 c(6) 由表中数据可知,析出 CuCl 晶体最佳 pH 为 2,pH 较大时,铜离子水解程度增大,反应 生成CuCl 减少,CuCl 产率降低,故答案为:2; pH 较大
18、时,铜离子水解程度增大,反应生 成 CuCl 减少。【点睛】根据实验目的正确理解实验流程图是解题的关键。本题的易错点和难点为 反应的方程式分析判断。4.工业上由含铜废料(含有 Cu、CuS CuSQ 等)制备硝酸铜晶体的流程如下:20% UNO:空气磴酸 陀)=0.1mol?L-1, c(Cu2+)=1.2 10120.1mol/L=1.2x10 c(C)=石6 107mol/L=4x-fbnol/L,此时溶液中c(Cu+)c(Cl-)1.2 10114 104=3x10,故答案为:3x1(?;(4),要注意根据遞液淘洗液(1) 焙烧”时 CuS 转化为 CuO 和 SQ,反应的化学方程式为
19、_(2) 酸化”步骤反应的离子方程式为 _ 。(3) 过滤”所得滤液中溶质的主要成分为 _。(4) 淘洗”所用的溶液 A 应选用 _ (填序号)。a.稀硫酸 b.浓硫酸 c 稀硝酸 d.浓硝酸(5)反应”一步的过程中发生反应CU+2HNO3+H2O2=CU(NO3)2+2H2O。该反应中被还原的物质为_。反应”一步中若不加 10%H2O2,只用浓 HNO3,随着反应的进行,容器内持续出现大量红棕色气体 NO2,请写出该反应的离子方程式 _。(6)由反应”所得溶液中尽可能多地析出CU(NO3)23H2O晶体的方法是 (相关物质的溶解度曲线如图所示 )10 JO dO SWAft CA【答案】2C
20、US+3Q_2CUO+2SQCuO+2l4=Cu2+2H2O FeSO a H2Q CuO+4l4+2NO3-=CLT+2H2O+2NO2蒸发浓缩,冷却至 26.4 摄氏度时结晶【解析】【分析】工业上由含铜废料(含有 Cu、CuS CuSQ 等)制备硝酸铜晶体,废料通入空气焙烧后铜生成 氧化铜,硫化铜转化为 CuO 和 SQ,加入硫酸酸化生成硫酸铜,加入过量的铁发生置换反 应生成铜,过滤得到滤渣铁和铜,用冷水淘洗后加入20%的 HNO3和 0%的 H2O2发生反应,蒸发浓缩,降温至温度略高于26.4结晶,从反应”所得溶液中析出 Cu(NQ)2?3H2O。【详解】(1)CUS焙烧和氧气反应转化为
21、 CuO 和 SQ,根据电子守恒和元素守恒可知反应的化学方程A式为:2CuS+3Q 一 CuO+2SQ;(2)焙烧后主要为氧化铜,酸化过程氧化铜和氢离子反应生成铜离子和水,离子方程式为:CuO+2M=Cif+2H2O;(3) 根据分析可知过滤得到滤液主要为硫酸亚铁溶液,即过滤”所得滤液中溶质的主要成分为 FeSQ;(4) 淘洗加入酸不能具有强氧化性,否则会溶解铜,a、 稀硫酸,不能和铜反应,故a 选;b、 浓硫酸和铜常温下不反应,但遇到水溶解放出大量热,会和铜发生反应,故b 不选;c、 稀硝酸具有氧化性能氧化铜,故c 不选;d、浓硝酸能溶解铜,故 d 不选;故答案为:a ;(5) 该反应中 H
22、2O2中的氧元素由-1 价变为-2 价,化合价降低被还原;若不加 10%H2O2,只用 20%HNO3,铜和浓硝酸反应生成二氧化氮气体,反应的离子方程式为:Cu+4H+2NO3-=Ci?+2NO2f+2H2O;(6) 图象中结晶水合物的溶解度随温度变化曲线可知,温度高于26.4 C 溶液中才能析出Cu(NO3)2?3H2O,所以从 反应”所得溶液中析出 Cu(NO3)2?3H2O 的方法是:蒸发浓缩,降温 至温度略高于 26.4 结晶。【点睛】配平氧化还原方程式时先分析元素化合价的变化,找出氧化剂还原剂和氧化产物还原产 物,之后依据电子守恒和元素守恒配平反应方程式。5. FeC3溶液可以蚀刻印
23、刷电路板上的Cu。某实验兴趣小组模拟该过程,并回收Cu 和蚀刻液的流程如下:(1)_蚀刻”时的化学反应方程式为 。(2)_滤渣的成分为。(3)反应n”的离子方程式为 _。【答案】2FeC3+ Cu= 2FeC2+ CuC2Cu Fe 2F(F+ Cb= 2Fe3+ 2Cl【解析】【分析】 按流程中的试剂用量和操作步骤综合考虑;【详解】(1)溶液在 蚀刻”铜时氯化铁被还原,铜被氧化,化学反应方程式为2FeC3+ Cu= 2FeC2+ CuC2答案为:2FeC3+ Cu= 2FeCb+ CuCb;(2)铁置换出了铜,又因为铁粉过量,所以滤渣的成分为Cu、Fe;答案为:Cu、Fe;(3)滤液中溶质只
24、有 FeC2,被通入的氯气氧化,QiI1收的匕幼液反应n”的离子方程式为 2Fe2+ Cb =2Fe3+ 2C;答案为:2Fe2+ Cb= 2Fe3+ 2C。6. Ag2OZn 纽扣电池的固体拆解物中含Ag20、Ag、Zn、Cu 石墨等物质,从中可提取金属银。如图是简要生产流程。(1 )固体拆解物需先粉碎的目的是。(2)浸渣的主要成分是_。(3) 以上流程中可循环使用的物质是,除此之外,你认为通过对 (填流程图中的物质代号)的回收处理,还有可能实现(填化学式)的循环利用。(4) 加入 Cu 之前若溶液的酸性太强,需适当调节溶液的pH,原因是(用离子方程式表示).(5)有人在实验室中利用如下方案
25、回收银:稀硝釀麻氨水Zn 粉已知:Ag+2NH3 Ag(NH3)2+K 稳=1.7X10 Ksp( AgCI)=1.8X110 写出 AgCl (s)与 NH3反应的离子方程式 _,该反应的平衡常数 K=(6) 上述两种回收方案中都用到了试剂X, X 是_。A.稀硫酸 B.稀硝酸C. CuSQ 溶液(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA, 1 小时后,得到 Ag_g (列出计算式,已知 1 个电子所带电量为 1.6X110C,阿伏伽德 罗常数的值用NA表示)。【答案】增加酸浸速率,提高浸取率石墨 Cu 滤液H、川 Zn+2+3Cu+8H +2NO3=
26、3Cu +2NO +4H2OAgCI+2NH3? Ag(NH3)2+C3.06X1A2.43 1024yNA【解析】【详解】(1 )粉碎是为了更好的酸浸,所以目的是增大接触面积,加快酸浸速率,故答案为:增加酸浸速率,提高浸取率;(2)石墨不与稀硝酸反应,故滤渣为石墨,故答案为:石墨;(3) 根据流程图知,固体混合物中含铜,回收可参与循环利用,而滤液n、川中均含有Zn2+,可回收加以循环利用,故答案为:Cu;滤液n、川;Zn;(4)加入 Cu 之前,若酸性太强, Cu 与稀硝酸发生氧化还原反应,反应的离子方程式为3Cu+8H+2NO3=3Cu2+2NO +4H20,+2+故答案为:3Cu+8H
27、+2NO3=3CU+2NO +4H2O;(5) 由信息可得,AgCI 溶于 NH3的离子方程式为 AgCI+2Nf?Ag(NH3)2+C-;该反应的c AgNH3cCl c Ag NH3 2平衡常数为K Ag3 2_ =丄一c2NH3c Agc2NH3Ksp=1.7X1(0 1.8 乂11=3.06X1Q故答案为:AgCI+2NH3?Ag(NH3)2+C; 3.06X10;(6)第一种回收方法中,固体混合物与X 反应后,生成物中有铜,在固体混合物中含Zn和 Cu,要回收 Cu,可利用稀硫酸和 CuSQ 溶液,而第二种方法中,在固体混合物中含Zn和 Ag,若要除去 Zn,则只能利用稀硫酸,故符合
28、题意的为A,故答案为:A ;(7) 1h=3600s, Q=lt=yX3600 根据题意回收的 Ag 的质量故答案为:242.43 10 y。NA7.工业上由含铜废料(含有 Cu、CuS CuSQ 等)制备硝酸铜晶体的流程如图:空气碇酸滤液淘洗液(1) “焙烧”时 CuS 转化为 CuQ 和 SQ,反应的化学方程式为(2)“酸化”步骤反应的离子方程式为。(3)“过滤”所得滤液中溶质的主要成分为_。(4)“淘洗”所用的溶液 A 应选用 _(填序号)。a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸c Ag+c Cl=K稳=n My 36001.6 1019NAmol 108g/mol=2.43 1
29、024yg,股气(5) “反应” 一步的过程中无红棕色气体生成。理论上消耗 HNQ3和 H2Q2的物质的量之比为 若不加 10%H2Q2,只用浓 HNQ3,随着反应的进行,容器内持续出现大量红棕色气体, 写出该反应的离子方程式(6)由“反应”所得溶液中尽可能多地析出CU(NQ)23H2O晶体的方法是。(相关物质的溶解度曲线如图所示)【答案】2CUS+3Q 高温2CUO+2SOCuO+2l4CU2+H2OFeSO a 2:1 Cu+4H+2NO3-=C+2NO2f+2H2O 蒸发浓缩,降温至温度略高于26.4 C 结晶【解析】【分析】工业上由含铜废料(含有 Cu、CUS CUSQ等)制备硝酸铜晶
30、体,废料通入空气焙烧后,铜生成氧化铜,硫化铜转化为 CuO 和 SQ,加入硫酸酸化生成硫酸铜,加入过量的铁发生置换反应生成铜,过滤得到滤渣铁和铜,用溶液A 淘洗后加入 20%的 HNO3和 10%的 H2O2发生反应,蒸发浓缩,降温至温度略高于26.4 结晶,从 反应”所得溶液中析出CU(NO3)2?3H2O,据此分析解答。【详解】(1)CUS焙烧和氧气反应转化为 CuO 和 SQ,反应的化学方程式为:2CuS+3Q2CuO+2SQ,故答案为:2CuS+3Q * 2CuO+2SQ;(2) 酸化过程为经过焙烧得到的氧化铜与稀硫酸反应生成铜离子,离子方程式为:CUO+2HFCU2+H2O,故答案为
31、:CUO+2HCU2+H2O;(3) 根据上述分析可知,过滤得到滤液主要为硫酸亚铁溶液,故答案为:FeSQ ;(4) 淘洗加入的酸不能具有强氧化性,否则会溶解铜。a.稀硫酸,不能和铜反应,故a选;b.浓硫酸和铜在常温下不反应,但浓硫酸稀释会放出大量热,会和铜发生反应,故b不选;c.稀硝酸具有氧化性能溶解铜,故c 不选;d 浓硝酸能溶解铜,故 d 不选;故答案为:a;反应”一步所用的试剂是 20%HNO3和 10%H2O2,硝酸做酸,过氧化氢做氧化剂将Cu氧化生成硝酸铜,反应的化学方程式为:CU+H2O2+2HNO3=CU(NO3)2+2H2O,理论上消耗HNO3和 H2O2的物质的量之比为 2
32、 : 1 ,故答案为:2 : 1 ;若不加 10%H2O2,只用浓 HNO3,铜和浓硝酸反应生成二氧化氮气体,反应的离子方程式 为:CU+4H+2NO3-=CU2+2NO2T+2H2O,故答案为:Cu+4H+2NO3-=Cu2+2NO2T+2H2O;(6)根据图像中结晶水合物的溶解度随温度变化曲线可知,温度高于26.4 C 从 反应”所得溶液中析出CU(NO3)2?3H2O,从反应”所得溶液中析出CU(NO3)2?3H2O的方法是:蒸发浓缩, 降温至温度略高于 26.4结晶,故答案为;蒸发浓缩,降温至温度略高于26.4 结晶。【点睛】本题的易错点为 ,要注意图像中温度的临界点为26.4。&am
33、p;我国古代许多著作在化学学科知识上都体现出了一定水平的认识。其中管子?地数中有记载:上有丹沙者,下有黄金;上有慈石者,下有铜金。”I“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是 _;(填化学式)慈石者磁石也”,请写出磁石溶于盐酸的离子方程式:_;n“铜金者,斑岩铜矿也。”安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu 主要以铜-铁硫化物(主要为 CuFeS)的形式存在。以黄铜矿(主要成份为 CuFeS,含少量 杂质 SiQ 等)为原料,进行生物炼铜,同时得到副产品绿矶(FeSO?7H20)。其主要流程如图
34、:已知:“反应 1”: 4CuFeS +2H2SO +176 4CuSO+2Fe2(SO)3+2H2O部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH 如表:沉淀物Cu(OH)Fe(OH)3Fe(OH)2开始沉淀 pH4.72.77.6完全沉淀 pH6.73.79.6(1) “反应 1 ”中,每生成 1 mol CuS04转移电子数为 _NA;“试剂 a ”是_,“试剂 b”是_;“反应 2”中加 CuO 调 pH 为 3.74.7 的目的是_ ;“操作 X”应为_ 、_ 、过滤、洗涤;请简述上述“操作X”中如何对所得FeSQ?7H2O 晶体进行洗涤_;简述如何判断“反应 5 ”已进行完
35、全: _。【答案】HgS FeO4+8H+= 2Fe3+Fe2+4H2O 17 Fe 粉 稀硫酸 使 Fe3+形成 Fe(OH)3沉 淀,防止生成 Cu(OH)2沉淀加热浓缩冷却结晶向漏斗中加入蒸馏水至浸没晶体,待水 自然流下,重复 2 -3 次 取少量反应后滤液加入几滴硫氰化钾溶液,若无明显现象则证明 反应进行完全【解析】【分析】I.实验室用硫磺粉处理洒落的水银,生成的产物为HgS;磁石的主要成分为四氧化三铁,过量湍血50*过滤与盐酸反应生成氯化铁、氯化亚铁和水;n.( 1)根据方程式中物质元素化合价的变化确定转移电子的数目;(2 )铁粉可将 Fe3+还原为 FW+;(3)将 pH 调节为
36、3.74.7,可将 Fe3+完全沉淀而不产生 Cu(OHb 沉淀;(4 )由溶液得到晶体,可进行加热浓缩、冷却结晶等操作;(5)反应 5 为硫酸铁与铁粉的反应,可用检验铁离子的方法检验是否反应完。【详解】I.由题意可知丹砂为实验室处理水银洒落后的产物,应为HgS 磁石的主要成分为四氧化三铁,与盐酸反应生成氯化铁、氯化亚铁和水,反应的离子方程式为Fe3O4+8H+= 2Fe3+Fe2+4H2O;n. (1)涉及反应为 4CuFeS +2H2SO4+ 176 4CuSO +2Fe2(SO4)3+2H2O,反应中 S 元素化合 价由-2价升高到+6 价,Fe 元素化合价由+2 价升高到+3 价,生成
37、 4molCuSC4,则消耗 17mol 氧气,转移 68mol电子,则生成 1molCuSO4,转移 17mol 电子,故答案为:17;(2) 试剂 a 是 Fe,试剂 b 是稀硫酸;(3)加 CuO 调 pH 为 3.74 的目的是使 Fe3+形成 Fe(OH)3沉淀,防止生成 Cu(OH)2沉淀,(4 )由溶液得到晶体,可进行加热浓缩、冷却结晶等操作,洗涤晶体,可向漏斗中加入蒸 馏水至浸没晶体,待水自然流下,重复2 - 3 次;(5) 反应 5 为硫酸铁与铁粉的反应,可用检验铁离子的方法检验是否反应完,方法是取少 量反应后滤液加入几滴硫氰化钾溶液,若无明显现象则证明反应进行完全。9.已知某工业废水中含有大量FeSQ,较多的 Cu2+,极少量的 Na+以及部分污泥,通过下列流程可从该废水中回收FeSQ7H2O 晶体及金属 Cu。(1)步骤 1 的主要操作是,需用到的玻璃仪器除烧杯外还有。(2) 固体混合物是_ (填化学式)(3) 步骤 3 中发生反应的化学方程式为
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 七年级地理人教版课件(上册+下册)
- 人教版小学数学五年级上册教学课件
- 异位妊娠的中医饮食护理
- 2025机械设备销售合同范本
- 学校安全第一课
- 2025停车场租赁合同范本
- 2025培训机构合作合同模板
- 破壳的小鸡美术课件
- 智慧树知到《孙子兵法中的思维智慧》(哈尔滨工程大学)章节测试答案
- 2025广告代理服务合同
- 冷却塔维修施工方案
- 航天发射场智能化-深度研究
- 信息时代背景下班主任提升班级管理工作效率的策略研究
- 旅游业员工工资保障措施建议
- 班组长、员工安全生产责任制考核记录表
- 老年康体指导职业教育79课件
- 北京市建设工程施工现场安全生产标准化管理图集(2019版)
- 2025年江苏省江宁城建集团招聘笔试参考题库含答案解析
- 大学生就业与创业指导知到智慧树章节测试课后答案2024年秋辽宁广告职业学院
- 高钛渣及其产品深加工项目的可行性研究报告
- 2024年中国黄油行业供需态势及进出口状况分析

评论
0/150
提交评论