



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、鲁科版必修第一册鲁科版必修第一册第第2 2节节 电解质的电离电解质的电离 离子反应离子反应第二课时第二课时 离子反应离子反应观察思考:观察思考: 实验:利用如图所示装置进行实验,向0.01molL-1Ba(OH)2溶液中滴入几滴酚酞溶液,然后向Ba(OH)2溶液中匀速逐滴加入0.2 molL-1H2SO4溶液,注意观察溶液中的现象和溶液电导率的变化。 你已经知道,硫酸和氢氧化钡都是电解质。那么,它们在溶于水时分别能电离出哪些离子?这些离子之间能发生怎样的反应?创原家独网科学1.溶液电导率由大到小接近零,再滴加时,又不断增大,说明了什么?2.溶液颜色为什么会由红色变成无色?3.白色沉淀的成分是什
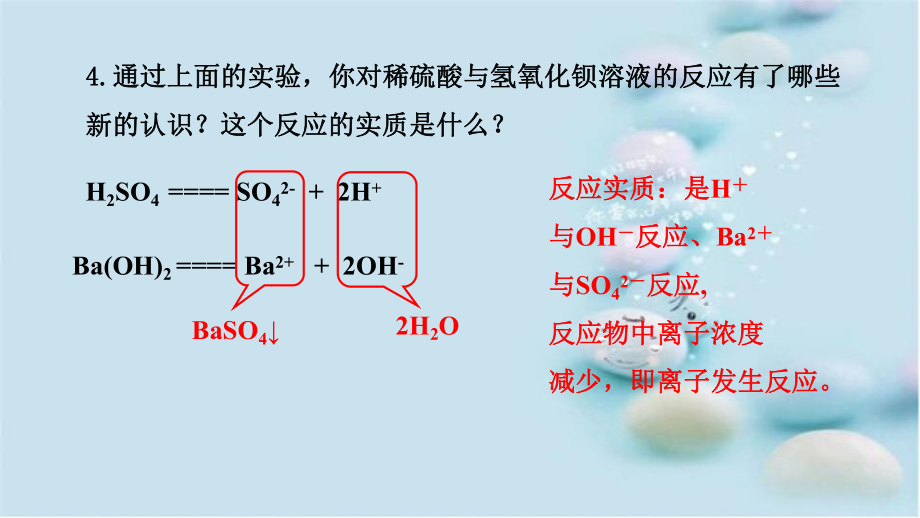
2、么?溶液中离子浓度减小,硫酸过量后离子浓度又增加溶液中离子浓度减小,硫酸过量后离子浓度又增加OHOH- - 浓度减小,浓度减小,H H+ + + OH+ OH- - = H= H2 2O OBaSOBaSO4 4BaBa2+ 2+ + SO+ SO4 42- 2- = BaSO= BaSO4 44.4.通过上面的实验,你对稀硫酸与氢氧化钡溶液的反应有了哪些通过上面的实验,你对稀硫酸与氢氧化钡溶液的反应有了哪些新的认识?这个反应的实质是什么?新的认识?这个反应的实质是什么?H2SO4 = SO42- + 2H+Ba(OH)2 = Ba2+ + 2OH-BaSO42H2O反应实质:是反应实质:是H
3、与与OH反应、反应、Ba2与与SO42反应反应, 反应物中离子浓度反应物中离子浓度减少,即离子发生反应。减少,即离子发生反应。 请分析下列各组电解质电离所产生的离子,说明混合后化学反应发生的实质,以及反应前后溶液中电解质所产生的离子的种类和数量的变化。(1)稀硫酸与NaOH溶液(2)CuSO4溶液与NaOH溶液(3)Na2CO3溶液与稀盐酸(4)NaCl溶液与AgNO3溶液(5)KCl溶液与AgNO3溶液交流研讨交流研讨(1)稀硫酸与NaOH溶液(2)CuSO4溶液与NaOH溶液(3)Na2CO3溶液与稀盐酸(4)NaCl溶液与AgNO3溶液(5)KCl溶液与AgNO3溶液H H+ +OH+O
4、H- -=H=H2 2O HO H+ +、OHOH- - 数目减少数目减少 CuCu2+2+2OH+2OH- -=Cu=Cu(OHOH)2 2 Cu Cu2+2+、OHOH- - 数目减少数目减少 COCO3 32-2-+2H+2H+ +=H=H2 2O+COO+CO2 2 CO CO3 32-2-、2H2H+ +数目减少数目减少 Cl Cl- -+Ag+Ag+ +=AgCl=AgCl Cl Cl- -、AgAg+ +数目减少数目减少 Cl Cl- -+Ag+Ag+ +=AgCl=AgCl Cl Cl- -、AgAg+ +数目减少数目减少 1 1、离子反应的含义、离子反应的含义 电解质溶液之间
5、发生的反应都是离子反应,电解质溶液之间发生的反应都是离子反应,都能使溶液中某种或某些离子的浓度发生改变。都能使溶液中某种或某些离子的浓度发生改变。在溶液中有离子参加的化学反应称为离子反应。在溶液中有离子参加的化学反应称为离子反应。二、离子反应二、离子反应发生的条件有难溶的物质生成;有难电离的物质(如:水)生成;有挥发性的气体生成。复分解反应都属于离子反应复分解反应都属于离子反应(1).概念:用实际参加反应的离子的符号表示离子反应的式子。 2 2、离子方程式、离子方程式(2).离子方程式的书写现以稀硫酸与Ba(OH) 2溶液的反应为例说明离子方程式的书写方法。明确反应物在溶液中的主要存在形式及微
6、粒间的数量关系,分别用离子符号或化学式表示硫酸的电离方程式为:H2SO4 =2H+ + SO42-氢氧化钡的电离方程式为:Ba(OH)2 = Ba2+ + 20H2.确定发生化学反应的微粒、产物及其数量关系3.写出离子方程式并配平2H+20H-+Ba2+SO42-=2H2O+BaSO41.书写下列各组物质间发生反应的离子方程式。NaOH溶液与稀硫酸(2)KOH溶液与稀盐酸(3)BaCl2 溶液与Na2SO4 溶液(4)Ba(NO3)2 溶液与 Na2SO4溶液(5)碳酸钙与稀盐酸H H+ +OH+OH- -=H=H2 2O OH H+ +OH+OH- -=H=H2 2O OBa2+SO42-=
7、BaSO4Ba2+SO42-=BaSO4CaCOCaCO3 3+2H+2H+ += H= H2 2O+COO+CO2 2+Ca+Ca2+2+ 2.观察你写出的离子方程式,回答下列问题。 (1)你认为离子方程式与化学方程式有哪些区别和联系? (2)对于你写出的每一个离子方程式,你能再补充一个与之对应的化学反应吗? 离离 子子 方方 程程 式式 所所 表表 示示 的的 不不 仅仅 仅仅 是一个化学反应,而是一类化学反是一个化学反应,而是一类化学反应,并揭示了这类化学反应的实质。应,并揭示了这类化学反应的实质。离子方程式的另一种书写方法离子方程式的另一种书写方法一写一写写出化学方程式;写出化学方程式
8、;二改二改改写化学方程式改写化学方程式四查四查检查离子方程式是否配平。检查离子方程式是否配平。以盐酸与氢氧化钠溶液所发生的反应为例以盐酸与氢氧化钠溶液所发生的反应为例NaOH+HCl=NaCl+ H2O 三删三删删去未参与反应的离子的符号得到离子方程式删去未参与反应的离子的符号得到离子方程式Na + + OH- +H+ +Cl- =Na + + Cl- + H2O Na+OH- +H+ +Cl- =Na + + Cl- + H2O OH- + H+ = = H2O 离子离子选用试剂选用试剂主要实验现象主要实验现象有关离子方程式有关离子方程式Cl- AgNO3溶液和稀溶液和稀HNO3SO42-
9、- 稀稀HCl和和BaCl2溶液溶液CO32- - 稀稀HCl和澄清石灰水和澄清石灰水NH4+ NaOH溶液溶液有白色沉淀有白色沉淀先加稀先加稀HCl,无明显现象,无明显现象再加再加BaCl2溶液有白色沉淀溶液有白色沉淀有能使石灰水变浑浊有能使石灰水变浑浊的无味气体的无味气体用湿润的红色石蕊试纸用湿润的红色石蕊试纸检验产生的气体,变蓝检验产生的气体,变蓝Ag+ + Cl- = AgClCO32- + 2H + = H2O +CO2CO2 + Ca(OH)2 = CaCO3+ H2OBa2+ + SO42- =BaSO4NH4+ + OH- NH3+ H2O3 3、离子反应的应用、离子反应的应用
10、(1 1)离子的检验)离子的检验(2 2)物质的分离与提纯)物质的分离与提纯食盐的精制 氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,并以它们为原料生产一系列化工产品。氯碱工业的主要原料是粗食盐。粗食盐中除了含有难溶性杂质外,还含有钙盐、镁盐等可溶性杂质。在氯碱工业中,这些可溶性杂质不但会增加生产能耗,还会带来安全隐患。因此,氯碱工业的一道重要工序是除去粗食盐水中的杂质。 实验目的实验目的从粗食盐水中除去Ca2+、Mg2+、SO42+。实验用品实验用品粗食盐水,稀盐酸,稀硫酸,NaOH溶液,Ba(OH)2溶液,Na2CO3溶液,BaCl2溶液;烧杯,漏斗,玻璃棒,表面皿, pH试纸,滤纸,试
11、管,胶头滴管,铁架台(带铁圈)。活动探究活动探究Na2CO3溶液NaOH溶液BaCl2溶液确定实验操作流程确定实验操作流程分析试剂添加顺序、实验操作步骤、每步操作后的结果,并用流程图表示。粗食盐水除去SO42-除去Mg2+除去Ca2+、过量的Ba2+过量的过量的BaCl2溶液溶液过量的过量的NaOH溶液溶液过滤过滤适量的适量的稀盐酸稀盐酸除去过量的OH-、CO32-操作流程操作流程1 1操作流程操作流程2 2除去BaSO4、Mg(OH)2、CaCO3沉淀过量的过量的Na2CO3溶液溶液粗食盐水除去SO42-除去Mg2+除去Ca2+、过量的Ba2+过量的过量的BaCl2溶液溶液过量的过量的NaO
12、H溶液溶液过滤过滤适量的适量的稀盐酸稀盐酸除去过量的OH-、CO32-除去BaSO4、Mg(OH)2、CaCO3沉淀过量的过量的Na2CO3溶液溶液所用试剂及实验操作所用试剂及实验操作实验现象实验现象解释和结论解释和结论1.向粗食盐水中滴加过量的BaCl2溶液。2.继续滴加过量的NaOH溶液。3.继续滴加过量的碳酸钠溶液。4.过滤。5.向滤液中滴加稀盐酸至溶液呈中性。实验方案实施实验方案实施白色沉淀生成白色沉淀生成白色沉淀生成白色沉淀生成白色沉淀生成白色沉淀生成除去SO42-除去Mg2+除去Ca2+、过量的Ba2+除去BaSO4、Mg(OH)2、CaCO3沉淀除去过量的OH-、CO32-思考:
13、思考:1. 如何确定除去杂质过程中试剂的添加顺序?2. 如何检验杂质离子是否去除干净? 不能引入新的杂质,如果不得不引入新的杂质,一定要再利用其它试剂把新引入的杂质除去; 为了保证除尽杂质,加入的除杂试剂一般应有所过量.一般在叙述时应该有这样的语言:“加入某物质至不再沉淀”或“加入某物质至不再产生气体为止”,这样的话一般意味着加入的除杂试剂适量或略有过量。 向上层清液中继续滴加原先的沉淀剂,如有浑浊出现则未沉淀完全,否则已经沉淀完全。二、离子反应二、离子反应1.1.离子反应的含义离子反应的含义在溶液中有离子参加的化学反应叫做离子反应。在溶液中有离子参加的化学反应叫做离子反应。2.2.离子方程式
14、离子方程式概念:用实际参加反应的离子离子的符号表示离子反应的式子书写方法:方法一明确反应物在溶液中的主要存在形式及微粒数量关系,分别用离子符号或化学式表示 确定发生化学反应的微粒、产物及其数量关系写出离子方程式并配平 方法二 : 书写步骤:一写一写 二改二改 三删三删 四查四查 3.3.离子反应的应用离子反应的应用(1) (1) 离子检验离子检验(2) (2) 物质的分离与提纯物质的分离与提纯 1 1、下列说法正确的一组是(、下列说法正确的一组是( )不溶于水的盐(不溶于水的盐(CaCO3、BaSO4等)都是弱电解质等)都是弱电解质易溶于水的电解质都是强电解质易溶于水的电解质都是强电解质 熔融
15、状态能导电的纯净物都是电解质熔融状态能导电的纯净物都是电解质强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度 电解质溶液导电是因为溶液中有自由移动的阴、阳离子电解质溶液导电是因为溶液中有自由移动的阴、阳离子0.5mol0.5molL L-1-1的所有一元酸的氢离子浓度都是的所有一元酸的氢离子浓度都是0.5mol0.5molL L-1-1A A、 B B、 C C、只有、只有 D D、只有、只有D D2 2、下列离子方程式的书写正确的是(、下列离子方程式的书写正确的是( )A A、实验室用大理石和稀盐酸制取、实验室用大理石和稀盐酸制取CO2
16、 2H+CO32-=CO2+H2OB B、铜片插入硝酸银溶液中、铜片插入硝酸银溶液中 Cu+2Ag+ = =Cu2+2AgC C、钠放入冷水:、钠放入冷水:Na+H2O=Na+OH-+H2D D、NaHCO3溶液与盐酸反应:溶液与盐酸反应: 2H+CO32-=CO2+H2OB B3 3、在某无色透明的酸性溶液中,能大量共存的离子组在某无色透明的酸性溶液中,能大量共存的离子组 是是 ( )( )A A、K、SO4 2 、CO32、Na B B、Na、ClO、K、NO3 C C、MnO4、K、SO42、Na D D、NH4、Al3、NO3、ClD D4 4、下列各组离子反应可以用下列各组离子反应可
17、以用H+ + OH- = H2O表示的表示的有有 ( )( )A A、Cu(OH)2和和HNO3B B、Ba(OH)2与与H2SO4 C C、CO2和和NaOH溶液溶液D D、H2SO4和和NaOHD D5 5、下列各组中的反应、下列各组中的反应( (反应在溶液中进行反应在溶液中进行) ),不可用同一离,不可用同一离子方程式表示的是(子方程式表示的是( )A A、NaOH+HCl=KOH+H2SO4B B、NaOH+H2SO4=Ba(OH)2+H2SO4C C、BaCl2+H2SO4=Ba(OH)2+Na2SO4D D、NaCl+AgNO3=HCl + AgNO3B B6 6、某酸性溶液中含有
18、、某酸性溶液中含有Ba2+、Fe3+,则下述离子组中,则下述离子组中能与上述离能与上述离子大量共存的是(子大量共存的是( )A A、CO32-、Cl- B B、NO3-、Cl- C C、NO3-、SO42- D D、OH -、NO3- B B7 7、下列离子方程式正确的是(、下列离子方程式正确的是( ) A A、氢氧化钡溶液与稀硫酸的反应、氢氧化钡溶液与稀硫酸的反应 OH H+ =H2OB B、澄清的石灰水与稀盐酸反应、澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2OC C、氯气溶于水:、氯气溶于水:Cl2 + H2O = H+ + Cl- + HClO D D、鸡蛋壳与食
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024-2025学年高中历史上学期第2周 专题五 现代中国的对外关系教学实录 必修1
- 23月光曲第二课时教学设计-2024-2025学年六年级上册语文统编版
- 27纪昌学射(教学设计)2024-2025学年四年级上册语文统编版
- 1 100以内的加法和减法(三) (教学设计)-2024-2025学年二年级上册数学苏教版
- 2016九年级化学下册 第十单元 酸和碱教学实录 新人教版
- A visit to the zoo(教学设计)-2024-2025学年外研版(三起)英语六年级上册
- 2024年五年级语文上册 第六单元 19 父爱之舟教学实录 新人教版
- 2024-2025学年高中历史 专题五 走向世界的资本主义市场 一 开辟文明交往的航线(4)教学教学实录 人民版必修2
- 2023一年级数学下册 一 100以内数的认识(综合与实践 有趣的数 )教学实录 西师大版
- 28 制作小台灯 (教学设计)-四年级科学上册青岛版(五四制)
- 水稳摊铺施工技术交底书
- 水泥混凝土路面试验检测的要点
- GB/T 20145-2006灯和灯系统的光生物安全性
- GB/T 1689-2014硫化橡胶耐磨性能的测定(用阿克隆磨耗试验机)
- 运输供应商年度评价表
- 室内消防及给排水管道安装施工方案方案
- 无创呼吸机参数调节课件
- 《元德秀字紫芝》2019年山东潍坊中考文言文阅读真题(含答案与翻译)
- 文件传阅单范本
- 电工培养计划表
- 建设“三型三化551”财务体系加快财务转型创建一流财务指导意见

评论
0/150
提交评论