



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
2024届广东省台山市华侨中学高考化学押题试卷
注意事项:
1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折暴、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(每题只有一个选项符合题意)
1、化学与人们的日常生活密切相关,下列叙述正确的是
A.二氧化硅是制造玻璃、光导纤维的原料
B.纤维素、油脂是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.NO、、CO2、PM2.5颗粒都会导致酸雨
2、下列有关化学用语和概念的表达理解正确的是()
A.立体烷和苯乙烯「、互为同分异构体
B.1,3一丁二烯的键线式可表示为二
C.二氟化氧分子电子式为F:O:F
,6
D.H*0、D2O.H」O、D9O互为同素异形体
3、依据反应2NaIO3+5SO2+4H2O=l2+3H2SO4+2NaHSO4,利用下列装置从含NnlOj的废液中制取单质碘的CCL溶液
并回收NaHSO4。其中装置正确且能达到相应实验目的是
4、对乙烯(CH2=CH2)的描述与事实不符的是
A.球棍模型:B.分子中六个原子在同一平面上
C.键角:10998,D.碳碳双键中的一根键容易断裂
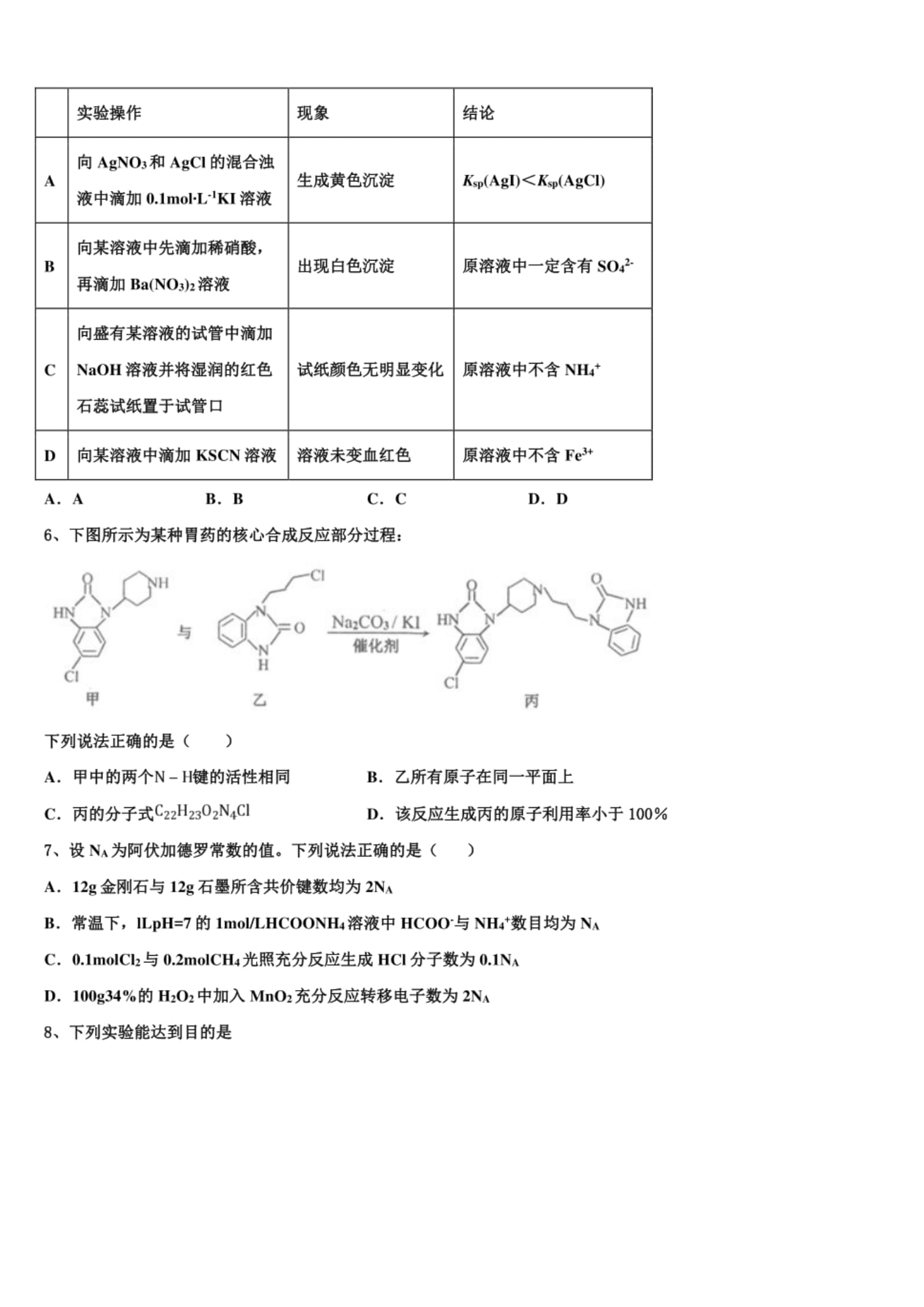
5、下列实验操作、现象和结论均正确的是()
实验操作现象结论
向AgNO3和AgCl的混合浊
生成黄色沉淀
A/Csp(AgI)<Ksp(AgCl)
液中滴加溶液
向某溶液中先滴加稀硝酸,
B出现白色沉淀原溶液中一定含有so?-
再滴加Ba(NO3)2溶液
向盛有某溶液的试管中滴加
CNaOH溶液并将湿润的红色试纸颜色无明显变化原溶液中不含NHZ
石惹试纸置于试管口
D向某溶液中滴加KSCN溶液溶液未变血红色原溶液中不含Fe3+
A.AB.BC.CI).D
6、下图所示为某种胃药的核心合成反应部分过程:
下列说法正确的是()
A.甲中的两个N-H键的活性相同B.乙所有原子在同一平面上
C.丙的分子式C22H2302N4clD.该反应生成丙的原子利用率小于100%
7、设NA为阿伏加德罗常数的值。下列说法正确的是()
A.12g金刚石与12g石墨所含共价键数均为2NA
B.常温下,lLpH=7的Imol/LHCOONHa溶液中HCOO-与NH4+数目均为NA
C.O.lmNCL与0.2molCH4光照充分反应生成HCI分子数为0.1NA
D.100g34%的H2O2中加入MnCh充分反应转移电子数为2NA
8、下列实验能达到目的是
9、液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态耕(N2H。为燃料的电池装置如图所示,该电
池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
A.b极发生氧化反应
B.a极的反应式:N2H4+4OlT-4e-=N2T+4H2。
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交液膜
10、NA表示阿伏加德罗常数的数值。乙醛(CH3cH20cH2cH3)是一种麻醉剂。制备乙醛的方法是
2cH3cH3cH20cH2cH3+H2O.下列说法正确的是
A.18gH分子含中子数目为IONA
B.每制备ImolCH3cH2180cH2cH3必形成共价键数目为4NA
C.10g46%酒精溶液中含H原子个数为1.2NA
D.标准状况下,4.48L乙醇含分子数为0.2N、
11、化学与人类生活、社会可持续发展密切相关,下列说法中不正确的是()
A.煤的气化与液化均为化学变化
B.大自然利用太阳能最成功的是植物的光合作用
是氢气与氮气在固体催化剂表面合成氨的反应过程示意图,下列有关合成氨反应的叙述中不正确的是()
A.过程②需吸收能量,过程③则放出能量
B.常温下该反应难以进行,是因为常温下反应物的化学键难以断裂
C.在催化剂的作用下,该反应的变小而使反应变得更容易发生
D.该过程表明,在化学反应中存在化学键的断裂与形成
16、聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与形成聚维酮碘,其结构表示如图
O
h
o,下列说法不正确的是()
-H-
CH「J吐总也一《±
A.聚维酮的单体是:火N)B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
二、非选择题(本题包括5小题)
17、美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:
SOCI,CHO
乙酸CH3COCI8X2C8H10O2
一定条件AICIB
囚3E
定
条CH30H
修
C9Hl2。2
回答下列问题:
(1)写出C中能在NaOH溶液里发生反应的官能团的名称o
(2)A-B和C-D的反应类型分别是、,H的分子式为
(3)反应E-F的化学方程式为o
(4)试剂X的分子式为CjHsOCL则X的结构简式为o
(5)B的同分异构体中,写出符合以下条件:①含有苯环;②能发生银镜反应;③苯环上只有一个取代基且能发生水
解反应的有机物的结构简式。
H0
(6)4一节基苯酚(©)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4一节基苯酚的合成路线:
(无机试剂任用)。
18、铁氨化钾(化学式为K3[Fe(CN)6J)主要应用于制药、电镀、造纸、钢铁生产等工业。其燃烧分解生成KCN、FeCz、
N2、(CN)2等物质。
(1)铁元素在周期表中的位置为,基态Fe3+核外电子排布式为。
(2)在[Fe(CN)6]3一中不存在的化学键有o
A.离子键B.金属键C.氢键D.共价键
(3)已知(CN)2性质类似CL:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCI=HCN+KCIHC=CH+HCN->H2C=CH-C=N
①KCNO中各元素原子的第一电离能由小到大排序为。
②丙烯脑(FhC=CH-C三N)分子中碳原子轨道杂化类型是_______;分子中。键和冗键数目之比为o
2
(4)C22-和Nz互为等电子体,CaCz晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC?晶体中哑铃形的C2
一使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C2?一数目为o
(5)金属Fe能与CO形成Fe(CO)s,该化合物熔点为一20℃,沸点为103'C,则其固体属于晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg・cn「3,铁原子的半径为nm(用含有d、NA的代数式
表示)。
图甲
19、碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KI03曾先后用于加碘盐中。KI还可用于分析试剂、
感光材料、制药等,其制备原理如下:
反应I:312+6KOH==KIO3+5KI+3H2。
反应II:3H2S+KIO3=3S|+KI+3H2O
-]氢铤化
区30%氢辄—三/钠溶液
化抑溶液k三
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为。装置中盛装30%氢氧化钾溶液的仪器名称是_________。
⑵关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为(填现象),停止滴
人KOH溶液;然后(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
⑶滴入硬酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是o
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸领,在过漉器中过滤,过漉得到的沉淀中除含有过量碳酸钦外,还含有硫酸
领和(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
⑸实验室模拟工业制备KIO3流程如下:
KI0;晶体
KCIOi溶液
几种物质的溶解度见下表:
KCIKH(1()3)2KCKh
251c时的溶解度(g)20.80.87.5
801时的溶解度(g)37.112.416.2
①由上表数据分析可知,“操作a”为o
②用惰性电极电解KI溶液也能制备KKh,与电解法相比,上述流程制备KIO3的缺点是
⑹某同学测定.上述流程生产的KIO3样品的纯度。
取LOOg样品溶于蒸馈水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0mo"L”Na2s2O3溶液,
恰好完全反应时共消耗12.60mLNa2403溶液。该样品中KKh的质量分数为(已知反
应:h+2Na2s2(h=2NaI+Na2s4。6)。
20、某学习小组研究溶液中Fe"的稳定性,进行如下实验,观察,记录结果。
2滴0.01molL1
,上一KSCN溶液一二4
2mL0.80mol-L*12mL0.80mol-L-1
FeSCh溶液SH-4.5)(NH4hFe(SO4的溶液(pH7.0)
实验I
物质0minIminlh5h
FeSO4淡黄色桔红色红色深红色
(NIL)2Fe(S04)2几乎无色淡黄色黄色桔红色
(1)上述(NH,zFe(SO,溶液pH小于FeSO,的原因是_______(用化学用语表示工溶液的稳定性:
FeS04(NH4)2Fe(S04)2(填或"V")°
(2)甲同学提出实验I中两溶液的稳定性差异可能是(MWzFelSODz溶液中的NH;保护了Fe",因为NH;具有还原性。
进行实验II,否定了该观点,补全该实验。
操作现象
取____一加一___,观察。与实验I中(NHDieCODz溶液现象相同。
(3)乙同学提出实验I中两溶液的稳定性差异是溶液酸性不同导致,进行实验皿:分别配制0.80mol-171pH为1、
2、3、4的FeSO,溶液,观察,发现pH=l的FeSO,溶液长时间无明显变化,pH越大,FeSO,溶液变黄的时间越短。
2>+
资料显示:亚铁盐溶液中存在反应4Fe+024-10H20=4Fe(0H)54-8H
由实验HL乙同学可得出的结论是_______,原因是_______。
(4)进一步研究在水溶液中Fe"的氧化机理。测定同浓度FeS04溶液在不同pH条件下,Fe?+的氧化速率与时间的关系
如图(实验过程中溶液温度几乎无变化,反应初期,氧化速率都逐渐增大的原因可能是____.
(5)综合以上实验,增强Fe"稳定性的措施有
21、形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习
物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是基态Ga原子核外电子占据最高能级的电子云轮廓图为
(2)HCmCNa(乙块钠)广泛用于有机合成,乙快钠中C原子的杂化类型为乙快钠中存在__(填字母)。
A.金属键B.c键C.九键I).氢键E.配位键E离子键G.范德华力
(3)Na*是汽车安全气囊中的主要化学成分,其阴离子的立体构型为一。写出和该阴离子互为等电子体的一种分
子的结构式一。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是一。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN的结构式可以表示为[S=C=N]•或[S-C三N「,SCN-
与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2・5和2.5。SCN•中提供孤电子对的原子可
能是__0
(6)某离子晶体的晶胞结构如图所示。
①晶体中在每个X周围与它最近且距离相等的X共有一个。
②设该晶体的摩尔质量为Mg-mol」,晶胞的密度为pg.cm+,阿伏加德罗常数为NA,则晶体中两人最近的X间的距
离为一cm。
参考答案
一、选择题(每题只有一个选项符合题意)
1、A
【解题分析】
A.二氧化硅是制造玻璃、光导纤维的原料,A正确;
B.纤维素属于天然有机高分子化合物,油脂是小分子,B错误;
C.福尔马林是甲醛的水溶液,福尔马林有毒,不能用于食物的保鲜和消毒,C错误;
D.导致酸雨的物质主要是SO2和NO.,CO2、PM2.5颗粒不会导致酸雨,D错误;
答案选A。
2、A
【解题分析】
△的分子式相同,但结构不同,互为同分异构体,A项正确;
A.立体烷和苯乙烯
B.1,3.丁二烯中含有2个C=C键,其键线式为:、B项错误;
C.二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为:;F:O:F;,C项错误;
••••••
,6,6I8
D.H2O.D2O>H2O.D2I8O是化合物,不是同素异形体,D项错误;
答案选A。
3、B
【解题分析】
依据实验步骤及操作的规范性、科学性分析作答。
【题目详解】
①浓硫酸在加热条件下与铜反应制取S02,装置正确且能达到相应实验目的;②气体和液体反应,有防倒吸装置,装
置正确且能达到相应实验目的;③用四氯化碳从废液中萃取碘,静置后分液,装置正确且能达到相应实验目的;④蒸
发溶液时用蒸发皿,而不应用用堪,装置错误,不能达到实验目的;故B项正确。
答案选IL
4、C
【解题分析】
A.球表示原子,棍表示化学键,则乙烯的球棍模型为选项A正确;
B.碳碳双键为平面结构,则分子中六个原子在同一平面上,选项B正确;
C.平面结构,键角为120。,正四面体结构的键角为109。281选项C错误;
D.碳碳双键比单键活泼,则碳碳双键中的一根键容易断裂,选项D正确;
答案选C
5、D
【解题分析】
A.AgNCh和AgCI的混合浊液中,含有硝酸银,银离子和碘离子反应生成黄色沉淀,因此不能说明^1)(AgI)<7Csp(AgCI),
故A错误:
B.可能含有亚硫酸根离子,故B错误;
C.向盛有某溶液的试管中滴加NaOH溶液并将湿润的红色石/试纸置于试管口,试纸颜色无明显变化,不能说明不
含钱根离子,一定要在加了氢氧化钠溶液后加热,故C错误;
D.向某溶液中滴加KSCN溶液,溶液未变血红色,原溶液中不含Fe“,故D正确。
综上所述,答案为D。
【题目点拨】
检验铁离子主要用KSCN,变血红色,则含有铁离子,检验亚铁离子,先加KSCN,无现象,再加氨水或酸性双氧水,
变为血红色,则含有亚铁离子。
6、D
【解题分析】
A.反应物甲中的两个N・H键的N原子连接不同的原子团,故两个N受其他原子或原子团的影响不同,则两个N・H键
的活性不同,A错误;
B.乙分子中含有饱和碳原子,与饱和碳原子成键的原子构成的是四面体结构,因此乙分子中所有原子不在同一平面上,
B错误;
C.由丙的结构简式可知其分子式为C22H24O2N5CI,C错误;
D.根据图示可知:化合物甲与乙反应产生丙外还有HC1生成,该反应生成丙的原子利用率小于100%,D正确;
故合理选项是Do
7、C
【解题分析】
A.石墨中每个碳通过三个共价键与其他碳原子相连,所以每个碳所属的共价键应为1.5,12g石墨是Imol碳,即有1.5NA
个共价键,而Imol金刚石中含2moi共价键,A错误;
B.甲酸为弱酸,一水合氨为弱碱,故HCOO•与NH4+在溶液发生水解,使其数目小于NA,B错误;
C.每有一个氯气分子与甲烷发生取代反应,则生成1个HC1分子,故O.lmolCL与0.2molCH4光照充分反应生成HC1
分子数为O.INA,C正确;
D.100澳4%%02为Imol,ImolH2O2分解生成ImolH2O和0.5molO2,转移电子ImoL数目为NA,D错误;
答案选C。
8、A
【解题分析】
A、N%极易溶于水,使烧瓶内压强减小,水溶液呈碱性,遇酚猷变红,形成红色喷泉,故A正确;B、从碘的四氯化
碳溶液中分离碘,应用蒸储装置,故B错误;C、SCh和CO2均能使澄清石灰水变浑,故C错误;D、铜与浓硫酸反
应要加热,故D错误;故选A。
9、B
【解题分析】
A、该燃料电池中,通入氧化剂空气的电极b为正极,正极上氧气得电子发生还原反应,A项错误;
B、通入燃料的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH-4e=N2T-4H2O,B项正确;
C、放电时,电流从正极b经过负载流向a极,C项错误;
D、该原电池中,正极上生成氢氧根离子,阴离子向负极移动,所以离子交换膜要选取阴离子交换膜,D项错误;
答案选B。
10、C
【解题分析】
A、18gH2加分子含中子数目为,“「邂।M0NA=9NA,故A错误;B、每制备ImolCH3cHz"OCH2cH3,分子间脱
水,形成C—O、O—H共价键,形成共价键数目为2NA,故B错误;C、10辞6%酒精溶液中,酒精4.6g,水5.4g,含
H原子=(.」.以「X6+-97\-K2)XNA=1.2NA,含H原子个数为L2NA,故C正确,D、标准状况下,4.48L乙醇
lost•n)l
为液态,故D错误:故选
11、C
【解题分析】
A.煤经气化、液化都生成新物质属于化学过程,故A正确;
B.太阳能应用最成功的是植物的光合作用,故B正确;
C.砖瓦陶瓷、渣土、卫生间废纸、瓷器碎片等难以回收的废弃物是其他垃圾,普通一次性电池属于有害垃圾,故C
错误;
D.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,符合题意,故D正确;
题目要求选不正确的选项,故选C。
【题目点拨】
本题考查了化学与生活、社会密切相关知识,主要考查白色污染、清洁能源、绿色化学等知识,掌握常识、理解原因
是关键。
12、B
【解题分析】
A.BaSO3和HNO3不能大量共存,白色沉淀是BaSO,,A项错误;
B.铁机化钾可氧化铁单质生成亚铁离子,Fe?+与KNFe(CN)6]溶液反应生成具有蓝色特征的铁瓶化亚铁沉淀,离子方
程式正确,B项正确;
C.不能排除是用硫酸对高锌酸钾溶液进行酸化,故酸化的高铳酸钾溶液中可能含有H2s04,则不能证明上述离子反
应一定发生,C项错误;
D.还原性:I->Fe2+,少量氯水优先氧化碘离子,高子方程式应为2I-+CL=l2+2CI-,D项错误;
答案选B。
【题目点拨】
离子方程式书写正误判断方法:
(D—查:检查离子反应方程式是否符合客观事实;
(2)二查:"=="“I”“t”是否使用恰当;
(3)三查:拆分是否正确。只有易溶于水的强电解质能拆写成离子,其他物质均不能拆写;
(4)四查:是否漏写离子反应;
(5)五查:反应物的“量”一一过量、少量、足量等;
(6)六查:是否符合三个守恒:质量守恒、电荷守恒以及得失电子守恒。
13、D
【解题分析】
由工艺流程分析可知,铜阳极泥经02堵烧得到TeCh,减浸时TcO2与NaOH反应得到NazTelW再经过氧化和酸化得
22+2
到TeCV,TeCh?―与Na2sCh发生氧化还原反应得到粗确,3SO3+TeO4+2H==Tel+H2O+3SO4,结合选项分析即可
解答。
【题目详解】
A.“焙烧”硅酸盐产品主要用到的仪器有:珀烟、泥三角、酒精灯和玻璃棒,不能用蒸发皿,A选项错误;
B.还原时发生反应:3SO?+TeO42+2H+==Tel+ll2O+3SO42,氧化剂为TeCh%还原剂SO3与物质的量之比与化学
计量数成正比,故为1:3,B选项错误;
C.“氧化”时氧化剂为H2O2,温度过高,H2O2会分解,氧化效果会减弱,C选项错误;
D.根据上述分析,并结合题干条件,TeCh微溶于水,易溶于强酸和强碱,Tc(h是两性氧化物,碱浸时反应的离子
方程式为Te(h+2OH-二TeCV—HzO,D选项正确;
答案选D。
14、C
【解题分析】
铁泥(主要成分为&2O3、FeO和少量Fe)与稀盐酸反应得到的滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加
入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)
2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余
2+
H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe+2OH=Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,以此
解答该题。
【题目详解】
A.钢铁表面的油污在碱性条件下可以发生水解反应,Na2cCh是强碱弱酸盐溶液,显碱性,热的NazCCh溶液可以让
油脂水解,水解是吸热的,温度升高,水解平衡向吸热的方向移动,水解效果越好,故A正确;
B.滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子和反应过量的盐酸:2Fe3++Fe=3Fe21故B
正确;
C.步骤④中,防止其在步骤⑤中继续氧化+2价铁元素,反应完成后需再加热一段时间除去剩余H2O2,故C错误;
D.超顺磁性的Fe3O4粒子平均直径25nm,属于胶体,可以做丁达尔效应实验,故D正确;
答案选C。
15、C
【解题分析】
A.根据示意图知,过程②化学键断裂需要吸收能量,过程③化学键形成则放出能量,故A正确;
B.化学键形断裂过程中吸收能量,故温度较低时不利于键的断裂,故B正确;
C.催化剂的作用原理是降低活化能,即反应物的化学键变得容易断裂,但AH不变,故C错误;
D.根据图示分析可知,该过程中,存在化学键的断裂与形成,故D正确。
故选c。
16、B
【解题分析】
由高聚物结构简式O&Q.
,可知主链只有C,为加聚产物,单体为N,°
II2C-6I
[CH.-CI1
高聚物可与HI3形成氢键,则也可与水形成氢键,可溶于水,含有肽键,可发生水解,以此解答该题。
【题目详解】
A.由高聚物结构简式可知聚维酮的单体是N故A正确;
ii2c-ai
0
L
鲁c由2m+n个单体加聚生成,故B错误;
,F1-O
-CH-CH]^[CH,CH]-
C.高聚物可与HI3形成氢键,则也可与水形成氢键,可溶于水,故c正确;
D.含有肽键,具有多肽化合物的性质,可发生水解生成氨基和粉基,故D正确;
故选B。
二、非选择题(本题包括5小题)
17、(酚)羟基;氯原子取代反应还原反应C15H25O3N
HO^0-CHX^2OHHOH-^^*HOHQ-CHKHiOCHj+H2O
+C3HCOOCH:o
OCOOH/^QHCOCI攵;
【解题分析】
O
由B的分子式、C的结构,可知B与氯气发生取代反应生成C,故B为/叫C发生还原反应生成D为
HO
IK对比D、E的分子式,结合反应条件,可知D中氯原子水解、酸化得到E为
H()-^^-CIi;CIL()II.由G的结构可知,E中醇羟基与甲醇发生分子间脱水反应生成F,F中酚羟基上H原
子被取代生成G,故F为对比G、美托洛尔的结构可知,G发生开环加成生成美托
洛尔。
【题目详解】
(1)由结构可知C中官能团为:(酚)羟基、埃基和氯原子,在氢氧化钠溶液中,由于和氯元素相邻的碳原子上没有氢原
子,不能发生消去反应,段基不与氢氧化钠反应,酚羟基有弱酸性,可以与氢氧化钠反应;
O
(2)B为根据流程图中A和B的结构式分析,A中的氯原子将苯酚上的氢原子取代得到B,则为取
HO
代反应;D为根据分析,C发生还原反应生成D;根据流程图中美托洛尔的结构简式,
每个节点为碳原子,每个碳原子形成4个共价键,不足键用氢原子补充,则H的分子式为Ci5H25O3N;
⑶E中醇羟基与甲醇发生分子间脱水反应生成F,化学方程式为:
HO-Q-CHKHQH+CH30H一定条件FH0-^-CH<HXKHJ+H2O.
(4)F为F中酚羟基上H原子被取代生成G,对比二者结构可知,X的结构简式为
CH:--CHCH:CI
oz
⑸B为,B的同分异构体中,含有苯环;能发生银镜反应,说明含有醛基;苯环上只有一个取代基
且能发生水解反应,故有机物的结构简式HCOOCH?一。;
(6)苯甲醇发生氧化反应生成苯甲醛,苯甲醛与苯酚反应生成,最后与Zn(Hg)/HC1
作用得到目标物。合成路线流程图为:
Zn(HgVHCI.
COOH-socu
一定条件
18、第四周期V1D族[Ar]3ds或l$22s22P63s23P63dsABK<C<O<Nspsp22:14分子
与3鹿XU
【解题分析】
(l)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,据此确定其在周期表的位置;基态Fe失
去4s上2个电子和3d轨道上1个电子即为Fe3+;
⑵根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①KCNO由K、C.N、O四种元素组成,K为金属、容易失去电子,第一电离能最小,C、N、0位于第二周期,
但N的p轨道是半充满状态、能量最低;
②丙烯摘(H2C=CH-C三N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp?两种形
式,其中C=C含有1个。键和1个五键、C三N含有1个。键和2个笈键,C-H都是。键,确定分子中。键和Jr键数
目,再求出比值;
(4)1个CM+周围距离最近且等距离的C2?「应位于同一平面,注意使晶胞沿一个方向拉长的特点;
(5)Fe(CO)5的熔点、沸点均不高,类似于分子晶体的特点;
12x56
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8x6+1=2,晶胞的质量为晶胞体积
83
112112
V=cm3>边长cm,根据Fe原子半径r与晶胞边长a关系求出r。
dW八\d.NA
【题目详解】
(l)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为快门3d64s2,位于第四周期Vffl族据;基态Fe失去4s
上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为)[AiJ3ds或人22s22P63s23P63ds故答案为:
第四周期VI族,[Ar]3d5或[Ar]3d§或Is22s22P63s23P63明
(2)[Fe(CN)6p-是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用
力,不是化学键,故选AB;故答案为:AB;
(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、
能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为
K<C<O<N;故答案为;K<C<O<N;
②丙烯脂(H2C=CH-ON)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形
式,其中C=C含有1个。键和1个孔键、ON含有1个。键和2个笈键,C-H都是。键,所以分子中。键和7T键数
目分别为6、3,。键和7T键数目之比为6:3=2:1;故答案为:sp、sp2;2:1;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca?+周围距离最近的C2?-不是
6个,而是4个,故答案为:4;
⑸根据Fe(CO)5的熔点、沸点均不高的特点,可推知Fe(CO)5为分子晶体;故答案为:分子;
12x56
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8xJ+1=2,晶胞的质量为一j「g,晶胞体积
8
112I112
v=-----cm3、边长a=?cm,Fe原子半径i•与晶胞边长a关系为4r=J5a,所以
_>/3_>/3小微故答案为:手煨X*
r------a-------
44
19、ZnS+H2SO4===H2St+ZnSO4恒压滴液漏斗无色打开启普发生器活塞,通入气体使溶液酸化并加
热,有利于溶液中剩余的硫化氢逸出,从而除去硫化氢硫蒸发浓缩、冷却结晶(或重结晶)KC1O3和L反
应时会产生有毒的氯气,污染环境;89.88%
【解题分析】
实验过程为:先关闭启普发生器活塞,在三颈烧瓶中滴入30%的KOH溶液,发生反应1:3b+6K0H==KIO3+5KI+
3H2O,将碘单质完全反应;然后打开启普发生器活塞,启普发生器中硫酸和硫化锌反应生成硫化氢气体,将气体通入
三颈烧瓶中发生反应11:3H2S+KIO3=3Sj+Kl+3H2O,将碘酸钾还原成KI,氢氧化钠溶液可以吸收未反应的硫化氢;
⑸实验室模拟工业制备KIO3:将12、HQ、KCKh水中混合发生氧化还原反应,生成KH(K)3)2,之后进行蒸发浓缩、
冷却结晶、过滤得到KH(IO3)2晶体,再与KOH溶液混合发生反应、过漉蒸发结晶得到碘酸钾晶体。
【题目详解】
(1)启普发生器中发生的反应是硫化锌和稀硫酸反应生成硫化氢气体和硫酸锌,反应的化学方程式:
ZnS+H2SO4===H2Sf+ZnSO4;根据仪器结构可知该仪器为恒压滴液漏斗;
⑵碘单质水溶液呈棕黄色,加入氢氧化钾后碘单质反应生成碘酸钾和碘化钾,完全反应后溶液变为无色;然后打开启
普发生器活塞,通入气体发生反应II;
⑶反应完成后溶液中溶有硫化氢,滴入硫酸并水浴加热可降低硫化氢的溶解度,使其逸出,从而除去硫化氢;
⑷根据反应n可知反应过程中有硫单卮生成,硫单质不溶于水:
⑸①根据表格数据可知温度较低时KH(K)3)2的溶解度很小,所以从混合液中分离KH(IO3)2晶体需要蒸发浓缩、冷却
结晶、过滤,所以操作a为蒸发浓缩、冷却结晶;
②根据流程可知该过程中有氯气产生,氯气有毒会污染空气,同时该过程中消耗了更多的药品:
⑹该滴定原理是:先加入过量的KI并酸化与KIO3发生反应:Kb-+5「+6H+===3l2+3H2O,然后利用Na2s2O3测定
生成的碘单质的量从而确定KKh的量;根据反应方程式可知IO.。-M2,根据滴定过程反应
b+2Na2s2O3===2NaI+Na2sXK可知b~2Na2s2O3,则有IO.0~6Na2s2O3,所用
〃(KI03)=0.01260Lx2.0mol/Lx-=0.0042mol,所以样品中KIO3的质量分数为°42T彳海如⑹*10。%=8/88%。
61.3g
【题目点拨】
启普发生器是块状固体和溶液不加热反应生成气体的制备装置。
-1-1
20、NHZ+HzO^^NH3・H2+H,<取2mLpH=4.0的0.80mol-LFeSCX溶液加2滴0.01mol-LKSCN
溶液溶液pH越小,Fe"越稳定溶液中存在平衡4Fe2++02+10H2。=4Fe(0H)3+8H\cW)大,对平衡的
抑制作用强,Fe,更稳定生成的Fe(0H”对反应有催化作用加一定量的酸;密封保存
【解题分析】
(1)(NH4)iFe(SO4)2溶液和FeSO」中的Fe?+浓度相同,但中(NH4)iFe(SO4)2含有浓度较高的NH4+;通过表
格中的颜色变化来分析;
(2)由于是要验证两溶液的稳定性差异是否是由于(NH。2Fe(SO4)2溶液中的NH4+保护了Fe?+导致,根据控制变
量法可知,应除了让NH4+这个影响因素外的其它影响因素均保持一致,据此分析;
(3)由实验DI可知,溶液的pH越小,溶液的酸性越强,则Fe?+越稳定;亚铁盐溶液中存在反应4Fe〃+O2+10H2O=4Fe
(OH)3+8H+,根据平衡的移动来分析;
(4)根据影响反应速率的因素有浓度、压强、温度和催化剂来分析;
(5)根据上述实验来分析。
【题目详解】
+
(1)(NH4)2Fe(SO4)2溶液和FeSCh中的Fe?+浓度相同,但(NH4)zFe(SO4)2溶液中含有浓度较高的NH4,NHJ
水解显酸性,导致(NHD2Fe(SO4)2中的pH更小;通过表格中的颜色变化可知(NHDzFe(SO4)2中的FF+被氧
++
化的速率更慢,即溶液的稳定性:FeSO4<(NH4)2Fe(SO4)2,故答案为:NH4+H2O=^NH3-H2O+H;<;
(2)由于是要验证两溶液的稳定性差异是否是由于(NIL)2Fe(SO4)2溶液中的NH4+保护了Fe?+导致,根据控制变
量法可知,应除了让NH4.这个影响因素外的其它影响因素均保持一致,故应取2mLpH=4.0的0.80mokL/FeS04溶液
于试管中,加2滴0.01mol・L」KSCN溶液,过若观察到的现象与实验I中(NH4)zFe(SO4)2溶液现象相同,则说
明上述猜想不正确,故答案为:取2mLpH=4.0的0.80mol・L/FeS04溶液;力口2滴0.01mol・L/KSCN溶液;
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。

评论
0/150
提交评论