



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
(3)离子反应一2025高考化学一轮复习易混易错专项复习
一、离子方程式正误判断方法
1、看是否符合客观事实。
2、看化学式拆写是否正确。氧化物、弱电解质、沉淀、多元弱酸的酸式酸根离子等不
能拆分。
3、看符号使用是否正确。尤其是“广”广。
4、看是否符合守恒关系。离子方程式要符合质量守恒、电荷守恒、得失电子守恒。
5、看是否漏掉部分离子之间的反应。
6、看反应物或产物配比是否正确。
看是否符合题设条件要求。要考虑“过量”“少量”“适量”"等物质的量”及滴加顺序对离子方
程式的影响。
二、离子共存判断方法
条件类
题目中的常见表述误点点悟
型
有色离子【MnO;(紫)、Cu2+(蓝)、Fe2+(浅
“无色”绿)、Fe3+(黄)、CrQ;(橙)、CrOj(黄)、
常见的
CF+(绿)等】不能大量共存
限制条
“pH=l或pH=13”溶液显酸性或碱性
件
“因发生氧化还原反应而不只能是氧化性离子和还原性离子不能大量
能大量共存”共存,不包括其他类型反应的离子
常见的“透明”“透明”也可“有色”
易错点“不能大量共存”易看成“大量共存”
“与A1反应放出H2”溶液既可能显酸性也可能显碱性
常见的“水电离的c(H+)=lxlO-
溶液既可能显酸性也可能显碱性
隐含条□molLi”
件“通入足量的NH3”与NH3H2O反应的离子不能大量共存
“NO3一”在酸性条件下具有强氧化性
“一定大量共存”
常见题
“可能大量共存”
干要求
“不能大量共存”
【典型例题】
L下列离子方程式书写正确的是()
+
A.二氧化氮气体溶液于水:2NO2+H20—2H+2NO;+NO
+2+
B.铜片加入稀硝酸中:3Cu+8H+2N0;—3CU+2N0T+4H2O
+3+
C.向稀硝酸中加入过量铁粉:Fe+4H+NO"—Fe+NOT+2H2O
A
D.氯化镂溶液中加入氢氧化钠溶液并加热:NH:+OH=NH3H2O
2.下列描述涉及反应的化学方程式亚睥且属于氧化还原反应的是()
A.服用含氢氧化铝的药物治疗胃酸过多:2Al(OHb+3H2SO4—Al2(SO4)3+6H2O
MnO2
B.用过氧化氢溶液制氧气:2H2。2^^。2个+2H2。
C.将铁丝浸入稀盐酸中:2Fe+6HCl—2FeCl3+3H2T
D.用食醋清洗水壶中的水垢:CaCO3+2CH3COOH—(CH3COO)2Ca+CO2T+H2O
3.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是()
A.Na\Ba2+>Cl、SO:B.Ca2\HCO;,Cl\K+
+
C.MnO4,K\I\HD.H\Cl、Na+、CO;
4.下列各组离子能够在指定的环境下大量共存的是()
A.酸性溶液中:Na+、K+、MnO;、Cl-
B.酸性溶液中:K+、NH:、C「、CO)
C碱性溶液中:Na+、K+、HCO-.CF
D.中性溶液中:K+、SO:-、C「、Na+
5.下列离子方程式书写正确的是()
A.向Ba(OH)2溶液中逐滴滴加NH4HSO4溶液至刚好沉淀完全:
2++
Ba+20IT+NH:+H+SOjNH3H2O+H2O+BaSO4J
+2+3+
B.Fe3()4和足量稀硝酸反应:Fe3O4+8H-Fe+2Fe+4H2O
C.过量SO2通入NaClO溶液中:S02+H20+CIO=HC1O+HSO;
2++
D.强碱性溶液中NaClO将Mi?+氧化成Mil。?:Mn+C1O+H2O=MnO2J+CF+2H
6.下图表示氯化钠溶液中微粒的的微观示意图。下列说法正确的是()
CI-
A.NaCl的电离过程需要在通电条件下才能完成
表示水合钠离子,水合氯离子也可以表示为甘1
C.NaCl由Na+和CP构成,故NaCl固体也能导电
D.NaCl溶液能导电,是在水分子的作用下电离出自由移动的水合钠离子和水合氯离子
7.为确定某溶液中的离子组成,进行如下实验:
①取少量溶液,加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体;
BaN
②在①溶液中再滴加(03)2溶液,产生白色沉淀;
③取②上层清液继续滴加Ba(NC)3)2溶液至无沉淀时,再滴加AgNOs溶液,产生白色沉淀。
根据实验现象,下列推断正确的是()
A.一定有CO:
B.一定有C「
C.一定有SO:
D.一定有HCO]
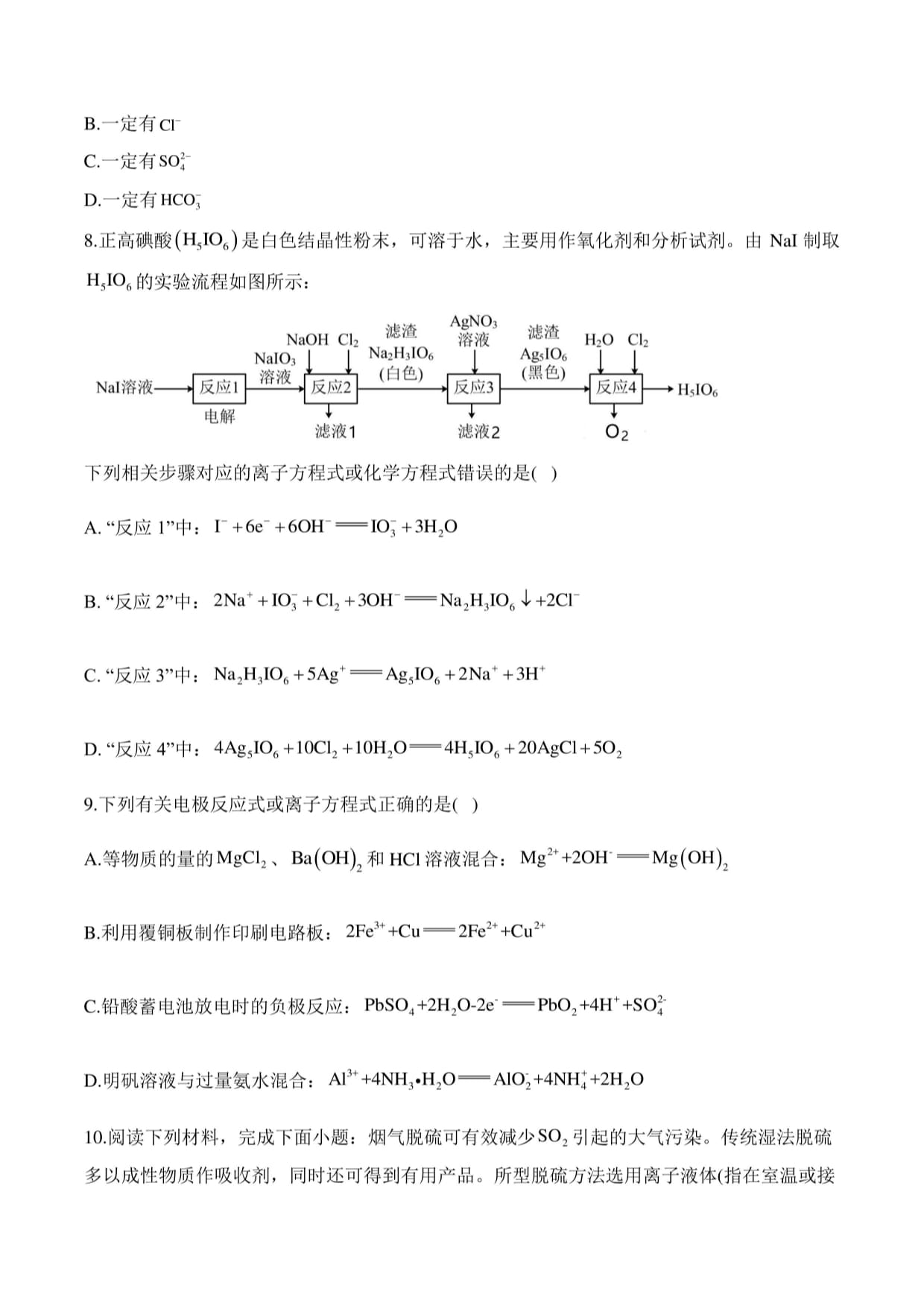
8.正高碘酸(国1。6)是白色结晶性粉末,可溶于水,主要用作氧化剂和分析试剂。由Nai制取
凡1。6的实验流程如图所示:
潴湾AgN03淮潜
NaOHCl2%'值溶液%'值H20Cl2
滤液1滤液2。2
下列相关步骤对应的离子方程式或化学方程式错误的是()
A."反应1”中:「+6—+6OH=10"+3H2O
+
B.“反应2”中:2Na+10-+Cl2+30H^Na2H3IO6J+2CF
+++
C.“反应3”中:Na2H3IO6+5Ag=Ag5IO6+2Na+3H
D.“反应4”中:4Ag5IO6+1OC12+10H2O^4H5IO6+20AgCl+5O2
9.下列有关电极反应式或离子方程式正确的是()
2+
A.等物质的量的MgQ、Ba(OH)2和HC1溶液混合:Mg+2OH—Mg(OH)2
B.利用覆铜板制作印刷电路板:2Fe3++Cu—2Fe2++Cu2+
+
C.铅酸蓄电池放电时的负极反应:PbSO4+2H2O-2e—PbO2+4H+S0j
3+
D.明矶溶液与过量氨水混合:Al+4NH3.H2O—A102+4NH:+2H2O
10.阅读下列材料,完成下面小题:烟气脱硫可有效减少SO?引起的大气污染。传统湿法脱硫
多以成性物质作吸收剂,同时还可得到有用产品。所型脱硫方法选用离子液体(指在室温或接
近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。
已知25℃时,几种酸的电离常数:H2sO3的Ka|=L3xl(y2、(2=6.2x10-8;H2co3的
(1=4.5x10,、Ka2=4.7xl0」i;CH3cH(OH)COOH(乳酸)的4=1.4x10”。
传统湿法脱硫涉及的下列离子方程式正确的是()
A.烟气与Na2SO3溶液的反应:SO2+SO;+H2O—HSO-
B.烟气与海水中HCO3的反应。:SO2+2HCO'—SO^-+2CO2+H2O
2+
C.烟气与石灰乳反应得到石膏:SO2+Ca+O2+2H2O—CaSO4-2H2O
D.烟气与氨水反应得到硫酸镂:2SO2+4NH3.H2O+O2—4NH:+280t+2H2O
IL下列反应的原理用离子方程式表示正确的是()
+
A.室温下,测得氯化镂溶液pH<7:NH:+2H2O^NH3.H2O+H3O
B.用氢氧化钠和铝粉做管道疏通剂:2A1+2OH-+2H2O^=2A1O;+3H2T
C.用碳酸氢钠溶液检验水杨酸中的竣基:
0H0"
+2HC0;T^j^+2H2O+2CO2t
COOHCOO-
D.用高镒酸钾标准溶液滴定草酸(H2c2O4,二元弱酸):
2M11O4+16H++5c20j^=2Mn2++10cO2T+8H2O
12.某工业废水中存在大量的Na+、Cl>Cu2\SOt,欲除去其中的Ci?+、SO:,设计工艺流
程如图所示:
--------NaOH试剂a操作X,-----试剂c---------
工业废水fTT|溶液TNa\Cl
1
---------------试剂b----
下列说法错误的是()
A.NaOH的作用是除去Cu?+
B.试剂a为Na?C03,试剂b为BaCl2
C.操作X为过滤,试剂c为稀盐酸
D.检验S。:是否除尽可取适量待测溶液,先加入盐酸,再加入Bad2溶液
13.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是()
AS2'.s?。:、Na+、0H-不能共存,S2-与S2。7发生氧化还原反应生成S
Na+、Al3+>C「、
B能够大量共存
NH3H2O
3+,+
cH2o2>Fe.sotK不能共存,Fe3+能催化H2O2分解
D「、NO;,Na+、H+能够大量共存
A.AB.BC.CD.D
14.向一定浓度的Ba(OH)2溶液中滴加NaHSC>4溶液,其电导率随滴入溶液体积变化的曲线如
图所示。下列分析正确的是()
电
导
率
|c
滴入溶液的体痴
A.ab段发生反应的离子方程式是:Ba2++SOt—BaSOj
B.c点溶液中大量存在的离子是Na+、SOj
C.b、d两点对应溶液中的离子总数目相等
2++
D.be段发生反应的离子方程式是:Ba+OH+H+SOt—BaSO4+H20
15.一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图:
NaOHNaClONaOH
滤液NaCkNa?SO,溶液
已知:Zn+2NaOH+2H2O^Na2[Zn(OH)4]+H2T
下列有关说法正确的是()
A.“酸溶”时,离子方程式为2Fe+6H+-2Fe3++3H2T
B.“氧化”时,离子方程式为2Fe?++C1CF+2H+-2Fe3++C「+凡0
C.“氧化”后的溶液中主要有Fe3+、Na\IT三种阳离子
D.两次加入NaOH溶液时均发生氧化还原反应
答案以及解析
L答案:B
+
解析:A.二氧化氮气体溶液于水生成硝酸和一氧化氮:3NO2+H20—2H+2N0;+NO,
故A错误;
B.铜片加入稀硝酸中,反应生成硝酸铜、一氧化氮和水,其反应离子方程式为:
+2+
3Cu+8H+2N0;—3CU+2N0T+4H2O,故B正确;
C.向稀硝酸中加入过量铁粉,生成硝酸亚铁、一氧化氮和水:
2+
3Fe+8H++2NO;3Fe+2NOT+4H2O,故C错误;
D.氯化镂溶液中加入氢氧化钠溶液并加热,生成氨气、水和氯化钠:
NH:+OH-=NH3?+H2O,故D错误。
综上所述,答案为B。
2.答案:B
解析:A、氢氧化铝和胃酸中的盐酸反应生成氯化铝和水,反应的化学方程式
为:A1(OH)3+3HC1—A1C13+3H2O,故选项错误。
MnO2
B、该化学方程式没有配平,正确的化学方程式应为:2凡。2^^2凡。+。2个,故选项错
误。
C、铁和盐酸反应生成氯化亚铁和氢气,正确的化学方程式为:Fe+2HC1-FeCU+^T,故
选项错误,
D、该化学方程式书写完全正确,故选项正确,故选:D。
3.答案:C
解析:A.Ba2+、SO:之间反应生成难溶物硫酸领,在溶液中不能大量共存,但不属于氧化还原
反应,A项错误;
B.Ca2\HCO;,Cl\K+之间不反应,在溶液中能够大量共存,B项错误;
C.MnO;、[、丁之间发生氧化还原反应,在溶液中不能大量共存,C项正确;
D.H+、C。;之间发生反应,在溶液中不能大量共存,但不属于氧化还原反应,D项错误;
答案选C。
4.答案:D
解析:A项中高镒酸根离子和氯离子会发生反应;B项中碳酸根离子与氢离子会发生反应;C
项中碳酸氢根离子和氢氧根离子会反应。
5.答案:A
解析:A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,二者的物质的量相等,
2++
反应的离子方程式为:Ba+2OH+H+SO^+NH:=BaSO4+NH3-H2O+H2O,故A
正确;
B.Fe3(D4中铁元素化合价有+2、+3,硝酸具有强氧化性能氧化亚铁离子,将Fes。,粉末溶于足
+3+
量的稀硝酸,离子方程式:3Fe3O4+28H+NO;-9Fe+NOT+14H2O,故B错误;
C.HC1O具有强氧化性,SO?具有还原性,二氧化硫能够还原次氯酸根离子,产物中HC1O与
+
HSO1还会发生氧化还原反应,离子方程式为:SO2+C1O+H2O—SOt+CF+2H-故C
错误;
D.在强碱性溶液中与H+不共存,,次氯酸钠将Mi?+氧化成MnC>2,离子方程式:
2+
CIO-+Mn+2OHMnO2J+C1-+H2O,故D错误;
故选:Ao
6.答案:D
解析:A.NaCl的电离过程不需要在通电条件下就能完成,NaCl在水溶液或熔融状态下会电
离成氯离子和钠离子,故A错误;
B.表示水合钠离子,水合氯离子可以表示为故B错误;
C.NaCl固体由Na卡和C「构成,但Na卡和C「不能自由移动,故NaCl固体不能导电,故C错
误;
D.NaCl溶液能导电,是在水分子的作用下电离出自由移动的水合钠离子和水合氯离子,故D
正确;
故选D。
7.答案:C
解析:根据实验①可知生成的气体为CO?,原溶液中至少含CO:或HCO]中的一种;根据实验
②可知该白色沉淀为BaSC\,即溶液中含有SOj;实验③中生成的白色沉淀为AgCL由于实
验①引入了CT,无法确定原溶液中是否含CT。结合上述分析可确定原溶液中一定含SO:。
8.答案:A
解析:A.反应1是在电解Nai溶液生成1。3,碘的化合价升高被氧化,失去电子,故“反应1”
中的离子方程式为:[-6-+603-10'+3通0,A错误;
B.由分析可知,反应1是在电解Nai溶液生成10],再加入NaOH溶液和氯气,反应生成不溶
+
于水的Na2H31。6,故“反应2”中:2Na+IO;+Cl2+30H=Na2H3IO6+2CF,B正确;
C.由分析可知,反应3为Na2H31。6中加入硝酸银溶液生成不溶于水的黑色Ag5K)6,则“反应
+++
3”中:Na2H3IO6+5Ag—Ag5IO6+2Na+3H,C正确;
D.由分析可知,反应3后的溶液中加入氯气和水生成的次氯酸分解生成气体氧气,过滤得到
高碘酸,“反应4”中:4Ag5IO6+1OC12+10H2O—4H5IO6+20AgCl+5O2,D正确;
故答案为:Ao
9.答案:B
解析:A.等物质的量的MgJ、Ba(OH)2和HC1溶液混合:
2++
Mg+4OH+2H—Mg(OH)2J+2H2O,故A错误;
B.利用覆铜板制作印刷电路板就是铜单质和氯化铁溶液的反应,反应的离子方程式为:
2Fe3++Cu-2Fe2++Cu2+,故B正确;
C.铅酸蓄电池放电时的负极反应铅失电子:Pb+S0t-2e-PbSO4,故C错误;
3+
D.明矶溶液与过量氨水混合生成氢氧化铝和镂盐:A1+3NH3.H2O—A1(OH)3+3NH:,
故D错误;
故选Bo
10.答案:D
解析:A.烟气与Na2sO3溶液反应生成亚硫酸氢根,正确的离子方程式为
SO2+SO^+H2O—2HSO;,A错误;
B.由碳酸和亚硫酸的电离常数可知,烟气与海水中的碳酸氢根反应生成亚硫酸氢根,离子方
程式为SO2+HCO]—HSO3+CO2,B错误;
C.烟气与石灰乳反应得到石膏(CaSO「2H2。),SO?被氧化,因此反应物中有。2,且石灰乳
形式的Ca(OH)2不拆为离子形式,故离子方程式为
2CaCO3+2SO2+O2+4H2O^2(CaSO4-H2O)+2CO2,C错误;
D.烟气与氨水反应并被氧化后得到硫酸镂,选项所给离子方程式正确,D正确;
本题选D;
1L答案:B
解析:A项,NH£I溶液中N(水解使溶液呈酸性,应用可逆符号,即
+
NH:+H2OT——^NH3-H2O+H+或NH:+2H2O7——^NH3-H2O+H3O,错误;
B项,Al能与NaOH溶液反应,而镁不与
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 商业公司绩效管理制度
- 路面机械改装方案(3篇)
- 加固材料招商方案(3篇)
- 水费支付优惠方案(3篇)
- 公司活动场地设置方案(3篇)
- 自己装修家居方案(3篇)
- 商贸领域犯罪方案(3篇)
- 公司外包合同协议书
- 元旦团建活动方案(3篇)
- 婚庆轿车运营方案(3篇)
- 国家开放大学《园林规划设计》形考任务1-4参考答案
- 2025届河南省许昌市名校高三下学期第二次模拟考试英语试题(原卷版+解析版)
- 融资租赁 测试题及答案
- 2025中国储备粮管理集团有限公司贵州分公司招聘22人笔试参考题库附带答案详解
- 蛛网膜下腔出血介入术后护理
- 千川合同协议
- 制造业智能排产系统(课件)
- 婚前拆迁婚内协议书
- 常州文化测试试题及答案
- 会考地理综合题答题模板+简答题归纳-2025年会考地理知识点梳理
- 预防VTE质控汇报演讲

评论
0/150
提交评论