



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
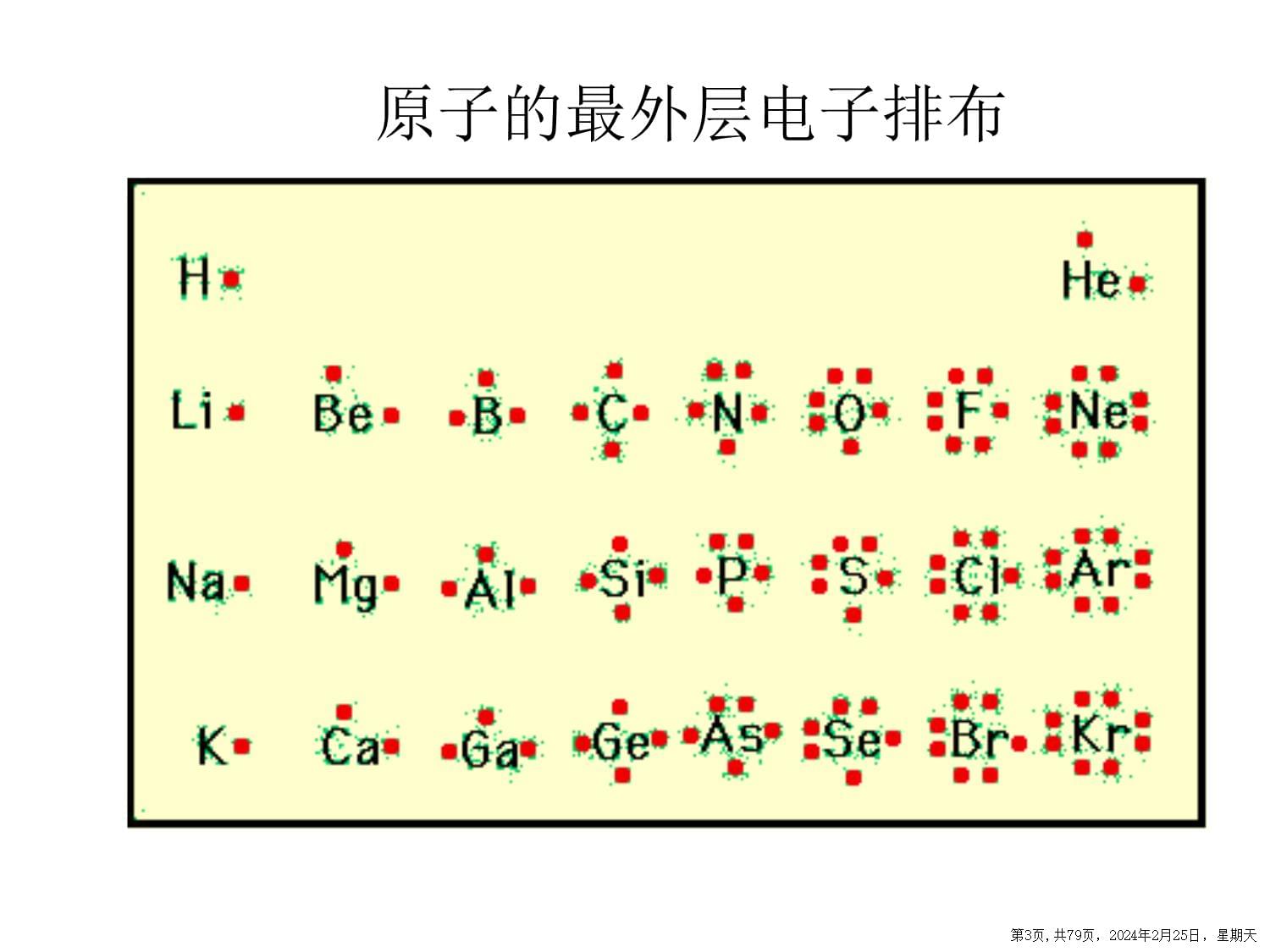
关于元素性质的递变规律核外电子排布第2页,共79页,2024年2月25日,星期天原子的最外层电子排布第3页,共79页,2024年2月25日,星期天123121818882结论:同周期,电子层数相同,最外层电子数递增;同主族,电子层数递增,最外层电子数相同。第4页,共79页,2024年2月25日,星期天元素化合价第5页,共79页,2024年2月25日,星期天第6页,共79页,2024年2月25日,星期天+10+1+5-4-10结论:同一周期,元素的主要化合价从左到右正价递增;同一主族,元素的主要化合价相同。第7页,共79页,2024年2月25日,星期天判断依据金属性非金属性金属单质与水或酸反应置换出H2的难易金属氧化物对应的水化物碱性强弱非金属单质与H2化合的难易及气态氢化物的稳定性最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱元素的金属性和非金属性第8页,共79页,2024年2月25日,星期天金属性强弱非金属性强弱①与水反应置换氢的难易②最高价氧化物的水化物碱性强弱③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)④互相置换反应⑤原电池反应中正负极①与H2化合的难易及氢化物的稳定性②最高价氧化物的水化物酸性强弱③单质的氧化性或离子的还原性④互相置换反应判断依据元素的金属性与非金属性第9页,共79页,2024年2月25日,星期天跟冷水剧烈反应NaOH强碱跟沸水反应放H2;跟酸剧烈反应放H2Mg(OH)2中强碱跟酸较为迅速反应放H2Al(OH)3两性氢氧化物结论:金属性Na>Mg>Al第10页,共79页,2024年2月25日,星期天SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸逐渐增强高温加热加热点燃或光照SiH4PH3H2SHCl逐渐增强逐渐增强非金属性逐渐增强第11页,共79页,2024年2月25日,星期天11~18号元素性质的变化中得出如下的结论:NaMgAlSiPSClAr同周期,由左至右,金属性逐渐减弱,非金属性逐渐增强同主族,由上至下,金属性逐渐增强,非金属性逐渐减弱第12页,共79页,2024年2月25日,星期天原子半径第13页,共79页,2024年2月25日,星期天第14页,共79页,2024年2月25日,星期天第15页,共79页,2024年2月25日,星期天逐渐减小逐渐减小结论:在同一周期中,从左到右,原子半径逐渐减小;在同一主族中,从上到下,原子半径逐渐增大。第16页,共79页,2024年2月25日,星期天元素的性质随着元素原子序数的递增而呈周期性的变化。这个规律叫做元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。元素周期表是对元素周期律的表述。第17页,共79页,2024年2月25日,星期天HHeLiBeBCNOFNaMgAlSiPSClNeArKRbCsFrKrXeRnCaGaGeAsSeBrSrInSnSbTeIBaTlPbBiPoAtRa第18页,共79页,2024年2月25日,星期天HHeLiBeBCNOFNaMgAlSiPSClNeAr1S11S21S22S11S22S21S22S22p11S22S22p21S22S22p21S22S22p31S22S22p41S22S22p41S22S22p51S22S22p63S13S23S23p13S23p23S23p33S23p43S23p53S23p6问题:1、每一周期元素原子的外围电子排布呈现什么样的变化规律?问题:2、稀有气体元素、非金属元素原子外围电子排布有什么特点?问题:3、过渡金属的外围电子排布有什么特点?有什么不同处?第19页,共79页,2024年2月25日,星期天第四周期过渡元素核外电子排布第20页,共79页,2024年2月25日,星期天第21页,共79页,2024年2月25日,星期天第22页,共79页,2024年2月25日,星期天二、原子核外电子排布的周期性变化1、同周期元素原子的外围电子排布从
到
。2、根据元素原子的外围电子排布的特征,将周期表分区:s区p区f区d区ds区ⅠA、ⅡA族ⅢA~ⅦA、0族ⅢB~ⅦB、Ⅷ族ⅠB、ⅡB族镧系、锕系元素ns1~2ns2np1~6(n-1)d1~9ns1~2
(n-1)d10ns1~2
(n-2)f0~14(n-1)d0~2ns2
根据最后一个电子填充在何种原子轨道进行分区。ns1ns2np6分区所含元素外围电子排布第23页,共79页,2024年2月25日,星期天元素第一电离能的周期性变化第24页,共79页,2024年2月25日,星期天
请同学们回忆一下:什么是元素的金属性和非金属性?同周期元素的金属性和非金属性如何变化?知识回顾第25页,共79页,2024年2月25日,星期天请同学们回忆一下:我们学过的元素主要性质有哪些?他们各有怎样的递变规律?1.金属性2.非金属性3.元素的主要化合价4.原子半径同一周期从左到右逐渐减弱同一主族从上到下逐渐增强知识复习
同一周期从左到右逐渐增强同一主族从上到下逐渐减弱同周期最高正价从+1价到+7价负价从-4到价同一周期从左到右逐渐减小同一主族从上到下逐渐增大第26页,共79页,2024年2月25日,星期天一、元素第一电离能
原子失去一个电子形成+1
阳离子所需的
能量叫做元素的第一电离能。符号为
.单位是
.I1KJ/mol气态气态最低第27页,共79页,2024年2月25日,星期天1、已知M(g)-e-→M+(g)时所需的最低能量为738KJ。则M元素的I1=
738KJ·mol-1496KJ2、已知钠元素的I1=496KJ/mol。则Na(g)-e-→Na+(g)时所需的最小能量为概念应用第28页,共79页,2024年2月25日,星期天
第一电离能越小,原子越
失去电子,金属性越
;第一电离能越大,原子越
失去电子,金属性越
。
元素第一电离能大小与原子失电子能力有何关系?容易难强弱探究学习第29页,共79页,2024年2月25日,星期天第30页,共79页,2024年2月25日,星期天
元素的第一电离能有什么变化规律呢?
同周期从左到右,第一电离能有逐渐
的趋势;同主族从上到下,第一电离能逐渐
。增大减小探究学习为什么第31页,共79页,2024年2月25日,星期天1.总体上金属元素第一电离能较小
非金属元素第一电离能较大。友情提示:比较金属元素、非金属元素及稀有气体元素最外层电子数多少入手参考答案:金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。稀有气体最外层电子排布ns2np6,达稳定结构,难失电子,第一电离能大。为什么?第32页,共79页,2024年2月25日,星期天2、同周期元素第一电离能从左到右有增大的趋势,为什么?提示:从原子结构的变化来解释参考答案:同周期元素从左到右,随核电荷数增大,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增大,原子失电子能力逐渐减小,第一电离能有逐渐增大的趋势。第33页,共79页,2024年2月25日,星期天3、同主族元素第一电离能从上到下逐渐减小,为什么?提示:从原子结构的变化来解释参考答案:同主族元素从上到下,随核电荷数增大,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,原子失电子能力逐渐增大,第一电离能逐渐减小。第34页,共79页,2024年2月25日,星期天4、同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。为什么?参考答案:碱金属元素核外电子排布为
ns1,同周期中(除稀有气体外)原子半径最大,易失去一个电子,形成稳定结构,因此第一电离能在同周期中最小。稀有气体最外层电子排布为ns2np6,已达稳定结构,难以失电子,因此第一电离能在同周期中最大。提示:从他们的原子外围电子排布式和原子结构的特点思考。第35页,共79页,2024年2月25日,星期天总体上:金属元素的第一电离能都
,非金属元素和稀有气体元素的第一电离能都
。在同一周期中第一电离能最小的是
元素,最大的是
元素。碱金属稀有气体较大较小规律与总结第36页,共79页,2024年2月25日,星期天1、下列叙述中正确的是()A、同周期元素中,VIIA族元素的原子半径最大B、VIA族元素的原子,其半径越大,越容易得到电子C、室温时,零族元素的单质都是气体D、同一周期中,碱金属元素的第一电离能最大C课堂练习第37页,共79页,2024年2月25日,星期天2、判断下列元素间的第一电离能的大小:Na
KN
PF
NeCl
SMg
AlO
N
>><>><为什么?当原子核外电子排布在能量相等的轨道上形成全空、半满、全满结构时,原子能量较低,该元素具有较大的第一电离能。P19课堂练习第38页,共79页,2024年2月25日,星期天⒊将下列元素按第一电离能由大到小的顺序排列:①KNaLi②BCBeN
③HeNeAr④NaAlSPLi>Na>KN>C>Be>BHe>Ne>ArP>S>Al>Na课堂练习第39页,共79页,2024年2月25日,星期天影响第一电离能的因素1、原子核对核外电子的引力2、原子达到稳定结构的趋势第40页,共79页,2024年2月25日,星期天根据第一电离能的定义,你能说出什么是第二电离能、第三电离能......吗?讨论后回答课堂练习第41页,共79页,2024年2月25日,星期天
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能(用I1表示),从一价气态基态正离子中再失去一个电子所需消耗的最低能量叫做第二电离能(用I2表示),依次类推,可得到I3、I4、I5……同一种元素的逐级电离能的大小关系I1<I2<I3<I4<I5……why第42页,共79页,2024年2月25日,星期天探究学习观察分析下表电离能数据回答问题:
为什么锂元素易形成Li+,而不易形成Li2+;镁元素易形成Mg2+,而不易形成Mg3+?从表中数据可知:Na元素的I2远大于I1,因此Na容易失去第一个电子,而不易失去第二个电子;即Na易形成Na+,而不易形成Na2+。镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。第43页,共79页,2024年2月25日,星期天每一周期元素都是从碱金属开始,以稀有气体结束f区都是副族元素,s区和p区的都是主族元素铝的第一电离能大于钾的第一电离能已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol错错对错概念辨析第44页,共79页,2024年2月25日,星期天影响第一电离能的因素:1、原子半径2、核电荷数3、核外电子排布(全空、半满、全满)ⅡA、ⅤA族和0族归纳总结第45页,共79页,2024年2月25日,星期天总结元素金属性同周期左→右减小同主族上→下增强元素第一电离能同周期左→右增大趋势(两处反常)同主族上→下减小原子结构原子核吸引电子的能力原子形成稳定结构的趋势第46页,共79页,2024年2月25日,星期天你知道吗?钠原子与氯原子结合生成的是
化合物。氢原子与氯原子结合生成的是
化合物。离子共价为什么?第47页,共79页,2024年2月25日,星期天如何证明?AlCl3是离子化合物还是共价化合物?测其熔融态能否导电。实验证明其熔融态不能导电。说明它是共价化合物。为什么?科学探究用什么实验加以证明?第48页,共79页,2024年2月25日,星期天成键原子间形成离子键还是形成共价键,主要取决于成键原子吸引电子能力的差异。第49页,共79页,2024年2月25日,星期天元素电负性的周期性变化第50页,共79页,2024年2月25日,星期天元素电负性的周期性变化第51页,共79页,2024年2月25日,星期天美国化学家
于1932年首先提出了用电负性来衡量元素吸引电子能力。电负性是用来衡量元素在化合物中
的能力的物理量。指定氟的电负性为
,并以此为标准确定其他元素的电负性。一、元素的电负性的概念吸引电子4.0相对值而非绝对值鲍林第52页,共79页,2024年2月25日,星期天1、根据吸引电子的能力判断下列元素的电负性的大小:Na
KN
P
Mg
AlCl
S课堂练习>>><第53页,共79页,2024年2月25日,星期天2.02.2观察与思考
观察教材第21图2-14元素的电负性回答下列问题:
1、同一周期中,元素的电负性如何变化?
2、同一主族中,元素的电负性如何变化?
3、电负性最大的元素和电负性最小的元素分别在元素周期表的什么位置?第54页,共79页,2024年2月25日,星期天电负性逐渐
。增大电负性有的趋势减小电负性最大电负性最小第55页,共79页,2024年2月25日,星期天
同一周期从左到右,主族元素电负性逐渐
,表明其吸引电子的能力逐渐
。同一主族从上到下,元素电负性呈现
趋势,表明其吸引电子的能力逐渐
。试根据原子结构的变化分析。二、电负性的递变规律:增大减小增大减小为什么?————呈周期性变化
第56页,共79页,2024年2月25日,星期天
同一周期从左到右,主族元素电负性逐渐
,表明其吸引电子的能力逐渐
。同一主族从上到下,元素电负性呈现
趋势,表明其吸引电子的能力逐渐
。二、电负性的递变规律:增大减小增大减小为什么第57页,共79页,2024年2月25日,星期天
因为同一周期从左到右随着核电荷数的增加,元素原子半径减少,核对外层电子引力逐渐增大,得电子能力逐渐增强,所以元素的电负性逐渐增强。同一主族从上到下,随着核电荷数的增加,电子层数增加,原子半径增大,核对外层电子的引力减小,得电子能力减弱,所以元素电负性有减小的趋势。第58页,共79页,2024年2月25日,星期天2、下列各组元素按电负性由大到小顺序排列的是
()A.FNOB.OClFC.NaMgAlD.ClSAs课堂练习D第59页,共79页,2024年2月25日,星期天三、电负性的意义
反映了原子间的成键能力和成键类型。
一般认为,电负性
1.8的元素为非金属元素,电负性
1.8的元素为金属元素。小于大于第60页,共79页,2024年2月25日,星期天三、电负性的应用1、根据电负性数值的大小来衡量元素的金属性和非金属性。
一般认为,电负性
1.8的元素为非金属元素,电负性
1.8的元素为金属元素。小于大于?第61页,共79页,2024年2月25日,星期天不看表判断下列元素的电负性的大小:
Li
SBe
I交流与讨论<<结论:一般金属元素电负性较小,非金属元素电负性较大?第62页,共79页,2024年2月25日,星期天
一般电负性小的元素在化合物中吸引电子的能力
,元素的化合价为
值;电负性大的元素在化合物中吸引电子的能力
,元素的化合价为
值。弱正强负2、衡量元素在化合物中吸引电子能力的大小。三、电负性的应用第63页,共79页,2024年2月25日,星期天标出下列化合物中元素的化合价。(1)MgO(2)BeCl2(3)CO2
(4)Mg3N2
(5)
IBr(6)SOCl2交流与讨论分析化合价的正负与电负性的关系:+2-1+2-2+4-2+2-3+1-1电负性大的元素显负价,电负性小的元素显正价。为什么?+4-2-1第64页,共79页,2024年2月25日,星期天
一般电负性小的元素在化合物中吸引电子的能力
,元素的化合价为
值;电负性大的元素在化合物中吸引电子的能力
,元素的化合价为
值。弱正强负2、衡量元素在化合物中吸引电子能力的大小。三、电负性的应用第65页,共79页,2024年2月25日,星期天规律应用P22问题解决3
请查阅下列化合物中元素的电负性值,指出化合物中为正值的元素
CH4NaHNF3NH3
SO2H2SIClHBr当两个成键元素间的电负性差值为零时呢?物质类型?第66页,共79页,2024年2月25日,星期天
一般认为,如果两个成键元素间的电负性差值大于1.7,他们之间通常形成
键;如果两个成键元素间的电负性差值小于1.7,他们之间通常形成
键。离子共价为什么规律与总结第67页,共79页,2024年2月25日,星期天
一般认为,如果两个成键元素间的电负性差值大于1.7,他们之间通常形成
键;如果两个成键元素间的电负性差值小于1.7,他们之间通常形成
键。离子共价3、反映了原子间的成键能力和成键类型。三、电负性的应用第68页,共79页,2024年2月25日,星期天
请查阅下列化合物中元素的电负性值,判断他们哪些是离子化合物,哪些是共价化合物NaFHClNOMgOKClCH4离子化合物:
。共价化合物:
。NaF、MgO、KClHCl、NO、CH4概念应用第69页,共79页,2024年2月25日,星期天判断HF是离子化合物还是共价化合物?查表计算再判断?到底哪一种正确?怎么办?以实验为准。用什么实验检验?测其液态能否导电。交流与讨论第70页,共79页,2024年2月25日,星期天四、元素的电负性与元素其它性质的关系:一般,同周期元素的原子半径越大,电负性越大,第一电离能越大,其非金属性越强,金属性越弱;元素的原子半径越大,元素的电负性越小,第一电离能越小,其非金属性越弱,金属性越强。即:元素的性质呈周期性变化。第71页,共79页,2024年2月25日,星期天随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律原子半径:化合价:(稀有气体元素为零)决定了归纳出最外层电子数1→8(K层电子数1→2)引起了非金属性:第一电离能:电负性:金属性:元素性质呈周期性变化的根本原因大→小(除稀有气体)+1→+7-4→-1弱→强强→弱小→大(有特例)小→大(除稀有气体)第72页,共79页,2024年2月25日,星期天元素周期律对人们认识
与
的关系具有指导意义,也为人们寻找新材料提供了科学途径。如在ⅠA族可以找到
材料,在ⅢA、ⅣA、ⅤA族可以找到优良
的材料。四、元素周期表的意义原子结构元素性质光电半导体第73页,共79页,2024年2月25日,星期天1、下列各组元素按电负性由大到小顺序排列的是()A.FNOB.OClFC.AsPHD.ClSAsD2、下列哪个系列的排列顺序正好是电负性减小的顺序()A.KNaLiB.OClHC.AsPHD.三者都是B巩固练习第74页,共79页,2024年2月25日,星期天4、下列不是元素电负性的应用的是()A.判
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 抗击新冠肺炎疫情文明礼仪范文
- 护理口腔个人简介
- 北师大版七年级数学课堂互动计划
- 园林苗木养护维护措施
- 四年级劳动课堂安全计划
- 湖北省襄阳市老河口市第四中学2024年物理九年级第一学期期末达标测试试题含解析
- 烟师大地球科学基础教案05大气圈概述
- 胆管癌护理个案分析
- 2025年春季二年级班主任家长沟通计划
- 食物药物中毒的护理
- 2025辅警考试题《公安基础知识》综合能力试题库
- 肺恶性肿瘤的护理查房
- 因式分解(二)换元法与十字相乘法
- 气动系统主要元件常见故障及排除方法
- 桥梁更换伸缩缝劳务分包合同
- 八年级上册语文课内文言文复习资料
- 2023青海师范大学孵化西宁大学招聘专任教师20人笔试备考试题及答案解析
- 广西2023年中信银行南宁分行春季校园招聘考试参考题库含答案详解
- 煤电公司准军事化管理宣传手册
- 中国哲学经典著作导读知到章节答案智慧树2023年西安交通大学
- 质量成本范围明细表

评论
0/150
提交评论