



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
2021—化学选择性必修1《化学反应原理》第三章
水溶液中的离子反应与平衡§3-2
水的电离和溶液的pH一、水的电离平衡二、外界条件对水的电离平衡的影响三、Kw的应用
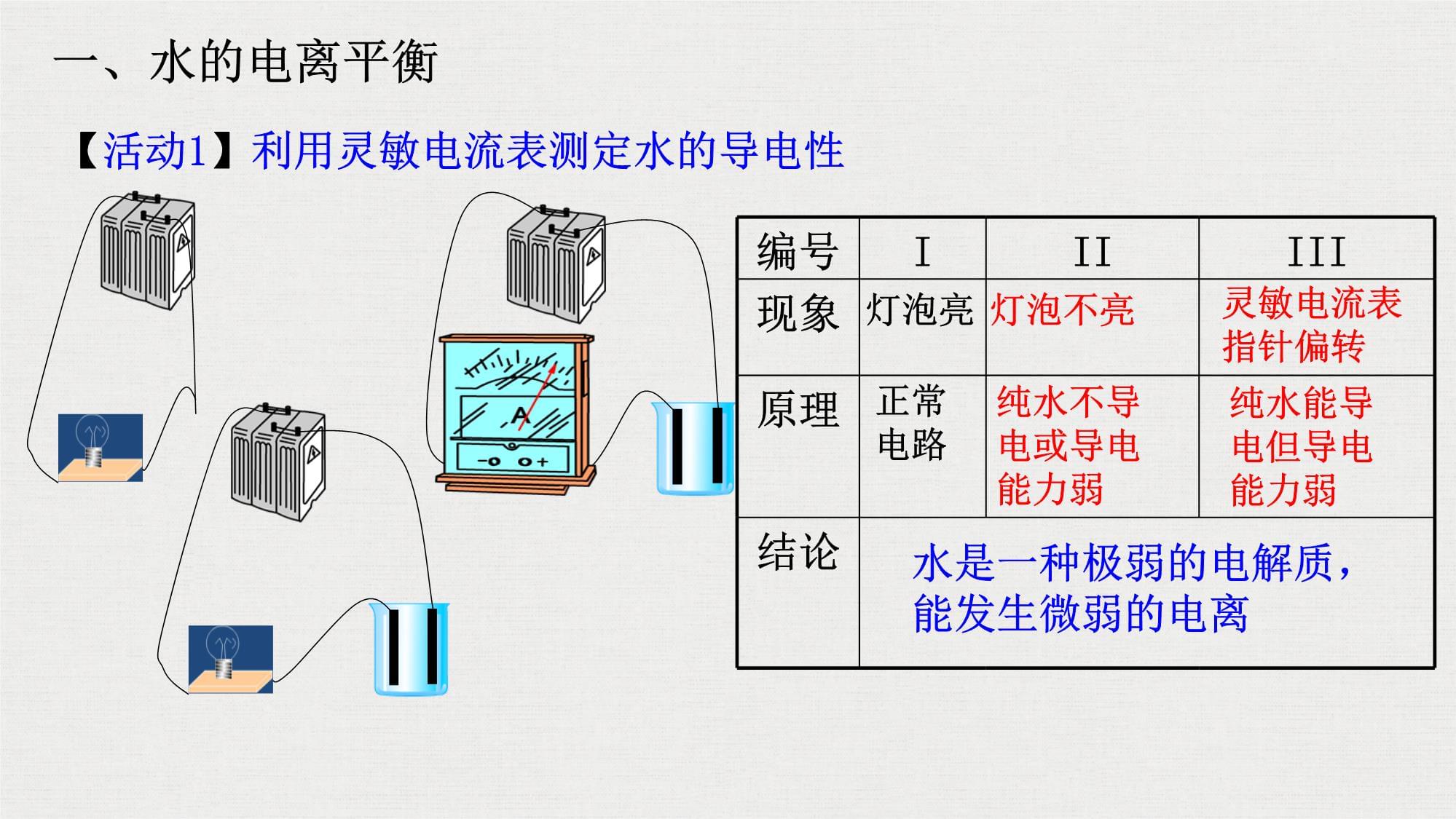
水的电离学习目标一、水的电离平衡【活动1】利用灵敏电流表测定水的导电性
编号IIIIII现象原理结论灯泡不亮纯水不导电或导电能力弱灵敏电流表指针偏转纯水能导电但导电能力弱水是一种极弱的电解质,能发生微弱的电离灯泡亮正常电路一、水的电离平衡1.水的电离方程式:
水是一种极弱的电解质,能发生微弱的电离。H2O+H2O
OH-+H3O+(自偶电离)H2OH++OH-
(简写)H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子一、水的电离平衡2.水电离的特点
水是一种极弱的电解质,能发生微弱的电离。
(1)微弱:≈2×10-9
10-755.6(2)△H>0(3)c(H+)水=c(OH-)水25℃时1L水约等于55.6mol(),约有10-7molH2O分子发生电离。1000g18g/mol3.水的离子积K电离·c(H2O)=c(H+)·c(OH-)KwKW=c(H+)·c(OH-)已知25℃时,1L纯水电离出的n(H+)=n(OH-)=1×10-7mol=1×10-14(25℃时)电离程度ɑ≈(1)表达式:Kw=
。(2)影响因素:温度一定,Kw是个常数,
Kw只与
有关,
越高,Kw越
。
25℃时,Kw=
,100℃时,Kw=1×10-12。(3)适用范围:Kw不仅适用于纯水,也适用于
、
、
的稀溶液。c(H+)·c(OH-)温度温度大1×10-14酸碱盐一、水的电离平衡3.水的离子积常数(KW)水是一种极弱的电解质,能发生微弱的电离。t/℃0102025405090100Kw/10-140.1150.2960.6871.012.875.3137.154.51.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25℃)高还是低?该温度下纯水中c(H+)是多少?深度思考提示
因此时水的离子积大于常温时水的离子积,故温度高于25℃,此时c(H+)=2×10-7mol·L-1。2.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?提示
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如:盐酸中的H+包括HCl和H2O电离产生的H+,
即:
c(H+)=c(H+)aq=c酸(H+)+c水(H+),而OH-全部来自水的电离,
c(OH-)=c(OH-)aq=c水(OH-)。1.下列说法正确的是()A.水的电离方程式:H2O===H++OH-B.升高温度,水的电离程度增大C.在NaOH溶液中没有H+D.在HCl溶液中没有OH-B2.下列关于水的离子积常数的叙述中,正确的是()A.因为水的离子积常数的表达式是Kw=c(H+)·c(OH-),所以Kw随溶液中
c(H+)和c(OH-)的变化而变化B.水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量C.水的离子积常数是温度的函数,随着温度的变化而变化D.水的离子积常数Kw与水的电离平衡常数K电离是两个没有任何关系的物
理量C体系变化条件酸碱性平衡移动方向Kw水的电离程度c(OH-)c(H+)加入HCl(g)_______________________加入NaOH(s)_______________________加入NaHSO4(s)逆不变减小
减小
增大H2OH++OH-逆不变减小
增大
减小温度升温_______________________降温_______________________其他:如加入Na_______________________正增大增大
增大
增大逆减小减小
减小
减小正不变
增大增大
减小二、外界条件对水的电离平衡的影响酸性碱性中性中性碱性酸性逆不变减小
减小
增大><=<=>3.下列措施能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的是()A.向纯水中投少量Na2O2B.将水加热煮沸C.向水中通入CO2D.向水中加入NaClC4.在25℃时,水的电离达到平衡:H2O
H++OH-
ΔH>0,下列叙述正确的是()A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,
Kw不变D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变C
归纳小结:(1)加入酸或碱,抑制水的电离;(2)Kw只受温度影响,升温,Kw和水的电离程度都增大;(3)加入弱酸盐或弱碱盐,促进水的电离(在第三节讲);(4)无论水的电离程度是增大还是减小,纯水都呈中性。溶液中水电离出的c(H+)或c(OH-)的计算(1)在室温下,0.01mol·L-1的盐酸中,c(OH-)是多少?水电离出的c(H+)又是多少?深度思考由于酸溶液中的OH-只来源于水的电离,所以水电离出的:c水(H+)=c水(OH-)=c溶液(OH-)=1.0×10-12mol·L-1。酸中水的电离受到抑制!(2)在室温下,0.01mol·L-1的氢氧化钠溶液中,c(H+)是多少?水电离出的c(OH-)又是多少?碱中水的电离受到抑制!由于碱溶液中的H+只来源于水的电离,所以水电离出的:
c水(OH-)=c水(H+)=c溶液(H+)=1.0×10-12mol·L-1。(3)在室温下,酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)还相等吗?c(H+)·c(OH-)=1.0×10-14还成立吗?提示
即:
c溶液(H+)≠c溶液(OH-)
c水(H+)=c水(OH-)
c(H+)·c(OH-)=1.0×10-14仍然成立。溶液溶液<1.0×10-7室温下,由水电离出的c(H+)=1×10-12
mol·L-1的溶液呈
。酸性或碱性三、Kw的应用1.溶液中水电离出的c(H+)或c(OH-)的计算方法
Kw=c溶液(H+)·c溶液(OH-)(1)酸溶液中:Kw=c酸(H+)·c水(OH-)(忽略水电离出的H+的浓度)。(2)碱溶液中:Kw=c水(H+)·c碱(OH-)(忽略水电离出的OH-的浓度)。(3)外界条件改变,水的电离平衡发生移动;但由水电离出的c(H+)与水电离出的c(OH-)一定相等。即:c水(H+)=c水(OH-)(4)室温下,由水电离出的c(H+)=1×10-12
mol·L-1的溶液可能呈酸性,也可能呈碱性。5.比较室温下浓度均为0.1mol/L的下列溶液中由水电离出的c(H+)大小关系_______①盐酸②醋酸溶液③硫酸溶液④氢氧化钠溶液②>①=④>③6.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1.0×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1.0×10-2mol·L-1。下列对该溶液的叙述不正确的是(
)A.该温度高于25℃B.由水电离出来的的浓度为c(H+)=1.0×10-10mol·L-1C.加入NaHSO4晶体抑制水的电离D.取该溶液加水稀释至100倍,溶液中的c(OH-)减小D三、Kw的应用2.水的电离平衡曲线的理解与识别(1)曲线上的任意点(如a,b,c)的Kw都
,即c(H+)·c(OH-)
,温度
。(2)曲线外的任意点(如d)与曲线上任意点的Kw
,温度
。(3)实现曲线上点之间的转化需保持温度不变,改变
;实现曲线上点与曲线外点之间的转化一定改变
。相同相同相同不同不同酸碱性温度1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是()A.该温度下,a点溶液呈碱性B.该温度下,0.01mol·L-1NaOH溶液中c(H+)
=1.0×10-12mol·L-1C.该温度下,加入NaOH可能引起由d向b的变化D.b点时,升高温度,可能引起由b向c的变化应用体验
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 离婚协议书二十四字范本
- 门店入股协议书范本合同
- 自体免疫细胞储存协议书
- 甲方合同终止协议书范本
- 甲方违约部分赔偿协议书
- 电商合同转让协议书范本
- 机械合作伙伴合同协议书
- 煤场地合作协议合同范本
- 股东投资协议谁出具合同
- 销售生态护坡砖合同范本
- 八年级物理浮力压强专题经典计算题(含答案解析)
- GB/T 3211-2008金属铬
- GB/T 12703.7-2010纺织品静电性能的评定第7部分:动态静电压
- ps6000自动化系统用户操作及问题处理培训
- 2023年韶关市法院书记员招聘笔试模拟试题及答案解析
- 革兰氏阴性菌课件
- 聘用证书合集通用PPT模板
- 建筑工程文件归档管理明细表
- 海姆立克手法理论知识、临床应用及注意事项考核试题与答案
- 碱性脱漆剂配方
- DB32∕T 186-2015 建筑消防设施检测技术规程

评论
0/150
提交评论