



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
第一节化学能与热能第一页,共二十八页。Page
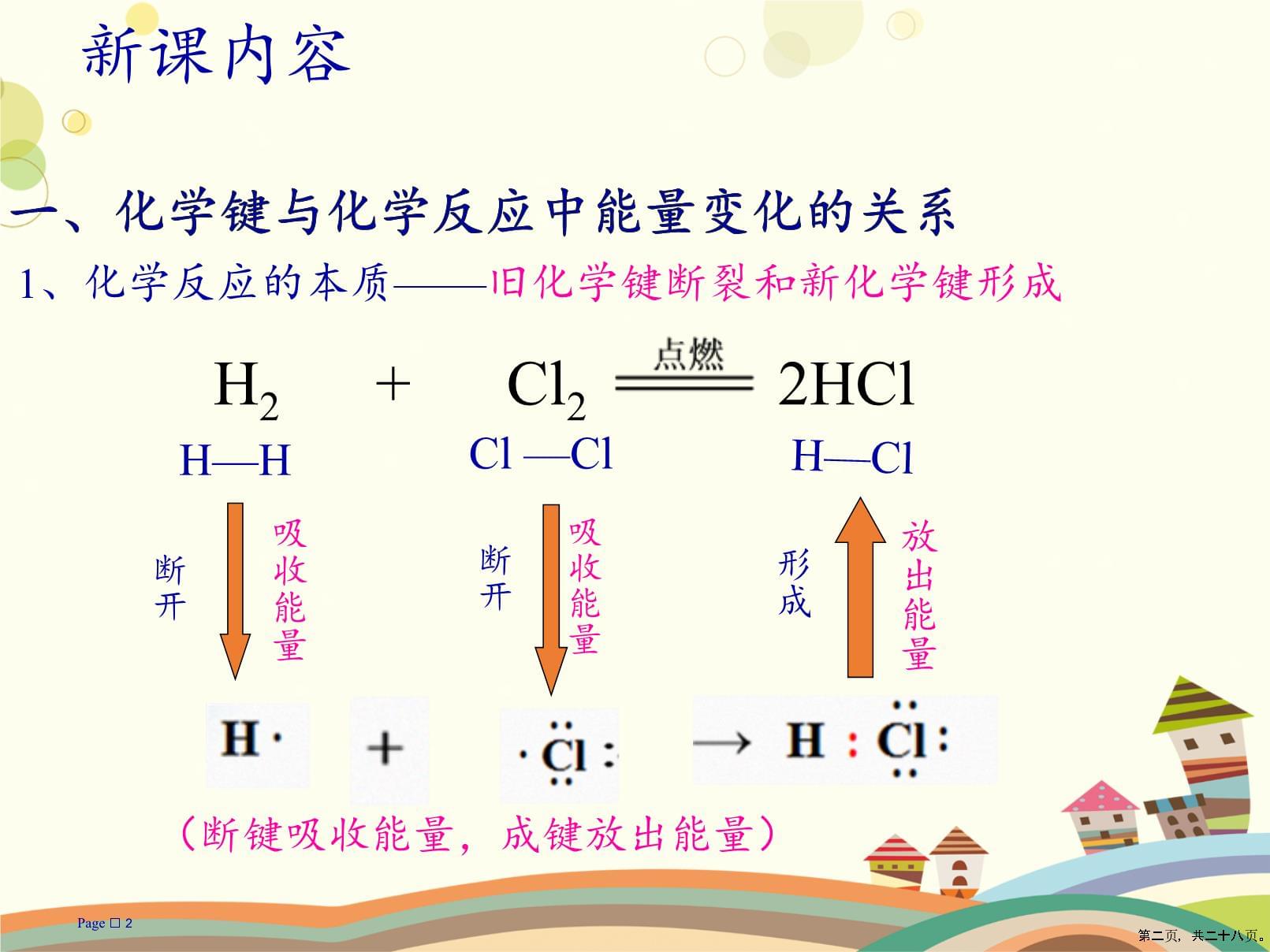
2一、化学键与化学反应中能量变化的关系新课内容1、化学反应的本质——旧化学键断裂和新化学键形成H—HCl—ClH—Cl断开断开形成H2+Cl22HCl吸收能量吸收能量放出能量(断键吸收能量,成键放出能量)第二页,共二十八页。Page
3一、化学键与化学反应中能量变化的关系新课内容2、化学反应中能量变化的主要原因(微观角度)
化学键的断裂和形成是化学反应中能量变化的主要原因。化学键变化能量变化断裂1molH-H键吸收能量436KJ形成1molH-H键放出能量436KJ断裂1molC-H键吸收能量415KJ形成1molC-H键放出能量415KJ第三页,共二十八页。Page
4思考·交流例:在25℃和101kPa的条件下,断裂1molH-H需要吸收436kJ能量,断裂1molCl-Cl键需要吸收243kJ能量,形成1molH-Cl会放出431kJ能量,通过计算说明化学反应H2+Cl2
=2HCl是吸收能量还是放出能量。解:设有1molH2与1molCl2完全反应,则断开反应物中化学键所吸收能量之和:
436kJ+243kJ=679kJ形成生成物中化学键所放出能量之和:
2×431kJ=862kJ吸收能量小于放出能量,因此,该反应是放出能量。第四页,共二十八页。Page
5思考·交流能量H2+Cl22H
+2Cl2HCl吸收能量679kJ放出能量862kJ放出能量183kJ反应坐标以H2+Cl2=2HCl反应为例:第五页,共二十八页。Page
6一、化学键与化学反应中能量变化的关系新课内容3、从化学键的角度判断化学反应中能量的变化化学反应中是吸收能量还是放出能量,取决于断键吸收的总能量与成键放出的总能量的相对大小。反应放出能量=成键放出总能量-断键吸收总能量反应吸收能量=断键吸收总能量-成键放出总能量化学反应都伴随着能量的变化!第六页,共二十八页。Page
7二、化学能与化学反应中能量变化的关系新课内容化学能,即化学物质具有的能量,各种物质都储存有化学能,不同的物质化学能不同。物质具有能量越高,越不稳定;物质的能量越低,越稳定;能量高的物质易转化为能量低的物质。1、化学能第七页,共二十八页。Page
8体系能量变化探究水由高处向低处流要释放能量(势能转换为动能)反应物的总能量>生成物的总能量化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)反应物的总能量<生成物的总能量化学反应吸收能量第八页,共二十八页。Page
9二、化学能与化学反应中能量变化的关系新课内容化学能,即化学物质具有的能量,各种物质都储存有化学能,不同的物质化学能不同。物质具有能量越高,越不稳定;物质的能量越低,越稳定;能量高的物质易转化为能量低的物质。1、化学能2、化学反应中能量变化的决定因素(宏观角度)
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。第九页,共二十八页。Page
10新课内容化学反应的过程,可以看成是能量的“贮存”或“释放”的过程。反应物生成物能量(E)反应物的总能量(E1)生成物的总能量(E2)△E放出能量反应过程△E吸收能量反应物生成物能量(E)反应物的总能量(E1)生成物的总能量(E2)反应过程E(反应物)>E(生成物)化学反应
能量E(反应物)<E(生成物)化学反应
能量放出吸收第十页,共二十八页。Page
11课堂小结化学反应中能量变化的原因:取决于反应物的总能量与生成物的总能量的相对大小。从化学键角度从反应体系能量角度取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小。Q(断键)
>Q(成键)吸收能量Q(断键)
<Q(成键)放出能量E(反应物)>E(生成物)放出能量E(反应物)<E(生成物)吸收能量注:一般用Q表示吸收或放出的能量,用E表示化学能。第十一页,共二十八页。Page
12练习1:氢气在氧气中燃烧放出热量,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO=O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。下列关系式中正确的是()
A.2Q1+Q2>4Q3
B.2Q1+Q2<4Q3C.Q1+Q2<Q3D.Q1+Q2=Q3B练习·拓展第十二页,共二十八页。Page
13练习2:已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是()A.A的能量一定高于CB.B的能量一定高于DC.A和B的总能量一定高于C和D的总能量D.A和B的总能量一定低于C和D的总能量C练习·拓展第十三页,共二十八页。思考与交流吸收能量放出能量能量反应物能量生成物能量反应物能量生成物思考:化学反应中放出的能量会消失吗?吸收的能量又将如何变化?第十四页,共二十八页。新课内容二、化学能与热能的相互转化能量的形式有多种,如化学能、热能、电能和光能等,能量之间可通过化学反应进行相互转化,化学反应中的能量变化主要表现为热量的变化。能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为另一种形式,在转化过程中体系包含的总能量不变。1、能量守恒定律第十五页,共二十八页。新课内容二、化学能与热能的相互转化2、放热反应和吸热反应(1)定义放热反应:释放热量的化学反应;吸热反应:吸收热量的化学反应。思考:KNO3、NH4NO3溶于水时会吸收热量,这些变化是否属于吸热反应?稀释浓硫酸、溶解NaOH固体时都会放出大量的热,这些变化过程是否属于放热反应?吸热和放热过程不一定会发生化学反应!!!第十六页,共二十八页。新课内容二、化学能与热能的相互转化2、放热反应和吸热反应实验2-1
铝片与盐酸反应现象结论产生气泡,用手轻触试管底部感到发热,用温度计测量,水银柱上升。该是放热反应。常见的放热反应活泼金属和酸、水反应酸碱中和反应可燃物的燃烧反应及缓慢氧化反应大部分的化合反应第十七页,共二十八页。新课内容实验2-2氢氧化钡晶体与氯化铵反应现象结论该反应是吸热反应1、玻璃片结冰与小烧杯粘结在一起2、产生刺激性气味的气体3、混合物成糊状Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O二、化学能与热能的相互转化2、放热反应和吸热反应常见的吸热反应Ba(OH)2·8H2O与NH4Cl的反应大多数分解反应以C、CO为还原剂的氧化还原反应。固体反应,通常先研细再混合,反应时用玻璃棒搅拌加快反应第十八页,共二十八页。Page
19课本P374、下列反应中,属于放热反应是,属于吸热反应的是。练习:下列说法正确的是()
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.化学反应中能量变化都表现为热量的过程
D.一个反应是吸热或放热与反应条件没有直接联系,与反应物与生成物的总能量的相对大小有关。D练习·拓展特别提示:一个化学反应是吸热还是放热与反应条件没有直接联系;放热反应可能要加热或点燃,如燃烧反应;吸热反应不一定要加热,如氢氧化钡晶体和氯化铵反应。②③④⑤⑥①①煅烧石灰石②燃烧木炭取暖③炸药爆炸④酸和碱的中和反应⑤生石灰与水作用制熟石灰⑥食物因氧化而腐败第十九页,共二十八页。实验探究实验2-1、2均是从定性的角度判断一个反应是放热还是吸热,能否在此基础上,定量测定一个化学反应所放出热量的大小呢?盐酸的温度NaOH溶液的温度反应后溶液的温度反应原理结论实验2-3稀盐酸和氢氧化钠溶液的中和反应H++OH-=H2O中和反应是一类放热反应。了解:中和热的概念
酸和碱发生中和反应生成1molH2O时所释放的热量。第二十页,共二十八页。实验探究思考与交流:若要测定盐酸和氢氧化钠反应的中和热。在实验2-3的基础上还需注意哪些问题?⑴用隔热装置,尽量减少热量散失;⑴酸碱的浓度和体积取定值:n=c·V⑵准确测量反应前后溶液的温度⑶准确量取溶液的体积、温度计读数要准确⑶做平行实验取平均值⑵搅拌使反应充分进行,使混合液温度均衡一、注意“量”的问题二、尽量减小实验误差第二十一页,共二十八页。新课内容三、化学能与热能相互转化的应用化学能热能煤、石油、天然气的燃烧高温冶炼金属、分解化合物提供了人类生存和发展所需要的能量和动力进行化工生产、研究新物质不可或缺的条件和途径化学反应第二十二页,共二十八页。科学视野1、社会发展与能源利用人类社会的发展与能源利用密不可分,人类正是通过对能源的利用才一步步不断向前发展,在某种程度上可以说,人类社会的发展史就是一部人类如何开发利用能源的历史。能源是现代社会物质文明的原动力,与我们每一个人息息相关。图2-3不同社会发展水平时期的人均耗能量第二十三页,共二十八页。科学视野(1)柴草时期:火的发现到18世纪产业革命以树枝、柴草为主要能源。(2)化石能源时期:18世纪中期至现在以煤、石油和天然气为主要能源,这三种能源均为不可再生能源。2、人类利用能源的三个阶段(3)多能源结构时期化石能源:煤、石油和天然气等新能源:太阳能、氢能、核能、生物质能、风能、地热能、波浪能、洋流能和潮汐能等。第二十四页,共二十八页。科学视野人体内发生的氧化还原反应与体外的燃烧本质相同,都是放热反应。只是二者条件和进行不同,生物氧化是在体温条件和酶的催化下进行的,能量的转化率和利用率都很高。太阳能糖类化学能光合作用植物其他形式的能量维持人的生理活动氧化还原反应人体摄入糖类3、生物体中的能量转化第二十五页,共二十八页。课堂小结能量变化化学能与热能的相互转化放热反应吸热反应Q(断键)<Q(成键)E(反应物)>E(生成物)Q(断键)>Q(成键)E(反应物)<E(生成物)遵循能量守恒原理能量利用类型注:一般用Q表示吸收或放出的能量,用E表示化学能。第二十六页,共二十八页。Page
27练习·拓展练习3:已知断裂1molH-H键,要吸收热量436k
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 土建外墙改造合同范本
- 设备租赁合同合作协议
- 艺术节合同范本
- 钢材供货合同范本
- 综合管线布置合同范本
- 门店代运合同范本
- 销售订货定金合同范本
- 委托加工门窗合同范本
- 劳务派遣护士合同范例
- 叉车设备 租赁 合同范例
- 高等数学35函数最大值和最小值课件
- 新人教版七年级数学下第一二单元检测试题
- 化工热力学答案-冯新-宣爱国-课后总习题答案详解
- 拉斐尔课件完整版
- EIM Book 1 Unit 8 We're going on holiday单元知识要点
- 机加工日语词汇
- 核舟记测模拟试题及答案
- MySQL中文参考手册MySQL学习教程
- 集群企业住所托管服务协议书
- YS/T 1028.3-2015磷酸铁锂化学分析方法第3部分:磷量的测定磷钼酸喹啉称量法
- GB/T 39305-2020再生水水质氟、氯、亚硝酸根、硝酸根、硫酸根的测定离子色谱法

评论
0/150
提交评论