



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
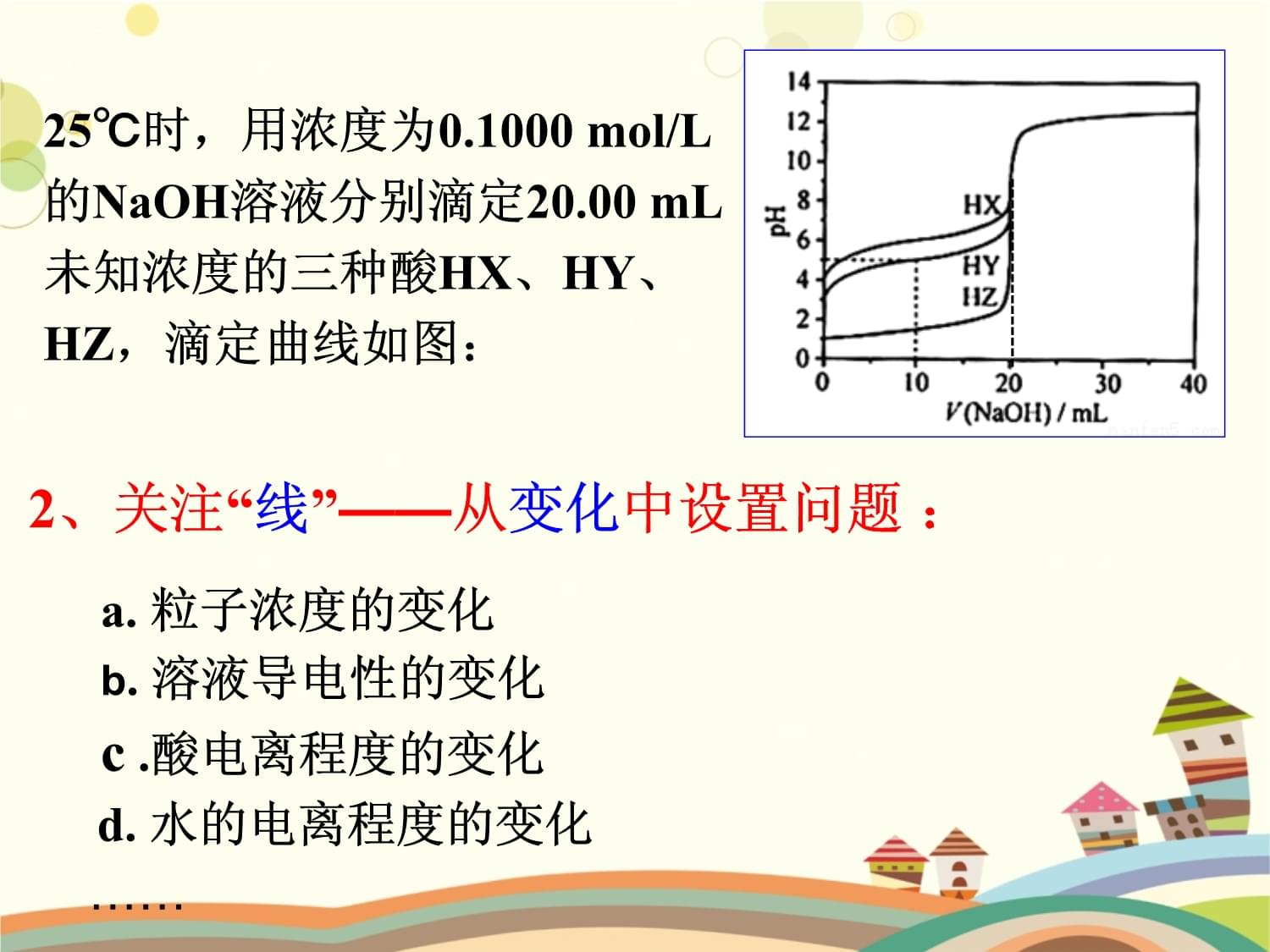
[素材]25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:a.计算三种酸的浓度(终点)b.计算Ka(HX)、Ka(HY)(起点)c判断某些点的酸碱性……1、关注“点”——从静态中设置问题:根据素材,请你命制一个选择项问题设置1
下述说法合理的是
。A.HZ为弱酸,且浓度为0.1000mol/LB.根据滴定曲线,25℃时可得Ka(HX)≈10-8C.0.1000mol/LHY溶液中,HY的电离度约为1%D.NaOH溶液滴定HY可选择甲基橙为指示剂25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:C[刨根问底]——关注特殊的点
25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:.MM点滴定终点(P点)c(Y-)=c(HY)的点(O点)V=10mL时的N点溶液呈中性的点(Q点)试试看(以HY为例):
请给以上5个点按在曲线上出现位置从左到右排序。.P
a.粒子浓度的变化
b.溶液导电性的变化
c.酸电离程度的变化
d.水的电离程度的变化……25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:2、关注“线”——从变化中设置问题
:下述说法合理的是
。A.N点溶液中水的电离程度比纯水大B.滴定终点前,随着NaOH的加入,
一直不断减小C.从M
到
N点间一直存在:c(Y-)>c(Na+)>c(H+)>c(OH-)D.溶液中Na+物质的量浓度:N>
P25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:N..MB问题设置2
.P25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:N..M[刨根问底]——关注变化中的一些不变量
a.过程中n(HY)与n(Y-)之和始终保持不变
b.过程中HY的电离平衡常数、水的离子积不变c.溶液始终为中性,正电荷总量与负电荷总量相等.…….P
a.三种酸酸性强弱的比较
b.滴定终点酸碱性的比较c.滴定突跃变化范围的比较…………3、关注“面”——从对比中设置问题
:25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:问题设置3下述说法合理的是
。A.相同温度下pH相等的HX、HY浓度:HX<HYB.同温同浓度的三种酸溶液的导电能力顺序HZ<HY<HXC.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(
H+)D.VNaOH=15mL时,溶液中三种阴离子浓度大小分别是c(Z-)
>c(Y-)>c(X-)25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:N..MD25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL未知浓度的三种酸HX、HY、HZ,滴定曲线如图:N..M现有1L浓度均为0.5mol/L的HY、NaY混合溶液,已知Ka(HY)=1×10-5(1)混合溶液pH约为多少?(2)向其中通入0.1molHCl气体(溶液体积变化忽略),估算平衡后溶液的pH(lg1.5≈0.18)若对pH=5的HCl、NaCl混合溶液中进行(2)操作,结果如何?55-0.18=4.82[刨根问底]——关注“隐蔽”问题2019年全国Ⅰ卷1.一定温度下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol·L-1的NaOH溶液,溶液pH变化的曲线如图所示。下列叙述中正确的是A.①点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)B.②点的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO)C
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 玛氏校招工作总结
- 2025年数学老师课堂教育方案
- 2025年学校暑期校本培训个人方案
- 2025年秋季幼儿园教研工作方案演讲稿
- 手术后病人的护理措施
- 2025年新生军训活动方案
- Excel在人力资源管理的应用1
- 避孕知识培训课件微盘
- 武汉大学《普通微生物学微生物学》2023-2024学年第二学期期末试卷
- 安徽蚌埠二中2024-2025学年高三下学期自测卷(三)线下考试物理试题含解析
- 五年级下册语文第五单元《形形色色的人》习作一等奖创新教学设计
- 色织物工艺设计2
- 液压系统符号
- 中考化学专题考点训练提升19 气体的制备(解析版)
- 年会颁奖晚会颁奖盛典简约PPT模板
- 绥江县农村饮水安全工程水质检测中心建设方案
- 钳工-实操技能试题
- 三次函数的图象与性质
- GB/T 755-2019旋转电机定额和性能
- GB/T 33474-2016物联网参考体系结构
- 上消化道早癌筛查须知

评论
0/150
提交评论