



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
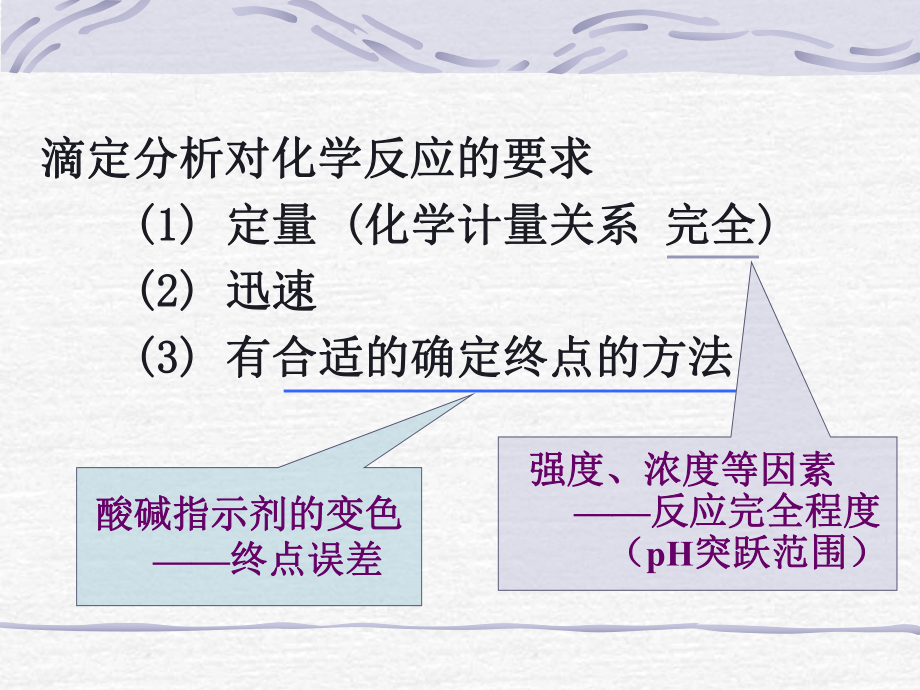
1、第 4 章 酸碱滴定法Acid-Base Titrations第四章第四章 酸碱滴定法酸碱滴定法 4-1 酸碱平衡中氢离子浓度的计算酸碱平衡中氢离子浓度的计算4-2 酸碱滴定曲线及滴定终点的检测酸碱滴定曲线及滴定终点的检测 4-2-1 酸碱指示剂酸碱指示剂 4-2-2 典型酸碱体系的滴定曲线典型酸碱体系的滴定曲线 及终点误差及终点误差4-3 酸碱滴定法的应用酸碱滴定法的应用滴定分析对化学反应的要求滴定分析对化学反应的要求 (1) (1) 定量定量 ( (化学计量关系化学计量关系 完全完全) ) (2) (2) 迅速迅速 (3) (3) 有合适的确定终点的方法有合适的确定终点的方法 强度、浓度等
2、因素强度、浓度等因素 反应完全程度反应完全程度 (pH突跃范围)突跃范围)酸碱指示剂的变色酸碱指示剂的变色 终点误差终点误差4-1 酸碱平衡中氢离子浓度的计算酸碱平衡中氢离子浓度的计算 质子条件质子条件 精确计算式精确计算式 近似计算式近似计算式 合理的近似计算标准合理的近似计算标准 pH 不超过不超过 0.02 个个pH单位单位 H+ 不超过不超过5 4-1-1 强酸或强碱溶液强酸或强碱溶液HCl溶液为例溶液为例 精确计算式精确计算式 近似计算式近似计算式 H+ = c + OH- - H+ = c c 20OH- - 或或 c2 20 KWHHWKc4-1-2 一元弱酸或弱碱溶液一元弱酸或
3、弱碱溶液 如浓度为如浓度为 c 的的HA溶液溶液 H+ = A- - + OH - - 精确计算式精确计算式 近似计算式近似计算式 最简式最简式 H+2 =Ka(c-H +) H+2=Kac H+2+KaH+ - Kac = 0 HHHAHW KKaHHHW KKcKaa24H2cKKK aaa cKaHA- - OH- - 即即c 与与Ka都不太小都不太小H+ c 210 cKa24H2cKKK aaa 4-1-2 一元弱酸或弱碱溶液一元弱酸或弱碱溶液 如浓度为如浓度为 c 的的HA溶液溶液 H+ = A- - + OH - - 精确计算式精确计算式 近似计算式近似计算式 最简式最简式 H+
4、2 =Ka(c-H +) H+2=Kac H+2+KaH+ - Kac = 0 HHHAHW KKaHHHW KKcKaacKaHHHWKc HHHW KcKa WHKcKa 4-1-3 多元酸或碱溶液多元酸或碱溶液 精确计算需解高次方程精确计算需解高次方程n元酸元酸n+1种存在形式种存在形式解解n+2次方程次方程H+ = H2A- - + 2HA2- - + 3A3- - + OH- -HHAH3HAH2HAHH33233321211wKKKKKKK aaaaaa 若若 C 较大,较大,Ka相差较多相差较多 常常可以当作一元酸考虑常常可以当作一元酸考虑4-1-3 多元酸或碱溶液多元酸或碱溶液
5、 近似计算式近似计算式 最简式最简式HAHH1n aK )H-(H12c aK c aK1H H+ c 2101 cK a混合酸(碱)溶液混合酸(碱)溶液 类似处理类似处理HHHCOHCOHHW3321KKK aa 4-1-5 两性物质的溶液两性物质的溶液从质子条件出发从质子条件出发精确计算需解高次方程精确计算需解高次方程如如 NaHCO3 溶液溶液 H+ + H2CO3 = CO32- + OH-HHHCOHCOHHW3321KKK aa 若进一步离解的若进一步离解的Ka和和Kb都不大,都不大,则则所得所得HA- - C,就可简化,就可简化CC4-1-5 两性物质的溶液两性物质的溶液 近似计
6、算式近似计算式 最简式最简式cKKcKK aaa 121WH)(21H aaKK cKKcKK aaa 121W2H)(c aK 1 当当W2KKc a 当当 C“主要平衡法主要平衡法” p.72 如如 HA NaA 溶液溶液 从质子条件出发,从质子条件出发, H+ = OH- + A- - cNaA H+ + HA cHA = OH- 代入代入 精确计算式精确计算式 近似计算式近似计算式 最简式最简式HOHHOH H-AHA cca HH H -AHA cca 酸酸性性: OHOH H -AHA cca 碱碱性性: -AHA Hcca HAAH a C 较大,较大, 0.05、cH cOH
7、4-1-6 弱酸及其共轭碱的溶液弱酸及其共轭碱的溶液 从质子条件出发从质子条件出发 合理简化合理简化 改用近似式乃至精确式改用近似式乃至精确式 最简式入手最简式入手 逐步逼近法逐步逼近法精确计算式精确计算式 近似计算式近似计算式 最简式最简式H+ + H2A = A2- + OH- H+ = OH- + A- - cNaA H+ + HA cHA = OH-cKaHcHc aK1H 21H aaKK -AHA Hcca OHH cOHAH OHAHAAHH322 - - - -32判断合理与否判断合理与否指示剂的指示剂的变色点变色点 变色范围变色范围 pH = pKHIn 1 HIn H+ +
8、 In- - 酸色酸色 碱色碱色4-2 酸碱滴定曲线及滴定终点的检测酸碱滴定曲线及滴定终点的检测4-2-1 滴定滴定终点的检测终点的检测 指示剂法和电位法指示剂法和电位法 酸碱指示剂:结构酸碱指示剂:结构颜色颜色HInHInIn HK HHInIn HIn K101 110 114-2-1 滴定滴定终点的检测终点的检测常用指示剂:甲基橙常用指示剂:甲基橙 甲基红甲基红 酚酞酚酞 p.77 混合指示剂:颜色的互补混合指示剂:颜色的互补 几种指示剂几种指示剂 指示剂指示剂惰性染料惰性染料 影响因素:影响因素: 温度温度 溶剂溶剂 用量用量 4-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差
9、1. 强碱(酸)滴定强酸(碱)强碱(酸)滴定强酸(碱) 0.1000mol/L NaOH 20.00ml 0.1000mol/L HCl (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素 (4)终点误差)终点误差 滴定前滴定前 pH CHCl pH = 1.00 滴定至滴定至Ep前前 pH C剩余剩余HCl (-0.1%) pH = 4.30 Ep 时时 中性(中性(NaCl) pH = 7.00 Ep 后后 pH C过量过量NaOH (+0.1%) pH = 9.70滴定突跃范围滴定突跃范围1. 强碱(酸)滴定强酸(碱)强碱(酸)滴定强酸(碱) 0.100
10、0mol/L NaOH 20.00ml 0.1000mol/L HCl (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 指示剂的变色范围指示剂的变色范围 滴定突跃范围滴定突跃范围 (3)影响因素)影响因素 (4)终点误差)终点误差4-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差 滴滴定定突突跃跃范范围围4-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差 1. 强碱(酸)滴定强酸(碱)强碱(酸)滴定强酸(碱) (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素浓度浓度大大 滴定突跃范围就大滴定突跃范围就大小小 滴定突跃范围就小滴定突跃范
11、围就小十倍十倍 Ep前后各前后各 1 个个pH单位单位 滴定突跃范围相差滴定突跃范围相差 2 个个pH单位单位NaOH 滴定滴定HCl 1mol/L pH3.3 10.7 0.1mol/L 4.3 9.7 0.01mol/L 5.3 8.7pH 3.3 10.74.3 9.75.3 8.74-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差 1. 强碱(酸)滴定强酸(碱)强碱(酸)滴定强酸(碱) (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素浓度浓度大大 滴定突跃范围就大滴定突跃范围就大小小 滴定突跃范围就小滴定突跃范围就小十倍十倍 Ep前后各约前后各
12、约 1 个个pH单位单位 滴定突跃范围相差约滴定突跃范围相差约 2 个个pH单位单位 滴定允许的相对误差滴定允许的相对误差 0.1 颜色判断的不确定性颜色判断的不确定性 0.2pH 认为认为 滴定突跃范围滴定突跃范围 0.4pH4-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差 1. 强碱(酸)滴定强酸(碱)强碱(酸)滴定强酸(碱) (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素 (4)终点误差)终点误差 Ep时时 H+ = OH- Ep前前 a = H+ - OH- Ep后后 a = OH- - H+ 100%)10-(10TE pEWpHpH c
13、K- -100%HOH 100% 100% 100% TEppppepeeee ccacannVV 总总余余( (过过)pepEpH-pHpH 2. 强碱(酸)滴定弱酸(碱)强碱(酸)滴定弱酸(碱) 0.1000mol/L NaOH 20.00ml 0.1000mol/L HAc (Ka = 1.8 10-5 ) (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素 (4)终点误差)终点误差 滴定前滴定前 pH CHCl pH = 1.00 滴定至滴定至Ep前前 pH C剩余剩余HCl (-0.1%) pH = 4.30 Ep 时时 中性(中性(NaCl) pH
14、 = 7.00 Ep 后后 pH C过量过量NaOH (+0.1%) pH = 9.70cKa-AHA cca cKbOH pH2.887.748.72pH 9.70 7.74(2)指示剂的选择)指示剂的选择2. 强碱(酸)滴定弱酸(碱)强碱(酸)滴定弱酸(碱)(3)影响因素)影响因素强度与浓度强度与浓度弱酸强度的弱酸强度的影响影响: :浓度一定时浓度一定时弱酸强度越大,滴定反应越完全,突跃范围越大弱酸强度越大,滴定反应越完全,突跃范围越大 Ka 大小大小 Ep和和Ep前的滴定曲线前的滴定曲线 1/10 Ep前前 各点各点pH增大增大 1 个单位个单位 ( Ep时时 pH增大增大 0.5 个单
15、位)个单位) Ep后后 pH值值基本不变基本不变 滴定突跃减小滴定突跃减小 1 个单位个单位2. 强碱(酸)滴定弱酸(碱)强碱(酸)滴定弱酸(碱)(3)影响因素)影响因素强度与浓度强度与浓度弱酸浓度弱酸浓度的影响的影响: :Ka一定时,一定时,浓度越大,滴定突跃范围越大浓度越大,滴定突跃范围越大 浓度大小浓度大小 Ep和和Ep后的滴定曲线后的滴定曲线 1/10 Ep前前 各点各点pH值值基本不变基本不变 ( Ep时时 pH减小减小 0.5 个单位)个单位) Ep后后 各点各点pH减小减小 1 个单位个单位 滴定突跃减小滴定突跃减小 1 个单位个单位2. 强碱(酸)滴定弱酸(碱)强碱(酸)滴定弱
16、酸(碱)(3)影响因素)影响因素强度与浓度强度与浓度 Ka c考虑考虑: 指示剂颜色判别不确定性指示剂颜色判别不确定性 0.2 个个pH单位单位 滴定突跃应滴定突跃应 0.4 个个pH单位单位 Ka c 2 10-8 若指示剂选择恰当,误差若指示剂选择恰当,误差 0.1 0.1000mol/L HCl 溶液滴定溶液滴定0.1000mol/L NH3 溶液溶液4-2-2 酸碱滴定曲线及终点误差酸碱滴定曲线及终点误差 2. 强碱(酸)滴定弱酸(碱)强碱(酸)滴定弱酸(碱) (1)滴定曲线)滴定曲线 (2)指示剂的选择)指示剂的选择 (3)影响因素)影响因素 (4)终点误差)终点误差 Ep时时 H+
17、 HA = OH- Ep前前 a = HA - OH- Ep后后 a = OH- - HA 100%)10-(10TE pEWpHpH cK- -100%OH 100%OHTE100%) HOH 100%TEHAepepepep cccca( Ep c a 分步滴定:分步滴定: c 2 10-8 106 104 c 2 10-10 3. 多元酸(碱)的滴定多元酸(碱)的滴定 以以NaOH H2A为例为例 H2AHA- A2- 21 aaKK 总量滴定总量滴定: c 2 10-81 aK2 aK21 aaKK 1 aK第一第一Ep(HCO3-) 104 pH = 8.3第二第二Ep(H2CO3)
18、 c 2 10-10 pH = 3.9Na2CO3 溶液(溶液(设设 0.1mol/L )(H2CO3 = 4.3 10-7 = 4.8 10-11) Na2CO3 = 2.1 10-4 = 2.3 10-81b K2b K1 aK2 aK21bb KK 2b K改善措施:改善措施:近近Ep时煮沸,时煮沸,CO2过量过量HCl煮沸,煮沸,回滴回滴CaK1H 21H aaKK 4-3 酸碱滴定法的应用酸碱滴定法的应用4-3-1 酸碱标准溶液酸碱标准溶液 基准物质基准物质( (指示剂指示剂) ) 标定标定HCl: 无水无水Na2CO3 Na2B4O7 10H2O 标定标定NaOH: KHC8H4O
19、4 H2C2O4 2H2O NaOH溶液中溶液中 CO2 的影响的影响 存在形式存在形式 终点终点pH值(体系)值(体系) CO2含量含量 标定与测定终点标定与测定终点pH一致一致 保存中吸收保存中吸收回复回复CO2形式形式( pH 5)2. . 铵盐中氮的测定铵盐中氮的测定 (1) 甲醛法甲醛法 4 NH4+ + + 6 HCHO = (CH2)6 N4H+ + + 3 H+ + + 6 H2O (2) 蒸馏法蒸馏法 NH4+ NH3 NH4+H3BO3吸收吸收 H2BO3 HCl滴定滴定 (过量)(过量) H3BO3 ( (甲基红甲基红) ) HCl吸收吸收 NH4Cl+HCl(已知(已知,过量)过量) NaOH回滴回滴( (甲基红甲
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 贵州省黔东南苗族侗族自治州2025届初三毕业班3月适应性线上测试(一)英语试题含答案
- 西北师范大学《沙盘模拟与管理建模》2023-2024学年第二学期期末试卷
- 彩色几何静物课件
- 小学生知识类话剧绘本
- 广东省安全员B证第四批(项目负责人)复审模拟题及答案
- 幼儿教育学绪论
- 电厂及变电站电气设备5电气主接线1
- 培训学校教师师德培训
- 小学语文教学技能培训
- CTR数据分享-突围jpg
- 公司非洲海外项目现场安全及人身安全管理办法
- 肿瘤患者围手术期心理变化及心理护理
- 中建室外总体工程施工方案
- 钳工实操试卷-共44套
- 人员增加申请表
- 电针刺激对c纤维镇痛效应的影响
- 跨境电子商务智慧树知到课后章节答案2023年下浙江工业大学
- 07FK02防空地下室通风设备安装图集
- 0-3岁婴幼儿保育与教育智慧树知到课后章节答案2023年下甘肃财贸职业学院
- 体外培育牛黄介绍-呼吸科课件
- 铁路损伤图谱PDF

评论
0/150
提交评论