



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
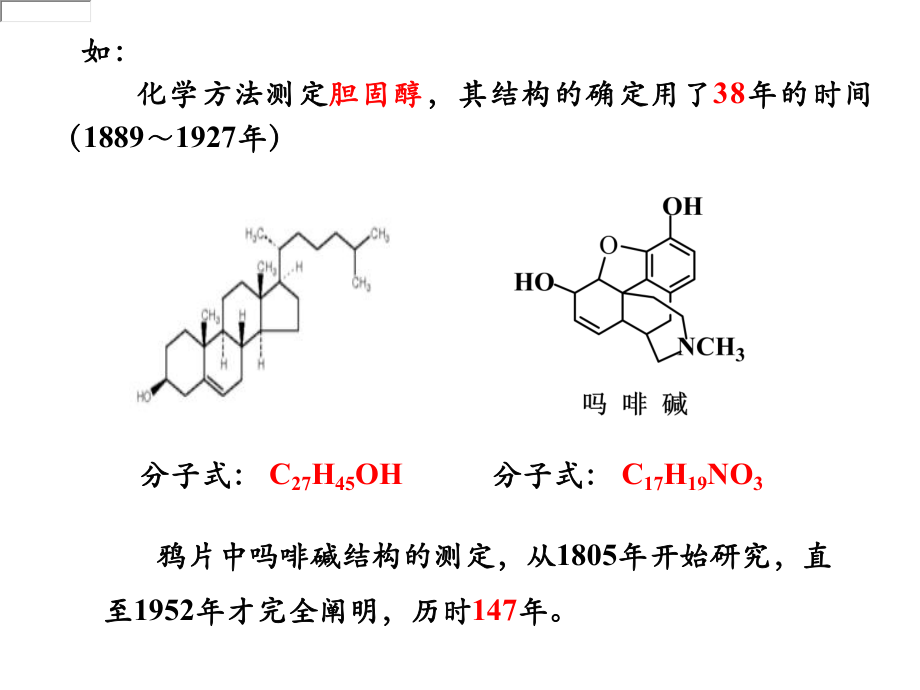
1、 有机化合物分子结构的测定是研究有机化合物的重要有机化合物分子结构的测定是研究有机化合物的重要组成部分。早期确定一个有机化合物的结构主要依靠化学组成部分。早期确定一个有机化合物的结构主要依靠化学方法方法(即从有机化合物的化学性质和合成来获得对结构的(即从有机化合物的化学性质和合成来获得对结构的认识)认识)。化学方法测定有化学方法测定有 机化合物结构机化合物结构 样品用量大样品用量大 工作繁重工作繁重 分析时间长分析时间长 准确性差准确性差第七章第七章 有机化合物波谱分析有机化合物波谱分析 化学方法测定化学方法测定胆固醇胆固醇,其结构的确定用了,其结构的确定用了38年的时间年的时间(188919
2、27年)年)分子式:分子式: C27H45OH 鸦片中吗啡碱结构的测定,从鸦片中吗啡碱结构的测定,从1805年开始研究,直年开始研究,直至至1952年才完全阐明,历时年才完全阐明,历时147年。年。如:如:分子式:分子式: C17H19NO3 近三、四十年来,由于科学技术的飞速发展,运用物理方法,近三、四十年来,由于科学技术的飞速发展,运用物理方法,如如X衍射衍射、红外光谱红外光谱、紫外光谱紫外光谱、核磁共振谱核磁共振谱和和质谱质谱等来测定有等来测定有机化合物的结构已成为常规的工作手段。机化合物的结构已成为常规的工作手段。物理方法的优点物理方法的优点 样品用量少(样品用量少(g-mg) 分析时
3、间短分析时间短 精确度高(精确度高(质谱法误差质谱法误差10-9, 而化学法而化学法 5%) 近代物理方法弥补了近代物理方法弥补了化学方法的不足,大大丰化学方法的不足,大大丰富了鉴定有机化合物的手富了鉴定有机化合物的手段,明显地提高了确定结段,明显地提高了确定结构的水平构的水平近代物理方法近代物理方法紫外光谱紫外光谱(uv)红外光谱红外光谱(IR)核磁共振谱核磁共振谱(NMR)质谱质谱(MS)四四大大光光谱谱第一节第一节 电磁波谱的一般概念电磁波谱的一般概念一、电磁波的区域划分一、电磁波的区域划分光光是一定波长范围的是一定波长范围的电磁波电磁波 电磁波的区域范围很广,根据波长不同,电磁波电磁波
4、的区域范围很广,根据波长不同,电磁波可分为若干个区域:可分为若干个区域:1. 波动性波动性光或电磁波具有两性光或电磁波具有两性波动性波动性微粒性微粒性光的传播服从波动的规律性,即光的传播服从波动的规律性,即. = c 波长,光波移动一周的距离。波长,光波移动一周的距离。 频率,每秒钟出现的周数,频率,每秒钟出现的周数, 单位:单位:赫赫(Hz) 或或周周 / 秒秒式中:式中:c 光速,即光速,即31010cm/s; 1nm = 10-3m = 10-7cm = 10-9m = 10A二、波长与频率二、波长与频率例如:波长为例如:波长为100nm 100nm 的光,它的频率是:的光,它的频率是:
5、频率也可用波数频率也可用波数( v( v或或 ) )表示,它们之间的关系:表示,它们之间的关系:- - - -波数,每波数,每cmcm长度内所含光波的数目,单位长度内所含光波的数目,单位: cm: cm-1 -1 = c/ = c/=1/=1/(cmcm-1 -1 ) = = = 3 = = = 3101015 15 (HzHz)c c 3 3101010101001001010-7 -7= = = 1= = = 110105 5 (-1 -1)1 1 1 11001001010-7 -7例如:波长为例如:波长为100nm 的光,它的能量为:的光,它的能量为:2. 微粒性微粒性光由具有一定能量
6、的微观粒子光由具有一定能量的微观粒子光量子组成光量子组成h= 6.6310-34 J S (焦焦秒秒)E = h (c/ )= 6.6310- 34 ( 310 10/ 10010-7)= 1.9910-18(J)光量子的能量光量子的能量(E)与光的频率及波长之间的关系为:与光的频率及波长之间的关系为:E=h = h (c/ )= h c h 普朗克普朗克(Planck)常数常数1. 吸收光谱的产生吸收光谱的产生 各种不同的分子对能量吸收是有选择性的。当分子受光各种不同的分子对能量吸收是有选择性的。当分子受光照射,吸收光的能量后,只有当光子的能量恰好等于分子中照射,吸收光的能量后,只有当光子的
7、能量恰好等于分子中某两个特定能级之间的能量差即某两个特定能级之间的能量差即( E = h = E2E1 )时才能时才能被吸收。被吸收。 吸收光波的波长,可以通过样品池的光线,在鉴定器上吸收光波的波长,可以通过样品池的光线,在鉴定器上予以鉴定,所得的图谱就叫予以鉴定,所得的图谱就叫 吸收光谱图。吸收光谱图。分子吸收电磁波所形成的光谱分子吸收电磁波所形成的光谱叫叫 吸收光谱吸收光谱。三、吸收光谱的概念三、吸收光谱的概念2. 吸收光谱分类吸收光谱分类分子中的能级:分子中的能级: 转动能级、振动能级和电子能级转动能级、振动能级和电子能级 光谱出现在远红外区和微波区光谱出现在远红外区和微波区,可用来测定
8、原子之间可用来测定原子之间的键长和键角。的键长和键角。 转动光谱转动光谱 分子吸收光能后只引起转动能级的变化。分子吸收光能后只引起转动能级的变化。 所需能量:所需能量:0.4 kJmol;吸收光的波长;吸收光的波长: 50m10 。分子吸收光谱可分为三类:分子吸收光谱可分为三类: 转动光谱、红外光谱和紫外光谱。转动光谱、红外光谱和紫外光谱。 振动光谱振动光谱 分子吸收光能后引起振动能级的跃迁而产生分子吸收光能后引起振动能级的跃迁而产生的光谱。的光谱。所需能量:所需能量:70 5 kJmol吸收光的波长:吸收光的波长: 2.5m10m形成光谱:形成光谱:红外光谱红外光谱 电子光谱电子光谱 分子吸
9、收光能后,某些电子由能级跃迁到高能级。分子吸收光能后,某些电子由能级跃迁到高能级。形成光谱:形成光谱:可见紫外光谱可见紫外光谱所需能量:所需能量:150650 kJmol吸收光的波长:吸收光的波长: 60 1250 nm第二节第二节 紫外可见光吸收光谱紫外可见光吸收光谱(UV) 紫外光谱吸收紫外光谱吸收是指分子中某些价电子吸收一定波长的是指分子中某些价电子吸收一定波长的紫外光,由低能级紫外光,由低能级(基态基态)跃迁至高能级跃迁至高能级(激发态激发态)而产生的光谱。而产生的光谱。200nm800nm称可见称可见紫外光谱紫外光谱分子吸收分子吸收E 价电子跃迁价电子跃迁 产生光谱产生光谱一、一、
10、紫外吸收的产生紫外吸收的产生1. 紫外区域划分紫外区域划分200nm400nm称紫外光谱称紫外光谱2.电子跃迁类型电子跃迁类型 一般所说的一般所说的紫外光谱紫外光谱就是就是紫外吸收电子光谱紫外吸收电子光谱,电子光谱电子光谱是指分子的是指分子的外层电子外层电子或或价电子价电子的跃迁而产生的。的跃迁而产生的。如甲醛:如甲醛:CHOH电子电子电子电子电子电子n电子电子 电子电子形成形成单键单键的电子的电子 电子电子形成形成不饱和键不饱和键的电子的电子 n 电子电子N、O、S、X等含有未成键的孤对电子等含有未成键的孤对电子有机化合物分子中几种不同性质的价电子有机化合物分子中几种不同性质的价电子有机化合
11、物分子中有成键价电子,相应有反键空轨道。有机化合物分子中有成键价电子,相应有反键空轨道。 有机分子中的常见轨道有有机分子中的常见轨道有、*、*和和n轨道轨道,当它吸收当它吸收一定能量后,可以产生不同的电子跃迁:一定能量后,可以产生不同的电子跃迁:*n有机分子中的轨道和电子跃迁有机分子中的轨道和电子跃迁*En * 吸收一定能量后,价电子将从低能量轨道(基态)跃迁到吸收一定能量后,价电子将从低能量轨道(基态)跃迁到较高的能级较高的能级(激发态激发态)时,电子所占的轨道为反键轨道。时,电子所占的轨道为反键轨道。基态基态激发态激发态*hE有机化合价电子可能产生的跃迁主要为:有机化合价电子可能产生的跃迁
12、主要为:(1)*饱和饱和CC、CH 键才产生键才产生, E 最大最大。*n *nEn *(2)n * 杂原子中杂原子中n电子向电子向*跃迁,跃迁,E次大次大。(3)n * 杂原子中杂原子中n电子向电子向*跃迁,跃迁,E最小,最小, R带带(4)*不饱和烃才产生,不饱和烃才产生,E次小,次小, K带带)能量大小顺序:能量大小顺序: * n* * n*n *nEn * 一般未成键孤对电子轻易激发,成键电子中一般未成键孤对电子轻易激发,成键电子中电子较相电子较相应的应的电子具有较高的能级,而反键电子却相反。因此,简电子具有较高的能级,而反键电子却相反。因此,简单分子中单分子中n*跃迁需最小能量,吸收
13、带出现在长波段,跃迁需最小能量,吸收带出现在长波段, n*及及*跃迁的吸收带出现的较短波段,而跃迁的吸收带出现的较短波段,而*跃跃迁则出现在远紫外区。迁则出现在远紫外区。 紫外吸收光谱紫外吸收光谱是由分子中电子能级的跃迁而产生。位于是由分子中电子能级的跃迁而产生。位于可可见见-紫外光紫外光区,用区,用可见可见-紫外分光光度计紫外分光光度计进行测定。测出的进行测定。测出的吸光吸光度度波长波长曲线曲线(即吸收光谱图即吸收光谱图)max= 280 nm max= 14.814.8280320250481216 / nmlog二、紫外光谱图的产生二、紫外光谱图的产生丙酮紫外光谱图:丙酮紫外光谱图:横坐
14、标:横坐标:表示吸收峰的表示吸收峰的位置,用位置,用波长波长(nm)表示。表示。纵坐标纵坐标:表示吸收强度。表示吸收强度。吸光度吸光度(A)、透过百分率、透过百分率(T%)、摩尔吸光系数、摩尔吸光系数(或或 )值在值在10105 104 强吸收强吸收 = 103104 较强吸收较强吸收 = 103102 弱吸收弱吸收I 入射光线入射光线LI (透过光强度透过光强度)样品池样品池紫外光谱吸收强度紫外光谱吸收强度 紫 外 光 谱 强 度 用 吸 光 度 表 示 , 用紫 外 光 谱 强 度 用 吸 光 度 表 示 , 用 朗 勃 特朗 勃 特 比 尔比 尔(Lambert-Beer)定律描述定律描
15、述 吸光度吸光度A和溶液的和溶液的浓度浓度C(mol/L)和光通过的溶液和光通过的溶液厚度厚度L(cm)成正比。成正比。增大,吸收光谱增强。增大,吸收光谱增强。吸光系数:吸光系数:透过率:透过率: T吸光度吸光度A1. 饱和脂肪族化合物饱和脂肪族化合物 含杂原子的饱和烃类含杂原子的饱和烃类n*: 在近紫外区边缘,不易观察,故一般也可作溶剂。在近紫外区边缘,不易观察,故一般也可作溶剂。 烃类烃类:只有只有*,max 200 nm一般可用作溶剂。一般可用作溶剂。 max CH3OH 183nm( =502 ) CH3OCH3 185nm( =2520 ) CH3Br 204nm( = 200)三、
16、紫外光谱与分子结构的关系三、紫外光谱与分子结构的关系CH4 :125nmCH3 CH3:135nm195nm有有*和和n*跃迁跃迁2. 不饱和脂肪族化合物不饱和脂肪族化合物共轭烯烃共轭烯烃C C C C 共轭体系越长,跃迁能阶相差越小,吸收向长波方共轭体系越长,跃迁能阶相差越小,吸收向长波方向移动,甚至可由近紫外区移至可见光区,向移动,甚至可由近紫外区移至可见光区,也增强。也增强。含碳碳双键化合物:有含碳碳双键化合物:有*孤立烯烃孤立烯烃* max 185nm, max 5000 ) 5000 ) 按各种排列组合法可能结构式有按各种排列组合法可能结构式有3030多种,但根据多种,但根据uv u
17、v 数数据推断它是一个共轭酮式共轭醛。故可能结构为:据推断它是一个共轭酮式共轭醛。故可能结构为:CH2C CCH3OH3. 3. 判断共轭体系判断共轭体系CH3CH CH COH max (nm) max可能结构可能结构200-40010000(强吸收)(强吸收)(示有(示有K带)可判可能含有二个双键共轭带)可判可能含有二个双键共轭分子分子C=C-C=CC=C-C=O260-300104 (强吸收)(强吸收)(示有(示有K带)可判有带)可判有35个不饱和共轭体个不饱和共轭体系系260-3002001000 (中强吸收)(中强吸收)(示有(示有B带)可判化合物含有苯环结构带)可判化合物含有苯环结
18、构250-30010100 (弱(弱吸收)吸收)(示有(示有R带),可判分子中可能有带),可判分子中可能有( C=O )羰基。)羰基。4. 化合物分子结构的初步估计化合物分子结构的初步估计第三节第三节 红外光谱(红外光谱(IR) 红外光谱红外光谱是测定有机化合物的重要物理方法之一。它可用是测定有机化合物的重要物理方法之一。它可用于分子中所含于分子中所含官能团的鉴定官能团的鉴定,亦可进行组分纯度分析及某些理,亦可进行组分纯度分析及某些理论研究,还可与其它手段配合推断未知物分子的结构。论研究,还可与其它手段配合推断未知物分子的结构。 红外光谱:红外光谱:是以连续波长的红外光照射样品,由于分子是以连
19、续波长的红外光照射样品,由于分子吸收了红外线的能量,引起分子内振动能级的跃迁而产生。吸收了红外线的能量,引起分子内振动能级的跃迁而产生。红外光红外光在在0.75500m 范围范围近红外区:近红外区: =0.752.5 m中红外区:中红外区: =2.525m远红外区:远红外区: 2 5m振动方式分两大类振动方式分两大类伸缩振动伸缩振动()弯曲振动弯曲振动()一、基本原理一、基本原理1. 分子的振动形式分子的振动形式 分子中的原子是通过化学键连接起来,它们不是静止的,分子中的原子是通过化学键连接起来,它们不是静止的,而是在它的平衡位置周围振动而是在它的平衡位置周围振动伸缩振动伸缩振动()C C对对
20、 称称 伸伸 缩缩 振振 动动 ( ( s) )( ( 2 2 8 8 5 5 3 3 c c m m- - 1 1) )C C不不 对对 称称 伸伸 缩缩 振振 动动( ( va s) )( ( 2 2 9 9 2 2 6 6 c c m m- - 1 1) )(2)弯曲振动:弯曲振动: 2. 振动频率与吸收带的位置振动频率与吸收带的位置 分子是由原子组成,原子与原子之间有电子云形成化学键。分子是由原子组成,原子与原子之间有电子云形成化学键。为了简化讨论,可把原子模拟为不同质量(为了简化讨论,可把原子模拟为不同质量(m1、m2)的小球;)的小球;把化学键模拟为不同强度、力常数为(把化学键模拟
21、为不同强度、力常数为(K)的弹簧。)的弹簧。K根据虎克定律:根据虎克定律:k12= = ,= = c1c表示一个分子的表示一个分子的折合质量折合质量=m1m2m1+ m21307=或或1C2k =m1m2K (m1+ m2) 振动频率振动频率 与与 K 成正比成正比 (即(即K则则) 振动频率振动频率 与与 成反比(即成反比(即则则 ) (m1 和和 m2 则则): 与成键两个原子的量相关;与成键两个原子的量相关;k: 与两个原子形成的化学键强度,即键能相关;与两个原子形成的化学键强度,即键能相关;原子振动频率、吸收带的位置与化学键关系原子振动频率、吸收带的位置与化学键关系例如:例如: CH键
22、,键,K=4.8 O-H N-H C-H -C-O-HO=36003300 35003300 31002800 32002500伸缩振动伸缩振动(cm-1) C - H C- C C - Cl 31002800 14001000 700600伸缩振动伸缩振动(cm-1)K= 4.5 9.77 12.2 14001000 18001600 25002000伸缩振动伸缩振动(cm-1) C- C C = C C = C 29982800 31003000 3300伸缩振动伸缩振动(cm-1) -C- H = C-H = C-H 红外光谱规律红外光谱规律则则= 13074.8 (12+ 1)121=
23、 2980cm-11. 基频区与指纹区基频区与指纹区高频区高频区40002000cm-1低频区低频区20001400cm-1(指(指 纹纹 区)区)高高 频频 区区4000 3000 2000 1400 650 400 cm-120406080T%低低 频频 区区( 基基 团团 频频 率率 区区 )二、红外光谱图与有机分子结构的关系二、红外光谱图与有机分子结构的关系 指纹区指纹区: 1400650cm-1 (主要为化学键的弯曲振动)(主要为化学键的弯曲振动) 基频区基频区40001400cm-1 (多为伸缩振动多为伸缩振动)低低频频区区高高 频频 区区指纹区指纹区T%(指(指 纹纹 区)区)高
24、高 频频 区区4000 2500 2000 1400 900 650 cm-120406080低低 频频 区区( 基基 团团 频频 率率 区区 )O-H(31003000) =C-H(3300)=C-H(31003000) -C-H(29982800)Ar-H(31003000)COO-H(31003000) N-H(35003100)C = CC = N C=O(18701600) C=C(17801600)(16501500) N-H芳烃芳烃C C(1600 ,1500) -(CH2)n-n 4芳烃取芳烃取代情况代情况 双键取双键取代构型代构型 C-C C-O C-N红外光谱吸收峰形状红外
25、光谱吸收峰形状2. 官能团特征吸收带官能团特征吸收带CH(高频区)(高频区):29602850cm-1 24 峰峰1 :11 :2 CH(低频区)(低频区):14751380cm-1 多为双峰多为双峰 烷烃烷烃常见峰常见峰:特殊峰:特殊峰:(CH2)n n4 720cm-1 13951385cm-113851380cm-1双峰双峰双峰双峰13701365cm-113751365cm-1CH3CH3CH3CCH CH3CH3强强弱弱正辛烷正辛烷2980295014701390720图中:图中:2980cm-1为为CH3,CH2的不对称的不对称伸缩伸缩振动振动2950cm-1为为CH3,CH2的对
26、称的对称伸缩伸缩振动振动1390cm-1为为CH2的对称弯曲振动的对称弯曲振动1470cm-1为为CH3不对称弯曲振动及不对称弯曲振动及CH2剪式振动剪式振动720cm-1为为 -(CH2)n- ,n4面内摇摆振动面内摇摆振动3000295016001400965720700135014701680295030803000cm-1为为=C-H 伸缩振动伸缩振动1600cm-1为为 C=C 伸缩振动伸缩振动965cm-1为反式烯烃弯曲振动为反式烯烃弯曲振动2950 2890cm-1双峰为双峰为 CH3,CH2伸缩振动伸缩振动720cm-1为为-(CH2)n- n4 弯曲振动弯曲振动1400cm-
27、1为为C-H 弯曲振动弯曲振动700cm-1顺式烯烃弯曲振动顺式烯烃弯曲振动2980 2850cm-1为为 CH3,CH2伸缩振动伸缩振动1350cm-11470cm-1为为C-H 弯曲振动弯曲振动1680cm-1为为C=C 伸缩振动伸缩振动3080cm-1为为=C-H 伸缩振动伸缩振动1525 1475cm-11625 1570cm-1CCC-H3080 3030cm-1 芳烃芳烃C-H900 700cm-1苯苯 : 670cm-1二取代苯:二取代苯:邻位:邻位:770 735cm-1对位:对位:860 800cm-1间位:间位:725 680cm-1810 750cm-1770 730cm
28、-1一取代苯:一取代苯:710 690cm-1三、红外光谱的应用三、红外光谱的应用1. 确证两种化合物是否同一物确证两种化合物是否同一物同一物同一物两两 者者 相相 同同两者相差小两者相差小(可能含杂质)(可能含杂质)两者相差大两者相差大不同物不同物2. 鉴别未知物鉴别未知物 对于一些分子式相同而结构不同的有机化合物,可根据分对于一些分子式相同而结构不同的有机化合物,可根据分子中所含官能团或空间位置的不同而用子中所含官能团或空间位置的不同而用IR区别之。如:区别之。如:分别把两种化合物进行红外光谱测定,然后对照两者光谱图。分别把两种化合物进行红外光谱测定,然后对照两者光谱图。33203310c
29、m-1 19801930cm-1C-HC=C=C和和H-CC-CH2-CH2=C=CH-故故C11 H24 结构式为结构式为 CH3-(CH2)9-CH3IR:2960cm-12870cm-1CH1470cm-11380cm-1C H2960287014701380720 某化合物分子式为某化合物分子式为C11 H24 ,其红外光谱图如下所示,确,其红外光谱图如下所示,确定此化合物的结构。定此化合物的结构。证明为饱和化合物证明为饱和化合物不饱和度:不饱和度:0720cm-1 为为(CH2)n n4,弯曲振动,弯曲振动C:91.4% 91.4 /12 =7.67H:8.7% 8.7 /1 = 8
30、.7 8故实验式为故实验式为C7 H8=nc+1 - = 7+1 - =4nH228证明可能含有苯环证明可能含有苯环1600148077071029602870147513803030 例:一挥发性的无色液体经元素分析结果例:一挥发性的无色液体经元素分析结果C占占91.4% , H占占8.7% ,它的红外光谱如图它的红外光谱如图8-11所示,确定这个化合物的结构。所示,确定这个化合物的结构。第四节第四节 核磁共振谱(核磁共振谱(NMR) 核磁共振谱核磁共振谱(NMR)是在是在50年代中期后才发展起来的,年代中期后才发展起来的,虽然历史不长,但目前已成为研究有机化合物分子结构的虽然历史不长,但目
31、前已成为研究有机化合物分子结构的一种强有力的工具。一种强有力的工具。氢谱(氢谱(PMR或或1HNMR) 提供分子中不同种类氢原子的情报提供分子中不同种类氢原子的情报碳谱:碳谱:13C-核磁共振谱(核磁共振谱(13CNMR) 利用碳同位素利用碳同位素13C来测定分子中有多少不同来测定分子中有多少不同的碳原子以及对称性的判断。的碳原子以及对称性的判断。1.1 原子核的自旋原子核的自旋1 基本原理基本原理 带电荷的质点自旋会产生磁场,磁场具有方向性,带电荷的质点自旋会产生磁场,磁场具有方向性,可用磁矩表示。可用磁矩表示。 原子核作为带电荷的质点,自原子核作为带电荷的质点,自旋可以产生磁矩,但并非所有
32、原子旋可以产生磁矩,但并非所有原子核自旋都具有磁矩。核自旋都具有磁矩。 实验证明:只有那些原子序数实验证明:只有那些原子序数或质子数为奇数的原子核自旋才具有或质子数为奇数的原子核自旋才具有磁矩。如:磁矩。如:1H、13C、15N、17O、19F 等。等。 氢核(质子)带有正电荷,自旋会产生磁矩,在没有氢核(质子)带有正电荷,自旋会产生磁矩,在没有外磁场时自旋磁矩取向是混乱的。外磁场时自旋磁矩取向是混乱的。但在外磁场但在外磁场H H0 0中它的取向分为二种:中它的取向分为二种: 一种与外磁场一种与外磁场平平行行,另一种则,另一种则相反相反。这两种不同取向的这两种不同取向的自旋具有不同能量。自旋具
33、有不同能量。H H0 0与与H H0 0 方向相反方向相反自旋能量高自旋能量高与与H H0 0 方向一致方向一致自旋能量低自旋能量低能量差:能量差: E Eh h r2 2 H H0 0 电磁辐射可以有效地提供能量。当辐射能恰好等于跃迁电磁辐射可以有效地提供能量。当辐射能恰好等于跃迁所需要能量时,即:所需要能量时,即:E辐辐 = h = E 就会发生这种自旋取向的就会发生这种自旋取向的变化,也即是质子吸收能量从变化,也即是质子吸收能量从低能态低能态跃迁到跃迁到较高能态较高能态而产生而产生信号,这种现象称为信号,这种现象称为核磁共振核磁共振。反映到图谱上有吸收峰,即。反映到图谱上有吸收峰,即核磁
34、共振核磁共振。 1.2 核磁共振现象核磁共振现象能量差:能量差: Ehr2H0 与外加磁场与外加磁场HO方向相同方向相同的自旋吸收能量后可以跃迁到的自旋吸收能量后可以跃迁到较高能级,变为与外磁场较高能级,变为与外磁场方向相反方向相反的自旋。的自旋。高能态高能态低能态低能态EHH磁场磁场HOEE辐辐 = h = E 即即: 频率频率 , 则则HO h -普朗克常数,普朗克常数, h = 6.62610-34J . S r -旋磁比常数,旋磁比常数, rH = 26753-圆周率常数,圆周率常数, =3.14Ho-外磁场强度外磁场强度, 单位:单位:高斯高斯E =r .( h/2).H0 H原子核
35、在外加原子核在外加H0磁场中自旋能级跃迁条件:磁场中自旋能级跃迁条件:E =h 电磁场辐射能量与频率关系电磁场辐射能量与频率关系h =r .( h/2).H0 =(r /2).H0 H原子核在外加原子核在外加H0磁场中自旋能级差磁场中自旋能级差1.3 1HNMR谱图的组成谱图的组成氢谱有四部分组成氢谱有四部分组成化学位移化学位移氢质子的特性氢质子的特性 一组组的峰一组组的峰分子中氢质子的种类分子中氢质子的种类积分曲线(或积分值)积分曲线(或积分值)-氢质子数目氢质子数目 偶合常数偶合常数氢质子周围其他质子情况氢质子周围其他质子情况2.1 氢原子的屏蔽效应氢原子的屏蔽效应 但实验证明,在固定频率
36、下,分子中不同类型的氢但实验证明,在固定频率下,分子中不同类型的氢核发生核磁共振所需的外加磁场强度是不同的。核发生核磁共振所需的外加磁场强度是不同的。低磁低磁高磁高磁 当氢核发生核磁共振时,频率和外加磁场强度之间存在着当氢核发生核磁共振时,频率和外加磁场强度之间存在着如下关系式:如下关系式: =(r /2).H0 由于质子磁旋比由于质子磁旋比r值是常数,只要频率值是常数,只要频率()固定,似乎有机化固定,似乎有机化合物分子中所有的氢核都应在同一磁场强度下发生核磁共振。合物分子中所有的氢核都应在同一磁场强度下发生核磁共振。 例如,乙醚例如,乙醚CH3CH3OCH2CH2 样品在固定频率下进行样品
37、在固定频率下进行磁场强度由低至高的扫描,磁场强度由低至高的扫描,首先出现首先出现CH2基的基的 H 的吸收的吸收信号,然后是信号,然后是CH3中的中的 H 。2、化学位移、化学位移HO电子环流电子环流+质子质子 感应磁场与外磁场方向相同,感应磁场与外磁场方向相同,则质子实际上感受到的有效磁场应则质子实际上感受到的有效磁场应是外磁场强度加上感应磁场强度。是外磁场强度加上感应磁场强度。这种作用称这种作用称去屏蔽效应去屏蔽效应。质子质子电子云密度电子云密度 ,感应磁场,感应磁场 ,屏蔽效应屏蔽效应在高场共振在高场共振质子质子电子云密度电子云密度 ,感应磁场,感应磁场 ,屏蔽效应屏蔽效应在低场共振在低
38、场共振 分子中原子核不是完全裸露的,质子被电子包围着,电子在外分子中原子核不是完全裸露的,质子被电子包围着,电子在外界磁场的作用下引起电子环流,在环流中产生了另一个与外磁场方界磁场的作用下引起电子环流,在环流中产生了另一个与外磁场方向相反的感应磁场。向相反的感应磁场。感应磁场感应磁场H去屏蔽区去屏蔽区屏蔽区屏蔽区 感应磁场与外磁场方向相反,感应磁场与外磁场方向相反,使质子感受到的有效磁场使质子感受到的有效磁场(H有效有效)要要比实际外加磁场强度比实际外加磁场强度(HO)小,这种小,这种效应叫效应叫屏蔽效应屏蔽效应。H有效有效 =H0 H感应感应2. 2 化学位移和表示化学位移和表示 由于氢原子
39、核在分子中所处环境不同受到不同的屏蔽效应,由于氢原子核在分子中所处环境不同受到不同的屏蔽效应,核外电子云密度不同,它们的共振吸收位置核外电子云密度不同,它们的共振吸收位置出现出现在不同磁场强在不同磁场强度,用来表示这种不同位置的量差距叫做度,用来表示这种不同位置的量差距叫做化学位移化学位移。样品样品-TMS0= 106(ppm)012345678910TMS低磁低磁高磁高磁 化学位移采用相对数值表示,即选用一个标准物质,化学位移采用相对数值表示,即选用一个标准物质,四四甲基硅烷甲基硅烷(TMS) CH3CH3CH3CH3Si 通常用通常用值值表示化学位移。表示化学位移。值值是样品和标准物是样品
40、和标准物TMS的共振的共振频率之差除以采用仪器的频率频率之差除以采用仪器的频率(o )。由于数值大小,所以乘以。由于数值大小,所以乘以106,单位用,单位用ppm表示。表示。选用选用TMS(四甲基硅烷四甲基硅烷)作为标准物质原因:作为标准物质原因: (1)屏蔽效应强,共振信号在高场区屏蔽效应强,共振信号在高场区(值规定为值规定为0),绝大多数吸收峰均出现在它的左边。绝大多数吸收峰均出现在它的左边。 (2)结构对称,是一个单峰。结构对称,是一个单峰。 (3)容易回收容易回收(b.p低低),与样品不反应、不缔合。,与样品不反应、不缔合。 6010TMS试样化 学 位 移试样的共振频率标准物质TMS
41、的共振频率感生磁场H非常小,只有外加磁场的百万分之几,为方便起见,故106化学位移化学位移不同可用来鉴别或测定不同可用来鉴别或测定有机化合物的结构!有机化合物的结构!2.3 信号数目信号数目( 等性质子与不等性质子等性质子与不等性质子) 质子所处的质子所处的化学环境相同化学环境相同等性(价)质子等性(价)质子只只得出得出一种信号一种信号(即具有相同化学位移值即具有相同化学位移值)。 质子所处的质子所处的化学环境不相同化学环境不相同不等(价)性质子不等(价)性质子产生产生不同的信号不同的信号(即具有不同的化学位移值即具有不同的化学位移值)质子等性判断:质子等性判断:用一个取代基(用用一个取代基(
42、用Y表示)分别代替分子中的质子,表示)分别代替分子中的质子,Y取取代后的产物若相同或是对映体,则取代质子为化学等价的,反代后的产物若相同或是对映体,则取代质子为化学等价的,反之亦然。之亦然。(1) 等性质子与不等性质子等性质子与不等性质子(2)核磁共振谱中信号数目)核磁共振谱中信号数目-组峰的数目组峰的数目核磁共振谱的信号数目核磁共振谱的信号数目 质子种类数目:组峰数目质子种类数目:组峰数目HHHHHHCH3-C-CH3=OCH3-CH3CH2CH2CH2 只有一种质子化合物只有一种质子化合物在在NMR只给出一个峰只给出一个峰(一种信号一种信号) 有两种不等性质子化合物有两种不等性质子化合物
43、有三种不等性质子化合物有三种不等性质子化合物 有四种不等性质子化合物有四种不等性质子化合物CH3CH2C-OCH2CH3=OCH3-OCH3CH3HHHHH(1)特征)特征H化学位移值范围化学位移值范围2.4 化学位移与有机分子结构的关系化学位移与有机分子结构的关系质子的类型质子的类型化学位移化学位移质子的类型质子的类型化学位移化学位移RCH30.9ArOH4.5-4.7(分子内缔合(分子内缔合10.516)R2CH21.3R3CH1.5R2C=CROH1519(分子内缔合)(分子内缔合)R2C=CRCH31.7RCH2OH3.44(CH2)30.22ROCH33.54R2C=CH24.55.
44、9RCHO910R2C=CRH5.3RCOCR2H22.7RCCH73.5HCR2COOH22.6ArCR2H2.23R2CHCOOR22.2RCH2F44.5RCOOCH33.74RCH2Cl34RCCCOCH323RCH2Br3.54RNH2或或R2NH0.55(峰不尖锐,(峰不尖锐,常呈馒头形)常呈馒头形)RCH2I3.24ROH0.55.5(温度、(温度、溶溶剂、浓度改变时影响剂、浓度改变时影响很大)很大)RCONRH或或ArCONRH59.4 诱导效应和共轭效应诱导效应和共轭效应 杂化态杂化态 各向异性各向异性 氢键氢键影响电子云密度影响电子云密度 不同的原因不同的原因 同一分子,同
45、一分子,等性氢等性氢有相同有相同值值。 一定化学环境的质子一定化学环境的质子在不同分子中,有大致相同的在不同分子中,有大致相同的值值。化学位移化学位移值不同,主要是由于电子云密度不同而引起的。值不同,主要是由于电子云密度不同而引起的。化学位移化学位移一般特点:一般特点: 与氢连接与氢连接C的杂化态的影响的杂化态的影响-质子上电子云密度影响质子上电子云密度影响SP3杂化杂化SP2杂化杂化SP杂化杂化电负性逐渐增大电负性逐渐增大(2)化学位移)化学位移值大小的一般规律值大小的一般规律值值, 0.21.6CHsp3ArH 值值, 6.58.5CHsp2值值, 4.57.5C H值值, 910OC H
46、值值, 23 (CH)CHsp 元素的电负性元素的电负性,通过诱导效应,使,通过诱导效应,使H核的核外电子云核的核外电子云密度密度,屏蔽效应,屏蔽效应,共振信号,共振信号低场。低场。低低 场场 氢质子连接的碳原子上有吸电子取代基或给电子取氢质子连接的碳原子上有吸电子取代基或给电子取代基时,是质子周围电子云密度变化,化学位移改变。代基时,是质子周围电子云密度变化,化学位移改变。 与碳原子连接基团电负性的影响与碳原子连接基团电负性的影响-质子上电子云密度影响质子上电子云密度影响化合物化合物 CHCl3 CH2Cl2 CH3Cl : 7.27 5.30 3.05a) 对于对于CH3X型分子,型分子,
47、X电负性电负性,则,则H 的的值值(向低场向低场)化合物化合物 CH3F CH3Cl CH3Br CH3I电负性电负性 F=4.0 Cl=3.0 Br=2.8 I=2.5 : 4.26 3.05 2.68 2.16化合物化合物 CH3 CH3 CH3NH2 CH3OH CH3F电负性电负性 C=2.5 N=3.0 O=3.5 F=4.0 : 1.1 2.2 3.38 4.26b) 连接连接电负性基团数目电负性基团数目,则,则值值CCH3CH3CH3HCH3CH2CH3CH3CH3化合物化合物:1.51.31.1c) 值值随着随着H原子原子与与电负性基团距离电负性基团距离增大增大而而减小减小 化
48、合物化合物 BrCH2CH2CH3 BrCH2CH2CH3 BrCH2CH2CH3 : 3.70 1.69 1.25d) 连接连接烃基烃基R ,则则值值 氢键的形成可以削弱对氢键质子的屏蔽,即氢键有氢键的形成可以削弱对氢键质子的屏蔽,即氢键有去屏蔽效应,使氢核磁共振出现在低场,化学位移值显著去屏蔽效应,使氢核磁共振出现在低场,化学位移值显著升高。升高。如:如: R-OH =0.55.5PPmR-COOH =10.512PPmR-NH2 =0.55.0PPm=4.07.7PPmOH氢键氢键-质子上电子云密度影响质子上电子云密度影响 氢键形成的程度与样品浓度、温度等有直接关系氢键形成的程度与样品浓
49、度、温度等有直接关系,因此因此它们的化学位移变化范围较大。一般当升高温度或稀释溶它们的化学位移变化范围较大。一般当升高温度或稀释溶液时,氢键和缔合会减弱,可使氢核信号向高场移动。液时,氢键和缔合会减弱,可使氢核信号向高场移动。 各向异性的影响各向异性的影响-分子整体电子云的影响分子整体电子云的影响a) 双键化合物的各向异性双键化合物的各向异性 烯烃双键碳上的烯烃双键碳上的H质子位于质子位于键环流电子产生的键环流电子产生的感生感生磁场与外加磁场方向一致的区域磁场与外加磁场方向一致的区域(称为去屏蔽区),(称为去屏蔽区),去去屏蔽效应的结果,使烯烃双键碳上的屏蔽效应的结果,使烯烃双键碳上的质子质子
50、的的共振信号移共振信号移向稍低的磁场区,向稍低的磁场区,其其 = 4.55.7。 芳环的芳环的电子电子在分子平面上下形成在分子平面上下形成电子云电子云,在外加磁,在外加磁 场的作用下,产生环流,生成感应磁场,芳环上氢核周围场的作用下,产生环流,生成感应磁场,芳环上氢核周围感感应磁场应磁场与与外磁场外磁场方向一致方向一致,因此质子处于,因此质子处于去屏蔽区去屏蔽区,因而,因而 在低场共振,所以化学位移大在低场共振,所以化学位移大(=7.2PPm)b) 芳香化合物苯环上质子的各向异性芳香化合物苯环上质子的各向异性c) 与与C C相连的质子各向异性相连的质子各向异性 碳碳三键是直线构型,碳碳三键是直
51、线构型,电子云围绕碳碳电子云围绕碳碳键呈筒型分键呈筒型分布,形成环电流,它所产生的感应磁场与外加磁场方向相布,形成环电流,它所产生的感应磁场与外加磁场方向相反,故三键上的反,故三键上的H质子处于屏蔽区,屏蔽效应较强,使三键质子处于屏蔽区,屏蔽效应较强,使三键上上H质子的共振信号移向较高的磁场区,其质子的共振信号移向较高的磁场区,其= 23。 3 峰面积与氢原子数目峰面积与氢原子数目 在在NMR谱图上,同一类氢核的个数与其相应共振吸收峰的谱图上,同一类氢核的个数与其相应共振吸收峰的面积成正比。面积成正比。 现在仪器能够对峰面积进行自动积分,得到的数值用阶梯现在仪器能够对峰面积进行自动积分,得到的
52、数值用阶梯式积分曲线高度来表示。式积分曲线高度来表示。0.6cm0.9cmCH3CH2OCH2CH30.6 :0.9 = 2 :3峰面积之比峰面积之比 =质子数目之比质子数目之比积分高度之比积分高度之比 = 质子数目之比质子数目之比根据峰面积和组峰数目,确定分子中质子种类和相对个数。根据峰面积和组峰数目,确定分子中质子种类和相对个数。 4.1 自旋偶合的产生(峰的分裂)自旋偶合的产生(峰的分裂)4 核磁共振峰的裂分和自旋偶合核磁共振峰的裂分和自旋偶合自旋分裂自旋分裂 由于分子中由于分子中相邻碳原子相邻碳原子上的上的质子质子自旋的相互作用(即自旋的相互作用(即自旋偶合),相互影响而引起谱线增多现
53、象称为自旋偶合),相互影响而引起谱线增多现象称为自旋裂分自旋裂分。 在高分辨率核磁共振谱仪测定在高分辨率核磁共振谱仪测定CH3CH2OH时时CH3和和CH2的共振吸收峰都不是单峰,而是多重峰。的共振吸收峰都不是单峰,而是多重峰。 相邻两个小峰之间的距离叫做耦合常数,用相邻两个小峰之间的距离叫做耦合常数,用J表示,单表示,单位为位为Hz。 在核磁共振中,一般来说,相邻碳上的不同种的氢才可发在核磁共振中,一般来说,相邻碳上的不同种的氢才可发生偶合,相间碳上的氢(生偶合,相间碳上的氢(H-C-C-C-H)不易发生偶合,同种相)不易发生偶合,同种相邻氢也发生偶合(邻氢也发生偶合(Br2CHCHBr2)
54、。)。产生的原因:产生的原因: 相邻的磁相邻的磁不等性不等性H核自旋相互作用(即干扰)的结果。这核自旋相互作用(即干扰)的结果。这种原子核之间的相互作用,叫做自旋偶合。由自旋偶合引起种原子核之间的相互作用,叫做自旋偶合。由自旋偶合引起的谱线增多的现象,叫做自旋裂分。的谱线增多的现象,叫做自旋裂分。 偶合表示核的相互作用,核磁共振峰裂分多个谱线。偶合表示核的相互作用,核磁共振峰裂分多个谱线。产生的条件:产生的条件: 产生的结果:产生的结果: 以以CH3CH2I为例,讨论自旋偶合与自旋裂分作用:为例,讨论自旋偶合与自旋裂分作用: Ha的邻近的邻近CH2上有两个上有两个H核(以核(以Hb表示);表示
55、);Hb邻近的邻近的CH上有三个质子(上有三个质子(Ha););Hb和和Ha对各自核磁共振峰相互影响。对各自核磁共振峰相互影响。H核的自旋量子数核的自旋量子数I = 1/2,在磁场中可以有两种取向,即:,在磁场中可以有两种取向,即: + 1/2(以(以表示)和表示)和 1/2(以(以表示)表示) Hb的自旋取向的排布方式和对的自旋取向的排布方式和对Ha的影响。的影响。C CH Ha aH Ha aC CH Hb bH Hb bH Ha aI I Hb自旋自旋取向取向 两个两个Hb自旋取向自旋取向 Hb自旋磁场与自旋磁场与H0关系和对关系和对Ha的影响的影响 同理,也可画出同理,也可画出Ha对对
56、Hb的影响。的影响。 由此可见,裂分峰的数目有如下规律:由此可见,裂分峰的数目有如下规律: 峰的数目峰的数目 = n + 1 n:为相邻:为相邻H核的数目核的数目CHHHH0H=H02H/H=H0H/H/ = H0H=H0H/H0H/H=H02H/高度比大约为高度比大约为 1 :2 :1CHHH0高度比大约为高度比大约为 1 :3 :3 :1H=H03H/H=H0H/H=H0H/H=H03H/CH3CH2I4.2自旋分裂峰的数目自旋分裂峰的数目 邻近氢核之间的自旋偶合使峰产生裂分,裂分峰的数目邻近氢核之间的自旋偶合使峰产生裂分,裂分峰的数目及峰面积比具有一定的规律。及峰面积比具有一定的规律。(
57、1)自旋分裂峰的数目规律)自旋分裂峰的数目规律(n+1)规律)规律 适用范围:适用范围:相邻碳原子只有一种等质子。相邻碳原子只有一种等质子。 n 相邻等性质子数目相邻等性质子数目如:如:CH3 CH2 BrabHa 应裂分为:应裂分为:2+1=3 重峰重峰 Hb 应裂分为:应裂分为:3+1=4 重峰重峰(CH3)2CHClab Ha 应裂分为:应裂分为:1+1=2 重峰重峰 Hb 应裂分为:应裂分为:6+1=7 重峰重峰 (n+1)(n/ +1)(n/ +1)规律规律适用范围:适用范围:相邻碳原子上有几种不等性质子。相邻碳原子上有几种不等性质子。n、n/ 、n/ 分别为各不同质子数目分别为各不
58、同质子数目CH3CH2CH2ClabcHa 裂分为:裂分为:2+1=3 重峰重峰Hb 裂分为:裂分为:(3+1)(2+1)=12 重峰重峰Hc 裂分为:裂分为:2+1=3 重峰重峰Br CH2CHCH2CH3CH3abecdHa :1+1=2 重峰重峰Hb :1+1=2 重峰重峰Hc :(1+1)(3+1)=8 重峰重峰Hd :2+1=3 重峰重峰He :(2+1)(3+1)(2+1)=36 重峰重峰 活泼质子不参与自旋偶合活泼质子不参与自旋偶合CH3CH2OHabcHa :2+1=3 重峰重峰Hb :3+1=4重峰重峰Hc :单峰单峰 分裂的一组峰中各峰分裂的一组峰中各峰相对强度相对强度有一
59、定的规律,它们的峰有一定的规律,它们的峰面积比一般等于面积比一般等于二项式(二项式(a+b)m 的展开式各系数之比。的展开式各系数之比。1 1 11 2 11 3 3 11 4 6 4 1分裂峰数目分裂峰数目n峰比例峰比例峰形状峰形状O单峰单峰11双峰双峰1 :12三峰三峰1 :2 :13四峰四峰1 :3 :3 :1峰相对强度峰相对强度 峰的相对强度峰的相对强度 总结:核磁共振谱图提供关于有机分子结构的中氢质子信息总结:核磁共振谱图提供关于有机分子结构的中氢质子信息1. 由由吸收峰的组数,吸收峰的组数,可以判断有可以判断有几种不同类型的几种不同类型的H核;核; 2. 由由峰的化学位移峰的化学位
60、移(值),可以判断值),可以判断各类型各类型H所处的所处的化学环境;化学环境; 3. 由由峰的强度峰的强度(峰面积或积分曲线高度),可以判断(峰面积或积分曲线高度),可以判断各各类类H的相对数目;的相对数目; 4.由由峰的裂分数目,峰的裂分数目,可以判断可以判断相邻相邻H核的数目;核的数目; 5. 由由裂分峰的外形或偶合常数,裂分峰的外形或偶合常数,可以判断可以判断哪种类型哪种类型H是是相邻的。相邻的。 五、谱图分析应用五、谱图分析应用 NMR谱图谱图可以给出有机分子中不同环境氢核的信息。可以给出有机分子中不同环境氢核的信息。根据谱图中各峰的根据谱图中各峰的化学位移化学位移(值值);峰的);峰
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 忻州职业技术学院《司法文书研习》2023-2024学年第二学期期末试卷
- 通化医药健康职业学院《经典影片鉴赏》2023-2024学年第二学期期末试卷
- 预防侵性主题班会
- 东北财经大学《文献检索与科技创新》2023-2024学年第一学期期末试卷
- 四川省遂宁市射洪中学2025年高考考前冲刺必刷卷(一)生物试题含解析
- 江西洪州职业学院《湖南地方民间舞》2023-2024学年第一学期期末试卷
- 幼儿园档案工作
- 2025年湘西市重点中学高三4月考-物理试题试卷含解析
- 深圳北理莫斯科大学《食品环境学(实验)》2023-2024学年第二学期期末试卷
- 山东省昌乐博闻学校2024-2025学年高考化学试题原创模拟卷(三)含解析
- 《文创灯具设计(论文)》
- 2023年浙江二造《建设工程计量与计价实务(土木建筑)》考试重点题库200题(含解析)
- 信管家风控实战
- 公路工程各主要试验检测项目
- 团队建设(破冰活动)精编版课件
- 岩石性质及其工程分级课件
- 化工仪表自动化-压力仪表培训课件
- 老年人泌尿系统疾病课件
- 四年级道德与法治(下册)第一单元同伴与交往单元测试卷-(含答案)
- 苏教版三年级(下)科学第一单元植物的一生质量测试卷(一)含答案
- 土壤铵态氮的测定

评论
0/150
提交评论