



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、 电解质溶液是高中化学化学重要的基础理电解质溶液是高中化学化学重要的基础理论之一,而电解质溶液中离子浓度大小比较专论之一,而电解质溶液中离子浓度大小比较专题考查的知识点多,灵活性、综合性较强,有题考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、电解质、电离平衡、水的电离、pH值、离子反值、离子反应、盐类水解等基本概念的掌握程度及对这些应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。而对于高二学生此专题知识的综合运用能力。而对于高二学生此专题是难点之一,但高考化学试卷年年涉及这种题是难点
2、之一,但高考化学试卷年年涉及这种题型,重视率高。因此要关注此类试题归类解析型,重视率高。因此要关注此类试题归类解析及与电解质溶液相关理论的结合。此文有很多及与电解质溶液相关理论的结合。此文有很多不足之处,望各位同仁批评指正。不足之处,望各位同仁批评指正。本专题的地位和作用:本专题的地位和作用:【一、关注三个守恒】【一、关注三个守恒】电解质溶液中的离子之间存在之三种定量关系电解质溶液中的离子之间存在之三种定量关系1电荷数平衡关系电荷数平衡关系-电荷守恒电荷守恒 :电解质溶液中所有阳电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷离子所带有的正电荷数与所有的阴离子所带的负电荷数相等
3、。数相等。 如如Na2CO3溶液中推出推出: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)2微粒数平衡关系微粒数平衡关系-物料守恒物料守恒 :电解质溶液中由电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如总数是不会改变的。如Na2CO3溶液中溶液中n(Na):n(c)2:1,推出:,推出: c (Na+) =2 c (H2CO3) + c (HCO3-) + c(CO32-) 3 3水电离的离子数平衡关
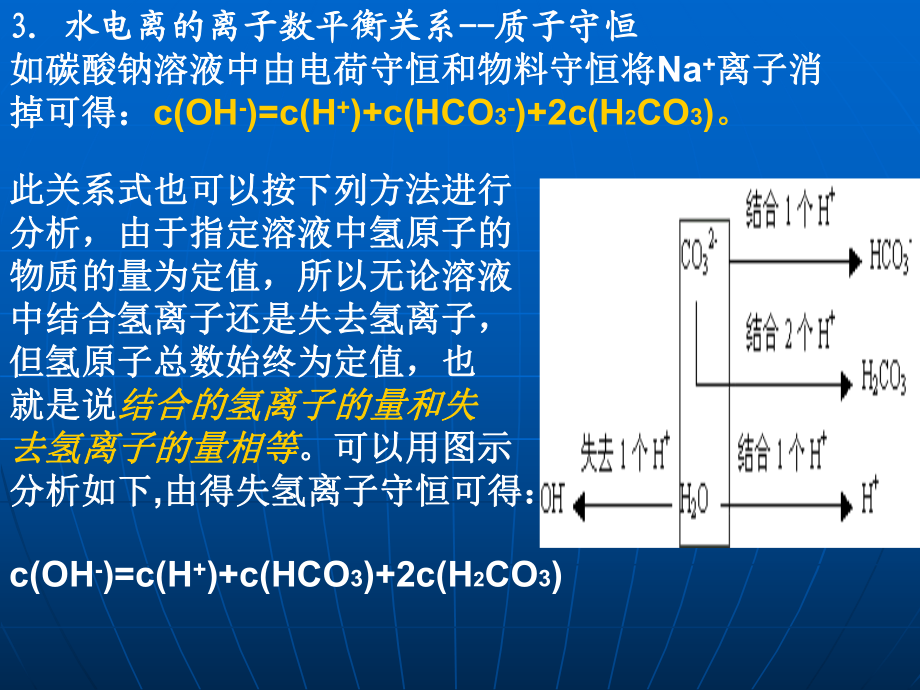
4、系水电离的离子数平衡关系-质子守恒质子守恒如碳酸钠溶液中由电荷守恒和物料守恒将如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消离子消掉可得:掉可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。此关系式也可以按下列方法进行此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也但氢原子总数始终为定值,也就是说就是说结合的氢离子的量和失结合的氢离子的量和失去氢离子的量相等去氢离子的量相等。可以用图示。可以用图示分析
5、如下分析如下,由得失氢离子守恒可得:由得失氢离子守恒可得: c(OH-)=c(H+)+c(HCO3)+2c(H2CO3)【二、解析常见题型及相关的基础理论】【二、解析常见题型及相关的基础理论】1、溶质单一型溶质单一型 【解题思路】酸、碱溶液主要考虑酸、碱电离【解题思路】酸、碱溶液主要考虑酸、碱电离 盐溶液主要考虑盐水解盐溶液主要考虑盐水解 .弱碱、弱酸溶液弱碱、弱酸溶液【相关理论】【相关理论】1.弱电解质的电离是弱电解质的电离是微弱微弱的,电离消耗的的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;离的存在;2.多元弱酸的电
6、离是分步的,主要以多元弱酸的电离是分步的,主要以第一步第一步电离为主电离为主。 弱碱溶液弱碱溶液【例【例1】室温下,】室温下,0.1mol/L的氨水溶液中,下列关系式中的氨水溶液中,下列关系式中不正确的是(不正确的是( )A. c(OH-)c(H+) B.c(NH3H2O)+c(NH4+)=0.1mol/L C.c(NH4+)c(NH3H2O)c(OH-)c(H+) D.c(OH-)=c(NH4+)+c(H+)【解析解析】:由于在:由于在NH3H2O溶液中存在下列电离平衡:溶液中存在下列电离平衡:NH3H2O NH4+OH-,H2O H+OH-,所以溶液中微,所以溶液中微粒浓度关系为:粒浓度关
7、系为:c(NH3H2O)c(OH-)c(NH4+)c(H+)。所以所得溶液呈碱性,根据电荷守恒和物料守恒知所以所得溶液呈碱性,根据电荷守恒和物料守恒知BD正正确,而一水合氨的电离是微量的,所以确,而一水合氨的电离是微量的,所以C项错误项错误 。多元弱酸多元弱酸【例【例2】在】在0.1mol/L的的H2S溶液中,下列关系错误的是(溶液中,下列关系错误的是( ) A.c(H+)=c(HS-)+c(S2-)+c(OH-) B.c(H+)=c(HS-)+2c(S2-)+c(OH-) C.c(H+)c(HS-)+c(S2-)+c(OH-) D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
8、【解析解析】解答这类题目主要抓住弱酸的电离平衡,由于解答这类题目主要抓住弱酸的电离平衡,由于H2S溶液中存在下列平衡:溶液中存在下列平衡:H2S HS-+H+, HS- S2-+H+,H2O H+OH-,所以溶液中微粒浓度关系为:,所以溶液中微粒浓度关系为:c(H2S )c(H+)c(HS-)c(OH-)。根据电荷守恒得。根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得,由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是,所以关系式错误的是A项。项。【答案答案】A3.盐溶液【相关理论】【相关理论】-水解理论水解理论弱酸的
9、阴离子和弱碱的阳离子因水解而损耗;如弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:溶液中有:c(Na+)c(HCO3-)。弱酸的阴离子和弱碱的阳离子的水解是微量的(双水弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生解除外),因此水解生成的弱电解质及产生H+的(或的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以的存在,所以水解后的酸性溶液中水解后的酸性溶液中c(H+)(或碱性溶液中(或碱性溶液中的的c(OH-))总是大于水解产生的弱电解质的浓度)总是大于水解产生的弱电解质的浓度
10、.一般来说一般来说“谁弱谁水解,谁强显谁性谁弱谁水解,谁强显谁性”,如水解呈酸,如水解呈酸性的溶液中性的溶液中c(H+)c(OH-),水解呈碱性的溶液中,水解呈碱性的溶液中c(OH-)c(H+);多元弱酸的酸根离子的水解是分步进行的,多元弱酸的酸根离子的水解是分步进行的,主要主要以第一步水解为主以第一步水解为主。强酸弱碱盐溶液:强酸弱碱盐溶液:【例【例3】在氯化铵溶液中,下列关系正确的是(】在氯化铵溶液中,下列关系正确的是()A.c(Cl-)c(NH4+)c(H+)c(OH-)B.c(NH4+)c(Cl-)c(H+)c(OH-)C.c(NH4+)c(Cl-)c(H+)c(OH-)D.c(Cl-
11、)c(NH4+)c(H+)c(OH-)【解析】由于氯化铵溶液中存在下列电离过程:【解析】由于氯化铵溶液中存在下列电离过程:NH4Cl=NH4+Cl-,H2OH+OH-和水解过程:和水解过程:NH4+H2OH+NH3H2O,由于铵离子水解被消耗,所以,由于铵离子水解被消耗,所以c(Cl-)c(NH4+),又因水解后溶液显酸性,所以,又因水解后溶液显酸性,所以c(H+)c(OH-),且水解是微量的,所以上述关系式正确的是且水解是微量的,所以上述关系式正确的是A项。项。【答案】【答案】A强碱弱酸的酸式盐溶液:强碱弱酸的酸式盐溶液:【例例4】草酸是二元弱酸,草酸氢钾溶液呈酸性,在草酸是二元弱酸,草酸氢
12、钾溶液呈酸性,在0.1mol/LKHC0.1mol/LKHC2 2O O4 4溶液中,下列关系正确的是(溶液中,下列关系正确的是( )A Ac c(K(K+ +)+)+c c(H(H+ +)=)=c c(HC(HC2 2O O4 4- -)+)+c c(OH(OH- -)+)+ c c(C(C2 2O O4 42-2-) )B Bc c(HC(HC2 2O O4 4- -)+)+ c c(C(C2 2O O4 42-2-)=0.1mol/L)=0.1mol/LC Cc c(C(C2 2O O4 42-2-) )c c(H(H2 2C C2 2O O4 4) )D Dc c(K(K+ +)=)=
13、 c c(H(H2 2C C2 2O O4 4)+)+ c c(HC(HC2 2O O4 4- -)+)+ c c(C(C2 2O O4 42-2-) )【解析解析】因为草酸氢钾呈酸性,所以因为草酸氢钾呈酸性,所以HCHC2 2O O4 4- -电离程度大于水解程电离程度大于水解程度,故度,故c c(C(C2 2O O4 42-2-) )c c(H(H2 2C C2 2O O4 4) )。又依据物料平衡,所以。又依据物料平衡,所以D Dc c(K(K+ +)=)= c c(H(H2 2C C2 2O O4 4)+)+ c c(HC(HC2 2O O4 4- -)+)+ c c(C(C2 2O
14、O4 42-2-) )正确,又根据电荷守恒,正确,又根据电荷守恒,c c(K(K+ +)+)+c c(H(H+ +)=)=c c(HC(HC2 2O O4 4- -)+)+c c(OH(OH- -)+2)+2c c(C(C2 2O O4 42-2-) ),所以。综合上述,所以。综合上述,C C、D D正确。正确。【答案】【答案】CD2 2、两种电解质溶液混合后离子浓度大小的比较、两种电解质溶液混合后离子浓度大小的比较 【解题思路解题思路】1、两种物质混合不反应、两种物质混合不反应-同时考虑水解和电离哪占主要同时考虑水解和电离哪占主要【例】用物质的量都是【例】用物质的量都是0.1 mol0.1
15、mol的的CHCH3 3COOHCOOH和和CHCH3 3COONaCOONa配制成配制成1L1L混混合溶液,已知其中合溶液,已知其中C(CHC(CH3 3COOCOO- -) )C(NaC(Na+ +) ),对该混合溶液的下列判,对该混合溶液的下列判断正确的是断正确的是( )( )A.C(HA.C(H+ +) )C(OHC(OH- -) ) B.C(CHB.C(CH3 3COOH)COOH)C(CHC(CH3 3COOCOO- -) )0.2 mol/L0.2 mol/LC.C(CHC.C(CH3 3COOH)COOH)C(CHC(CH3 3COOCOO- -) ) D.C(CHD.C(CH
16、3 3COOCOO- -) )C(OHC(OH- -) )0.2 mol/L0.2 mol/L【解析】【解析】 CHCH3 3COOHCOOH和和CHCH3 3COONaCOONa的混合溶液中,的混合溶液中,CHCH3 3COOHCOOH的电离和的电离和CHCH3 3COONaCOONa的水解因素同时存在。已知的水解因素同时存在。已知C(CHC(CH3 3COOCOO- -) )C(NaC(Na+ +) ),根据电,根据电荷守恒荷守恒C(CHC(CH3 3COOCOO- -) )C(OHC(OH- -) )C(NaC(Na+ +) )C(HC(H+ +) ),可得出,可得出C(OHC(OH-
17、-) )C(HC(H+ +) )。说明混合溶液呈酸性,进一步推测出说明混合溶液呈酸性,进一步推测出0.1mol/L0.1mol/L的的CHCH3 3COOHCOOH和和0.1mol/L0.1mol/L的的CHCH3 3COONaCOONa溶液中,电离和水解这一对矛盾中起主要作用溶液中,电离和水解这一对矛盾中起主要作用是电离,即是电离,即CHCH3 3COOHCOOH的电离趋势大于的电离趋势大于CHCH3 3COOCOO- -的水解趋势。根据物料的水解趋势。根据物料守恒,可推出(守恒,可推出(B B)是正确的。)是正确的。常见的以电离为主的(同浓度混合)常见的以电离为主的(同浓度混合)1、氯化铵
18、和氨水、氯化铵和氨水2、醋酸钠和醋酸、醋酸钠和醋酸常见的以水解为主的常见的以水解为主的1.氰酸钠与氰酸氰酸钠与氰酸2、两种物质恰好完全反应、两种物质恰好完全反应-等同于单一溶质,等同于单一溶质, 故与题型故与题型1方法相同方法相同【例】在【例】在10ml 0.1mol10ml 0.1molL L-1-1NaOHNaOH溶液中加入同体积、同浓度溶液中加入同体积、同浓度HAcHAc溶液,溶液,反应后溶液中各微粒的浓度关系错误的是反应后溶液中各微粒的浓度关系错误的是( )( )。A Ac c(Na(Na+ +) )c c(Ac(Ac- -) )c c(H(H+ +) )c c(OH(OH- -) )
19、B Bc c(Na(Na+ +) )c c(Ac(Ac- -) )c c(OH(OH- -) )c c(H(H+ +) )C Cc c(Na(Na+ +) )c c(Ac(Ac- -) )c c(HAC)(HAC)D Dc c(Na(Na+ +) )c c(H(H+ +) )c c(Ac(Ac- -) )c c(OH(OH- -) )【解析】由于混合的【解析】由于混合的NaOHNaOH与与HAcHAc物质的量都为物质的量都为1 11010-3-3molmol,两者恰,两者恰好反应生成好反应生成NaAcNaAc,由于少量,由于少量AcAc- -发生水解:发生水解:AcAc- - + H + H2
20、 2O O HAc+ OH HAc+ OH-,-,故有故有c c(Na(Na+ +) )c c(Ac(Ac- -) )c c(OH(OH- -) )c c(H(H+ +) ),根据物料守恒,根据物料守恒C C正确,根据电荷守恒正确,根据电荷守恒D D正确,正确,A A错误。故该题选项为错误。故该题选项为A A。3、两种物质反应,其中一种有剩余两种物质反应,其中一种有剩余:(1)酸与碱反应型)酸与碱反应型- 关注题中所给数据是物质的量浓关注题中所给数据是物质的量浓度还是度还是pH【注意】【注意】此类题目若有酸、碱过量时,应抓住两溶液混合此类题目若有酸、碱过量时,应抓住两溶液混合后剩余的弱酸或弱碱
21、的电离程度和生成盐的水解程度的相后剩余的弱酸或弱碱的电离程度和生成盐的水解程度的相对大小。对大小。【例【例1】 将将0.2molL1HCN溶液和溶液和0.1molL1的的NaOH溶液等体积混合后,溶液显碱性,下列关溶液等体积混合后,溶液显碱性,下列关系式中正确的是系式中正确的是 A.c(HCN)c(CN)C.c(HCN)c(CN)c(OH) D. c(HCN)c(CN)0.1molL1 【解析】上述溶液混合后,溶质为【解析】上述溶液混合后,溶质为HCN和和NaCN,由于该题已说明,由于该题已说明溶液显碱性,所以不能再按照溶液显碱性,所以不能再按照HCN的电离处理,而应按的电离处理,而应按NaC
22、N水解水解为主。所以为主。所以c(Na)c(CN),选,选B D【答案】【答案】B D【例【例2】 设氨水的设氨水的pHx,某盐酸的,某盐酸的pHy,已知,已知x+y14,且,且x11。将上述两溶液分别取等体积充。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺分混合后,所得溶液中各离子浓度由大到小的顺序是序是A.c(Cl)c(NH4+)c(H+)c(OH) B. B. c(NH4+)c(Cl)c(H+)c(OH)C. c(NH4+)c(Cl)c(OH)c(H+) D. c(Cl)c(NH4+)c(OH)c(H+)【解析】由于【解析】由于x+y14,且,且x11,所以氨水,所以氨水c(OH-)和盐和盐酸中的酸中的c(H+)相等。两者等体积混合后,氨水过量,溶液显相等。两者等体积混合后,氨水过量,溶液显碱性。碱性。【答案】【答案】C4 4、其他类型、其他类型不同物质同种离子浓度比较型不同物质同种离子浓度比较型-要看溶液中其它离要看溶液中其它离子对其的影响子对其的影响【例】物质的量浓度相同的下列溶液中,【例】物质的量浓度相同的下列溶液中,NHNH4 4+ +浓度浓度最大的是(最大的是( )。)。A ANHNH4 4Cl BCl BNHNH4 4HSOHSO4 4
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 二零二五年淘宝商家入驻市场准入合同
- 2025年度金融科技行业员工劳动合同
- 二零二五年度法人对公司借款及利息支付合同
- 二零二五年度退房设施设备检查合同
- 二零二五年度木地板出口退税与关税优惠合同
- 二零二五年度城市道路改造混凝土运输合作协议
- 2025年度高端住宅装修终止合同协议书
- 2025年度诊所托管与医疗质量监控合同
- 二零二五年度砼班组劳务承包及进度管理合同
- 2025年度绿色餐厅合作发展协议书
- 预防性侵安全教育课件
- 《钢铁是怎样炼成的》读书分享课件
- 颈椎损伤的固定与搬运操作流程课件
- 中国戏曲 昆曲学习通超星期末考试答案章节答案2024年
- 消毒隔离课件教学课件
- 中国旅游地理项目一二测试题
- 涉外法治视角下国际经贸规则形成研究
- 低空经济公司的投融资方案
- 城市停车规划规范
- 2022年集团消防技能比赛项目、规则和评分标准
- 手机维修行业中的数字转型

评论
0/150
提交评论