
下载本文档
版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、章末再考真题演练1.(2017 天津高考) )常压下羰基化法精炼镍的原理为: Ni(s) + 4C0(g)Ni(C0) )4( (g)。230C时,该反应的平衡常数 K= 2X105。 已知:Ni(C0) )4的沸点为 42.2C,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO) )4;第二阶段:将第一阶段反应后的气体分离出来, 加热至 230C制 得高纯镍。下列判断正确的是( () )A. 增加 c(CO),平衡向正向移动,反应的平衡常数增大B. 第一阶段,在 30C和 50C两者之间选择反应温度,选 50CC .第二阶段,Ni(CO) )4分解率较低D .该反应达
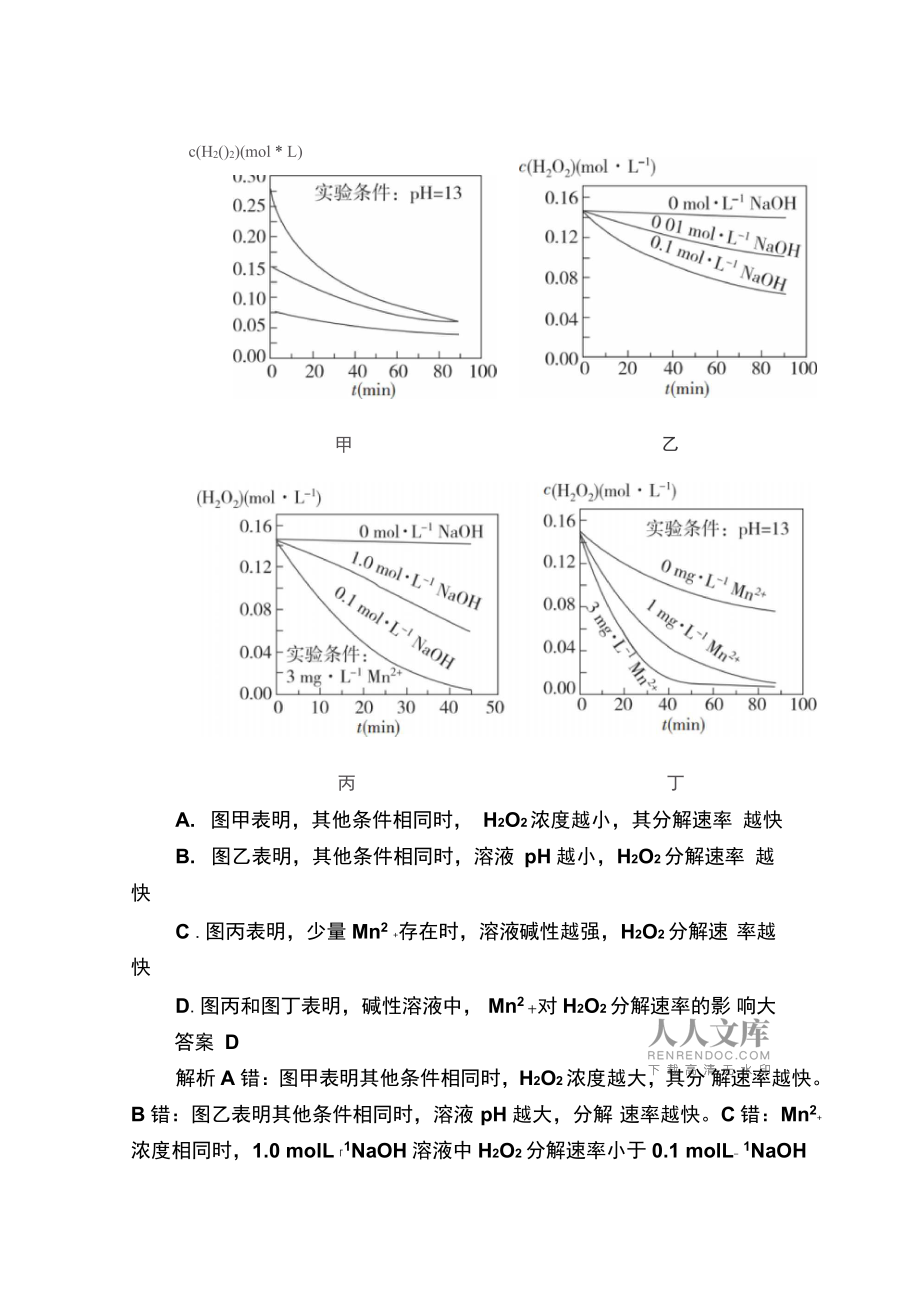
2、到平衡时,v生成Ni(CO)4 = 4v生成(CO)答案 B解析 A 错:增加 c(CO),平衡正向移动,温度不变,反应的平 衡常数不变。B 对:第一阶段,生成的 Ni(CO)4是气态,应选择高于 其沸点的反应温度,故选 50C。C 错:230C时,化学平衡常数 K =2X10-5,有利于反应逆向进行,Ni(CO) )4分解率较高。D 错:反应 达到平衡时, 4v生成Ni(CO)4 =v生成(CO)。2.(2017 江苏高考阳2。2分解速率受多种因素影响。实验测得70C时不同条件下 H2O2浓度随时间的变化如图所示。下列说法正确 的是( () )A. 图甲表明,其他条件相同时, H2O2浓度越
3、小,其分解速率 越快B. 图乙表明,其他条件相同时,溶液 pH 越小,H2O2分解速率 越快C .图丙表明,少量 Mn2+存在时,溶液碱性越强,H2O2分解速 率越快D.图丙和图丁表明,碱性溶液中, Mn2十对 H2O2分解速率的影 响大答案 D解析 A 错:图甲表明其他条件相同时,H2O2浓度越大,其分 解速率越快。B 错:图乙表明其他条件相同时,溶液 pH 越大,分解 速率越快。C 错:Mn2+浓度相同时,1.0 molL1NaOH 溶液中 H2O2分解速率小于 0.1 molL-1NaOHc(H2()2)(mol * L)乙甲丙丁溶液中。D 对:pH 相同时,Mn2+浓度越大,分解速率越
4、快,所以图丙和图丁表明,碱性溶液中, Mn2十对 H2O2分解速率影响大。3. (2017 江苏高考)(双选)温度为时,在三个容积均为 1 L 的 恒容密闭容器中仅发生反应:2NO2( (g)2NO(g) + O2( (g)(正反应吸热) )。实验测得:v正=v(NO2)消耗=k正c2(NO2), v逆=v(NO)消耗=2v(O2)消耗= k逆c2(NO)c(O2), k正、k逆为速率常数,受温度影响。下列说法 正确的是( () )容器编号物质的起始浓度(mol* L1)物质的平衡浓度(mol L)f(NO2)c(NO)r(O2)c(O2)(X 6000. 2n0. 30. 50. 2m00.
5、 50. 35JA .达平衡时,容器I与容器H中的总压强之比为4 : 5B.达平衡时,容器u中 cNO;比容器1中的大C .达平衡时,容器皿中 NO 的体积分数小于 50%D .当温度改变为 T2时,若 k正=k逆,则 T2T1答案 CD解析 A 错:容器I中:2NO2(g)2NO(g) + O2( (g)起始 /mol L10.6001转化/mol L0.40.40.2平衡 /mol L-10.20.40.2容器I中达到平衡时总物质的量为 0 2 mol+ 0.4 mol + 0.2 mol=0.8 mol,容器H中起始总物质的量为 0.3 mol + 0.5 mol + 0.2 mol=
6、1 mol,因为该反应反应前后气体分子数不相等,则达到平衡时,总物 质的量不为 1mol,则容器I与容器II中的总压强之比不等于 4 : 5。B 错:根据等效平衡,容器I中的投料比可转化为:2NO2( (g)2NO(g) +。血。血起始 /mol L-10.30.50.2转化后 /mol L0.60.20.05所以平衡逆向移动,C( (NO2) )增大,c( (02) )减小,所以容器i中 cNOr 比容器I中的小。C 对:根据等效平衡,容器皿中的投料比可转化为:2NO2( (g)2NO(g)+ O2( (g)起始 /mol L_100.5 0.35转化后 /mol L_10.500.1容器I
7、中达到平衡时 NO 的体积分数等于 50% ,容器皿中。2抑 制反应向右进行,所以 NO 的体积分数小于 50%。D 对:由题中关 系式v正=v(NO2)消耗=k正c2(NO2), v逆=v(NO)消耗=2v(02)消耗=k逆2v NO2消耗C2(NO)C(O*可得,k正=c2N02, k逆v NO2消耗v NO消耗- =c2NO cO2。反应达到平衡时v(N2) )2消耗=v(NO)消耗,贝yC2(NO2) )= c2(NO) c(O2)。温度时,K=C C呎復0202c ( NO2)=4 尹=0.8,温度 T2时,K=c c畀022= 正反应为吸热反应,所以 T2 T1。4. (2016
8、北京高考) )下列食品添加剂中,其使用目的与反应速率 有关的是( () )A .抗氧化剂C .着色剂D .增稠剂=c2NO cO2,当温度改变为T2时,k正= k逆,即 c2NO21,平衡常数增大,B.调味剂答案 A解析 相对于食物,抗氧化剂可以更快地被氧气氧化,从而降低 了包装袋中氧气的浓度,减缓食品被氧化的速率。5. (2016 江苏高考)(双选)一定温度下,在 3 个体积均为 1.0 L 的 恒容密闭容器中反应 2 出 9)+ CO(g) CHsOH(g)达到平衡。下列 说法正确的是( ( ) )容器温度/K物质的起始浓度/mol - L1物质的平衡浓度/mol L_JC(H2)c(CO
9、)C(CH3()H)T4000. 200. 1000* 080II400(X 400. 200500000. 100. 025A .该反应的正反应放热B. 达到平衡时,容器I中反应物转化率比容器H中的大C. 达到平衡时,容器H中 c(H2)大于容器皿中 c(H2)的两倍D .达到平衡时,容器皿中的正反应速率比容器I中的大答案 AD解析 A 项,若反应皿的温度为 400C,则反应I和反应皿达到 的平衡为等效平衡, 而反应皿的实际温度为 500C,500C时 CH3OH 的平衡浓度比 400C时的小,说明升高温度后,平衡逆向移动,故正 反应为放热反应,正确;B 项,反应H相当于给反应I加压,加压时
10、, 平衡正向移动,故容器H中反应物的转化率大,错误;C 项,由表中 数据知,达到平衡时,可求得容器I中 c(H2) )=0.04 molL-1,可推知 容器II中C(H2) )0.08 mol L,容器 皿中 c(H2)= 0 15mol L,平衡 时,I中厲出)小于容器皿中 c(H2)的两倍,错误;D 项,浓度相同, 容器皿中的温度高,所以容器皿中正反应速率大于容器I中的,正确。6.(2016 天津高考)()(双选)在恒温恒容的密闭容器中,某储氢反应:MHs)+ yH2(g) MHx+2y(s) 出0 达到化学平衡。下列有关叙述正确的是()A .容器内气体压强保持不变B. 吸收 y mol
11、H2只需 1 mol MHxC. 若降温,该反应的平衡常数增大D .若向容器内通入少量氢气,则 v 倣氢) v (吸氢)答案 AC解析 达到化学平衡时,气体的物质的量不变,所以容器内气体 压强保持不变,A 项正确;由于该反应是可逆反应,所以吸收ymol H2所需的 MHx的物质的量大于 1 mol, B 项错误;该反应的平衡常数表1达式为 K =-yr ,由于该反应是放热反应,降低温度,平衡向正反 c (出)应方向移动,c(H2)减小,故 K 增大,C 项正确;向容器内通入少量 氢气,平衡向正反应方向移动,v(正)v(逆),即v(吸氢)v(放氢),D 项错误。7.(2015 天津高考)某温度下
12、,在 2 L 的密闭容器中,加入 1 molX(g)和 2 mol Y(g)发生反应:X(g) + mY(g) 3Z(g),平衡时,X、丫、Z 的体积分数分别为 30%、 60%、 10%。 在此平衡体系中加入 1 mol Z (g) ,再次达到平衡后,X、Y、Z 的体积分数不变。下列叙述不正 确的是()A. m= 2B. 两次平衡的平衡常数相同C. X 与 Y 的平衡转化率之比为 1 : 1D .第二次平衡时,Z 的浓度为 0.4 mol Lr 1答案 D解析 在原平衡体系中加入 1 mol Z,再次达到平衡后,X、Y、 Z 的体积分数不变,说明该平衡与原平衡是等效平衡,则化学方程式 两边气
13、态物质的化学计量数相等,即 m= 2, A 项正确;温度不变, 平衡常数不变,B 项正确;起始时 X、Y 的物质的量之比等于化学计量数之比, 则二者的平衡转化率相等,C 项正确; 起始时加入 1 mol X 和 2 molY,相当于 3 mol Z,平衡时 Z 的物质的量为 3 molx10% =0 3 mol,在平衡体系中再加入 1 mol乙乙相当于起始时共加入 4 mol乙乙则新平衡时 Z 的物质的量为4 molx10% = 0.4 mol,其浓度为 0 4 mol/2 L= 0.2 mol L-1, D 项错误。8. (2015 上海高考)对于合成氨反应,达到平衡后,以下分析正 确的是(
14、)A .升高温度,对正反应的反应速率影响更大B.增大压强,对正反应的反应速率影响更大C .减小反应物浓度,对逆反应的反应速率影响更大D .加入催化剂,对逆反应的反应速率影响更大答案 B解析 A 项,合成氨为放热反应,升高温度对吸热反应的影响更大,即对逆反应的反应速率影响更大,错误;B 项,增大压强对气体体积大的影响更大,所以增大压强对正反应的反应速率影响更大,正确;C 项,减小反应物浓度正反应速率减小,而逆反应速率不变,错 误;D 项,催化剂会同等程度地影响正、逆反应速率,错误。9 . (2015 安徽高考)汽车尾气中 NO 产生的反应为:N2(g) +O2(g) 2NO(g)。一定条件下,等
15、物质的量的 N2(g)和 0 的)在恒容 密闭容器中反应,如图曲线 a 表示该反应在温度 T 下 N2的浓度随时 间的变化,曲线 b 表示该反应在某一起始反应条件改变时 N2的浓度随时间的变化()2B.温度 T 下,随着反应的进行,混合气体的密度减小C .曲线 b 对应的条件改变可能是加入了催化剂D .若曲线 b 对应的条件改变是温度,可判断该反应的出0。10.(福建高考)在一定条件下,N2O 分解的部分实验数据如下:反应时 间 /min0102030405060708090100t(N2O)/mol 1厂10. 1000.090 0,080 0.070 0.060 0.050 0. 040
16、0. 030 6 020 0.0106 000J下图能正确表示该反应有关物理量变化规律的是( () )(注:图中半衰期指任一浓度 N2O 消耗一半时所需的相应时间,01、02均表示 N2O 初始浓度且 G”“ = ”)3向反应器中再分别充入下列气体,能使H?S 转化率增大的是(填标号)A. H2S B. CO2C. COS D. N2(2)(全国卷皿)298 K 时,将 20 mL 3x mol L NasAsOs、20 mL 3xmol L I2和 20 mL NaOH 溶液混合, 发生反应:AsO;(aq) + 12( (aq) + 2OH(aq) AsO;_(aq)+2(aq)+出 0(
17、1)。溶液中 c(AsO4)与反 应时间(t)的关系如图所示。1下列可判断反应达到平衡的是 _ 填标号)。a. 溶液的 pH 不再变化b. v() = 2v(AsO;_)c. c(AsO4_)/c(AsO;_)不再变化 1d. c(I ) = y mol L2tm时,V正_V逆(填“大于” “小于”或“等于”) )。3tm时V逆tn时V逆(填“大于” “小于”或“等于”),理由是。4_若平衡时溶液的 pH = 14,则该反应的平衡常数 K 为_ B(2)ac大于小于 tm时生成物浓度较低4y2( (mol L1)1x y、解析( (1)解:设平衡时 H?S 转化的物质的量为 X。H2S(g)+
18、 COCOS(g) + H2O(g)初始/mol0.400.1000转化/molXxxx平衡/mol0.40 x 0.10 xxx由题意得:x/tnin0.40 mol x + 0.10 mol x + x + x0. 023解得:x= 0.01 mol2温 度升高,水的平衡物质的量分数增大,平衡右移,则H2S的转化率增大,故a2a。温度升高,平衡向吸热反应方向移动,故3A 项,充入 H2S, H2S 的转化率反而减小。B 项,充入 CO2, 增大了一种反应物的浓度,能够提高另一种反应物的转化率, 故 H2S 的转化率增大。C 项,充入 COS,平衡左移,H?S 的转化率减小。D 项,充入 N
19、2,对平衡无影响,不改变 H2S 的转化率。(2)a 对:溶液 pH 不变时,则 c(OH)也保持不变,反应处于 平衡状态。B 错:根据反应方程式,始终存在速率关系:v (I) _2v(ASO3),反应不一定处于平衡状态。C 对:由于 Na3AsO3总量一定, 当C(ASO4)/C(ASO3)不再变化时, c(AsO3)、C(ASO3)也保持不 变,反应建立平衡。 D 错: 由图可知, 建立平衡时 c(I)_2C(AS&) _2y mol L1,因此 c(I)_y mol L1时,反应没有建立平衡。2tm时,反应正向进行,故V正大于V逆。3由于 tm时生成物 ASO4的浓度小于 tn时ASO3
20、的浓度,因V逆的大小取决于生成物浓度的大小,故 tm时的 V逆小于 tn时的 V逆。反应前,三种溶液混合后,c(Na3AsO3) _ 3x mol LH2S 的平衡转化率0.01 mol0.40 molx100% =2.5%K=c(COS)C(H2O)_ c H2S c CO20.01x0.01U 2.510.400.01250.10 0.01 _351252.8X103应情况如下:1x20 mL20 mL + 20 mL + 20 mLx mol L1,同理,1匕c(l2)_x mol L ,反As(旳)+b (nq) 2(旧(aq As( (atp +21 (nq) 起始侬度/ mol L
21、_平衡浓度/mol - L_1K=o(jry)(h y)X 112. (2016 全国卷H)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛( (CH2=CHCHO)和乙腈(CH3CN)等。回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈( (C3H3N) 和副产物丙烯醛(C3H4O)的热化学方程式如下:C3H6( (g)+ NH3( (g)+3O2(g)=C3H3N(g)+ 3H2O(g)-1出=515 kJ mol C3H6( (g)+ O2( (g)=C3H40(g) + H2O353 kJ mol两个反应在热力学上趋
22、势均很大,其原因是_;有利于提高丙烯腈平衡产率的反应条件是 ;提高丙烯腈反应选择性的关键因素是(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的 温度为 460C。低于 460C时,丙烯腈的产率 _傾“是”或“不是”) )对应温度下的平衡产率,判断理由是 _ ;高于460C时,丙烯腈产率降低的可能原因是 _ 双选,填标号) )。A .催化剂活性降低B.平衡常数变大C .副反应增多D .反应活化能增大jrpV(2y)2(mol厂Ji(3)丙烯腈和丙烯醛的产率与 n(氨)/n(丙烯)的关系如图(b)所示。 由图可知,最佳 n(氨”n(丙烯) )约为_ ,理由是_ 进料气氨、 空气、丙烯
23、的理论体积比约为 _ 。答案( (1)两个反应均为放热量大的反应降低温度、降低压强催化剂(2) 不是该反应为放热反应,平衡产率应随温度升高而降低AC(3) 1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低1 : 7.5:1解析( (1)判断反应自发进行的趋势可从熵变和焓变两方面考虑,反应和的熵变不大,但焓变均较大,这是导致两个反应在热 力学上趋势均很大的主要原因。根据影响平衡移动的因素可知,提高 丙烯腈平衡产率( (即使反应的平衡右移) )的条件可以是降低温度、降 低压强。不同的反应一般使用的催化剂也不同,因此催化剂是提高丙烯腈反应选择性的关键因素。(2) 丙烯腈产率降低的原因可能是催化剂的
24、活性降低、副反应增多,A、C 正确。(3) 由反应可知 n(NH3) ): n(O2) ): n(C3H6) )= 1 : 1 5 : 1,由于。2O.X0.0丙烯HS/XX、t/v图(a)O+6槪(14a 1)A(16 O.X 1.0 L2 n(氨“腻内烯图(h)1在空气中所占体积分数约为1所以理论上进料气氨、空气、丙烯的5体积比 V(NH3) ): V(空气):V(C3H6) )= 1 : (1 5X5) : 1 = 1 : 7.5 : 1O13. (1)(2015 全国卷 叮甲醇既是重要的化工原料,又可作为燃 料。利用合成气( (主要成分为 CO、CO2和 H2) )在催化剂作用下合成甲
25、 醇,发生的主要反应如下:1CO(g) + 2H2(g)2CO2( (g) + 3 出 9)3CO2( (g) + 出 9)回答下列问题:-1CH3OH(g) AH1=-99 kJ molCH3OH(g) + H20(g) ZH2= 58 kJ mol-1CO(g) + H2O(g) H3= + 41 kJ mol反应的化学平衡常数 K 表达式为_;图 1 中能正确反映平衡常数 K 随温度变化关系的曲线为 _ 填曲 线标记字母) ),其判断理由是 _ 。合成气组成 n(H2) )/n(CO + CO2) = 2.60 时,体系中的 CO 平衡转化率( (a与温度和压强的关系如图 2 所示。a(
26、CO 值随温度升高而_(填“增大”或“减小”) ),其原因是_;图2 中的压强由大到小为 _ ,其判断理由是 _。(2)(2015 广东高考) )用 02将 HCI 转化为 C12,可提高效益,减少 污染。新型RUO2催化剂对上述 HCI 转化为 CI2的总反应具有更好的 催化活性。a.实验测得在一定压强下,总反应的 HCI 平衡转化率随温度变 化的aciT 曲线如图,则总反应的出_0 填”或*KML启H、 )衍(: 0+(:他)=2.60呂 -:-厂亠1500510520510500 510 520 530 540 550 HK图2O“ v” ;)A、B 两点的平衡常数 K(A)与 K(B)中较大的是b.在上述实验中若压缩体积使压强增大,画出相应 的示意图,并简要说明理由:_。C.下列措施中,有利于提咼aci的有_ 。A.增大 n(HCI) B.增大 n(O2) )C .使用更好的催化剂 D .移去 H2O一定条件下测得反应过程中 n(Cl2) )的数据如下:t/min02.04.06.08.03n(Cl2) )/103mo
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026年汽车充电桩安装服务合同协议
- 货物运输保险合同2026年变更程序
- 家政服务安全培训课件
- 物业公司资产管理部年终总结
- 培训讲师课件评估
- 培训教学与课件要求
- 培训中级育婴员课件
- 土壤培训课件内容
- 2024年初级会计专业技术资格《经济法基础》考试典型题汇编(含答案)
- 医疗质量安全全员培训课件
- 供电一把手讲安全课
- 本科实习男护生职业认同感调查及影响因素分析
- 未分化型精神分裂症的护理查房
- 合肥机床行业现状分析
- 国家开放大学《森林保护》形考任务1-4参考答案
- GB 31604.1-2023食品安全国家标准食品接触材料及制品迁移试验通则
- 工控组态技术及应用-MCGS模块三MCGS模拟量组态基本知识课件
- 电力线路维护检修规程
- YC/T 405.2-2011烟草及烟草制品多种农药残留量的测定第2部分:有机氯和拟除虫菊酯农药残留量的测定气相色谱法
- 医院信息系统操作权限分级管理制度
- 养殖场管理制度

评论
0/150
提交评论