



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、一、溶液一、溶液考纲解读:了解溶液的涵义,理解溶液中溶质的质量分数的概念;考纲解读:了解溶液的涵义,理解溶液中溶质的质量分数的概念;了解饱和溶液、溶解度的概念;了解温度对溶解度的影响及溶解了解饱和溶液、溶解度的概念;了解温度对溶解度的影响及溶解度曲线。度曲线。1、溶液的涵义、组成、溶液的涵义、组成(1)溶液的概念:一种或一种以上的物质分散到另一种物质)溶液的概念:一种或一种以上的物质分散到另一种物质里形成里形成均一、稳定均一、稳定的的混合物混合物。(3)形成过程)形成过程溶解溶解(2)组成:)组成: 宏观:宏观:由溶质和溶剂组成。由溶质和溶剂组成。 微观:微观:由溶质的分子或离子(水合分子或水
2、合离子)由溶质的分子或离子(水合分子或水合离子) 溶剂的分子组成。溶剂的分子组成。NaCl(s) Na +(aq) +Cl+(aq)溶解溶解结晶结晶专题专题7 物质的量浓度物质的量浓度(4)分类:)分类:饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液。种溶质的溶液。饱和溶液饱和溶液不饱和溶液不饱和溶液增加溶剂或升高温度(通常)增加溶剂或升高温度(通常)增加溶质、减少溶剂或降温(通常)增加溶质、减少溶剂或降温(通常)2、溶液的定量表示、溶液的定量表示(1)溶解度()溶解度(S)固体溶解度:在一定固体溶解度:在一定温度温度下
3、,某固态物质在下,某固态物质在100 g溶剂里达到溶剂里达到饱和状态时所溶解的质量。饱和状态时所溶解的质量。气体溶解度:某气体在气体溶解度:某气体在101 kPa,一定,一定温度温度时溶解在时溶解在1体积水里体积水里达到饱和状态时的气体体积。达到饱和状态时的气体体积。 依溶解度可将固体物质的溶解性依溶解度可将固体物质的溶解性划分为划分为4个范围:个范围:00.01(难溶难溶) 0.011(微微) 110(可可) 10以上以上(易易)S 100 =m(溶质溶质) m(溶剂溶剂)物质溶解过程中,使溶液温度升高的常见物质:浓物质溶解过程中,使溶液温度升高的常见物质:浓H2SO4、NaOH ;温度降低
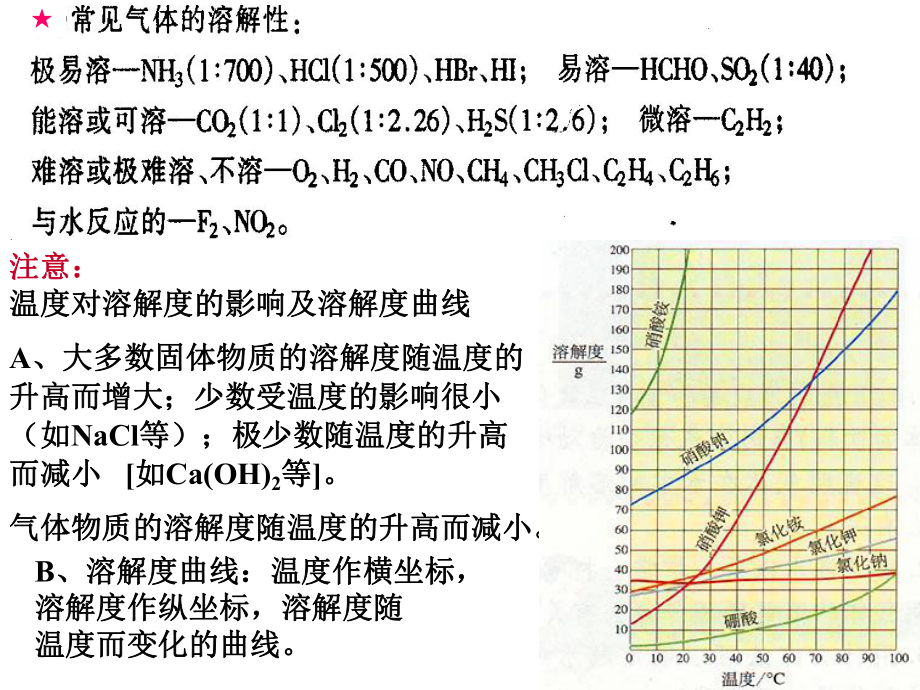
4、的有:温度降低的有:NH4NO3;温度基本不变的有:;温度基本不变的有:NaCl、白糖等。、白糖等。步步高步步高P21注意:注意:温度对溶解度的影响及溶解度曲线温度对溶解度的影响及溶解度曲线A、大多数固体物质的溶解度随温度的、大多数固体物质的溶解度随温度的升高而增大;少数受温度的影响很小升高而增大;少数受温度的影响很小(如(如NaCl等);极少数随温度的升高等);极少数随温度的升高而减小而减小 如如Ca(OH)2等等。气体物质的溶解度随温度的升高而减小。气体物质的溶解度随温度的升高而减小。B、溶解度曲线:温度作横坐标,、溶解度曲线:温度作横坐标,溶解度作纵坐标,溶解度随溶解度作纵坐标,溶解度随
5、温度而变化的曲线。温度而变化的曲线。 3、有关计算、有关计算(1)有关溶解度的计算)有关溶解度的计算A.定义法定义法溶剂溶质mm100SB.关系式法关系式法溶质溶质 + 溶剂溶剂 = 饱和溶液饱和溶液a ba + bS100S+100100Sba100bSaC.利用溶解度曲线及溶解度数据进行计算和判断利用溶解度曲线及溶解度数据进行计算和判断(2)溶解度与溶质质量分数、溶质物质的量浓度的关系)溶解度与溶质质量分数、溶质物质的量浓度的关系(2)溶质的质量分数)溶质的质量分数)%(100S100S%100mmm%100mmBBBB饱和(溶剂)(溶液)(3)物质的量浓度()物质的量浓度(mol/L))
6、()S100(MS1000M1000Vnc饱和步步高步步高P18讨论讨论1:甲、乙两物质的溶解度曲线如图所示。下列叙述中,甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是(正确的是( )A. t1时,在时,在100 g 水中放入水中放入60 g甲,其溶质的质量分数为甲,其溶质的质量分数为37.5% B. t1时,甲和乙的饱和溶液的物质的量浓度一定相等时,甲和乙的饱和溶液的物质的量浓度一定相等C. t2时,甲和乙的饱和溶液的溶质的质量分数一定相等时,甲和乙的饱和溶液的溶质的质量分数一定相等D. t2时,分别在时,分别在100 g水中各溶解水中各溶解20 g甲、乙,同时降低温度,甲、乙,同时
7、降低温度,甲先达到饱和甲先达到饱和D1020304050溶解度溶解度/gt1t2温度温度/ 乙乙甲甲讨论讨论2:某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极收集到的气体总体积为收集到的气体总体积为22.4aL时,剩余溶液恢复至原温度,析时,剩余溶液恢复至原温度,析出溶质出溶质mg;若两极收集到的气体总体积为若两极收集到的气体总体积为33.6aL时,剩余溶液时,剩余溶液恢复至原温度,析出溶质恢复至原温度,析出溶质ng;则硝酸钠在该温度时的溶解度为;则硝酸钠在该温度时的溶解度为(气体体积均为已折合为标况下的体积)(气体体积均为已折合为标况下的
8、体积)( ) 100(n-m)/11.2ag B.3100 (n-m)/agC.100 (n-m)/6ag D.100 (n-m)/(6a+n-m)g讨论讨论3 3:在标况下,将在标况下,将V L A气体(摩尔质量为气体(摩尔质量为M g/mol)溶于)溶于0.1 L水中,所得溶液密度为水中,所得溶液密度为d g/mL,则此溶液的物质的量为(,则此溶液的物质的量为( )2240MVVd1000.B2240MVVd.Ad) 1 . 0V(4 .22MV.D2240MVVdM1000.C练习:练习:在标准状况下,把在标准状况下,把1体积体积Cl2、5体积体积O2跟跟11体积体积H2混合,混合,这三
9、种气体的物质的量之比是这三种气体的物质的量之比是_,质量比是,质量比是_,混合气体的平均相对分子质量是混合气体的平均相对分子质量是_;如果在密闭容器中将混合;如果在密闭容器中将混合气体用电火花引燃后,恰好完全反应,所得盐酸(气体用电火花引燃后,恰好完全反应,所得盐酸(d=1.143g/cm3)的物质的量浓度是的物质的量浓度是_。15 1171 160 2214.99.04 mol /L(3)关于一定量溶液稀释(或浓缩、混合)的计算)关于一定量溶液稀释(或浓缩、混合)的计算 (稀溶液)(稀溶液)(浓溶液)(浓溶液)VcVc(稀溶液)(稀溶液)(浓溶液)浓溶液)mm(溶质的量不变(溶质的量不变(m
10、、n)注意体积:注意体积:近似处理近似处理 由由计算计算讨论讨论1 1:密度为密度为0.91g/cm3的氨水,质量分数为的氨水,质量分数为25 该氨水用等体该氨水用等体积的水稀释后,所得溶液的质量分数为(积的水稀释后,所得溶液的质量分数为( ) A 等于等于12.5 B 大于大于12.5 C 小于小于12.5 D 无法确定无法确定C结论:两种同一溶质、不同质量分数的的溶液混合时结论:两种同一溶质、不同质量分数的的溶液混合时等质量:等质量:( (混混)=)=(1 12 2)/2/2等体积:等体积:溶液密度大于溶液密度大于1:( (混混)(1 12 2)/2 /2 如如: :硫酸、氯化硫酸、氯化
11、钠溶液钠溶液溶液密度小于溶液密度小于1:( (混混)(1 12 2)/2/2 如:如:氨水、乙醇、甲酸溶液氨水、乙醇、甲酸溶液讨论讨论2 2:30%与与50 %的硫酸的硫酸混合混合 所得溶液的质量分数?所得溶液的质量分数?等质量混合等质量混合等体积混合等体积混合练习练习1:将质量分数为将质量分数为a%,物质的量浓度为,物质的量浓度为c1 mol/L稀硫酸蒸发掉稀硫酸蒸发掉一定量的水,使其质量分数为一定量的水,使其质量分数为2a%,此时若物质的量浓度为,此时若物质的量浓度为 c2 mol/L,则,则c1 与与c2的关系为(的关系为( ) A c2 =2c1 B c2 2c1 D c1 =2c2
12、C 练习练习2:将将100g 18 mol/L的硫酸加水稀释为的硫酸加水稀释为 9 mol/L,所加水的质,所加水的质量量_ 100g。(填大于、小于、等于)。(填大于、小于、等于)4、一定物质的量浓度溶液的配制、一定物质的量浓度溶液的配制讨论讨论1 1:怎样配制怎样配制 2mol/L 的的NaCl溶液溶液100mL?计算计算:n (NaCl)=2mol/L0.1L=0.2molm(NaCl)=0.2mol58.5g/mol=11.7g称量:称量:(天平的使用天平的使用?)溶解:溶解:在烧杯中用在烧杯中用20毫升蒸馏水使之完全溶解毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)(注意
13、:应冷却,不可在容量瓶中溶解)转移、洗涤:转移、洗涤:移入移入100mL容量瓶,洗涤烧杯和玻璃棒两容量瓶,洗涤烧杯和玻璃棒两到三次(用玻璃棒引流)到三次(用玻璃棒引流)定容:定容:加水到接近刻度加水到接近刻度12厘米时,厘米时, 改用胶头滴管加水到刻度,改用胶头滴管加水到刻度,摇匀。装入试剂瓶摇匀。装入试剂瓶,贴标签贴标签. 注意事项:注意事项:(1 1)使用前要调零)使用前要调零(2 2)两个托盘上各放一张大小相同的称量纸)两个托盘上各放一张大小相同的称量纸(3 3)称量时遵循左物右码的原则)称量时遵循左物右码的原则(4 4)用镊子夹取砝码应按照从大到小的顺序)用镊子夹取砝码应按照从大到小的
14、顺序(5 5)称量完毕应将砝码放回盒中,游码归零)称量完毕应将砝码放回盒中,游码归零注意注意事项:事项:应在烧杯中溶解,不能在容量瓶中溶解。因为在应在烧杯中溶解,不能在容量瓶中溶解。因为在容量瓶上标有温度和体积,这说明容量瓶的体积容量瓶上标有温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解往往伴随着一定的热受温度影响。而物质的溶解往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因热胀冷效应,如果用容量瓶进行此项操作,会因热胀冷缩使它的体积不准确,严重时还可能导致容量瓶缩使它的体积不准确,严重时还可能导致容量瓶炸裂。炸裂。注意事项:注意事项: 由于容量瓶瓶颈较细,为避免液体由于容量瓶瓶
15、颈较细,为避免液体洒在外面,应用玻璃棒引流。洒在外面,应用玻璃棒引流。 用少量蒸馏水洗涤用少量蒸馏水洗涤2 23 3次,洗涤液要全次,洗涤液要全部转移到容量瓶中。部转移到容量瓶中。 用量筒量取液体药品,量筒不必洗涤。用量筒量取液体药品,量筒不必洗涤。步步高步步高P19讨论讨论2 2:怎样用怎样用98%的硫酸(密度的硫酸(密度1.84)配制)配制0.5mol/L的硫酸的硫酸500mL计算计算98%的浓硫酸的物质的量浓度为:的浓硫酸的物质的量浓度为:18.4mol/L由由C1V1= C2V218.4 V浓浓=0.5 500V浓浓=13.6 mL量取:量取:用量筒量取用量筒量取13.6mL98%的浓
16、硫酸,的浓硫酸,用烧杯装适量蒸馏水,将量取的浓硫酸缓缓用烧杯装适量蒸馏水,将量取的浓硫酸缓缓注入烧杯中,边加边搅拌注入烧杯中,边加边搅拌溶解:溶解:转移、洗涤、定容转移、洗涤、定容.同前同前浓浓 稀稀固配液固配液浓液配稀液浓液配稀液计算计算取量取量溶解溶解转移、洗涤转移、洗涤定容定容物质的量物质的量浓度溶液浓度溶液的配制的配制(称取或量取)(称取或量取)固体算质量固体算质量液体算体积液体算体积在烧杯中溶解在烧杯中溶解冷却后冷却后容量瓶容量瓶1、基本步骤、基本步骤 托盘天平、药匙(固体溶质使用)、量筒、托盘天平、药匙(固体溶质使用)、量筒、烧杯、玻璃棒、容量瓶、胶头滴管烧杯、玻璃棒、容量瓶、胶头滴管、2、实验所需仪器、实验所需仪器 3、实验误差分析、实验误差分析VMmVncBB称量误差称量误差mVCB砝码锈蚀增重砝码锈蚀增重砝码、药品放反砝码、药品放反在敞口容器中称量易挥发在敞口容器中称量易挥发性物质性物质量筒量取液体时俯视读数量筒量取液体时俯视读数量筒量取液体时仰视读数量筒量取液体时仰视读数增大增大减小减小/不变不变减小减小
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 湘教版数学七年级上册3.3《一元一次方程模型的应用》听评课记录3
- 小学二年级口算题之一
- 五年级口算竞赛题
- 店铺出租合同范本
- 小区弱电合同范本
- 2025年度车位物业管理与社区老年活动中心服务合同
- 2025年度智能小区物业与业主服务合同模板范文
- 二零二五年度离婚后子女抚养费及教育支持协议
- 国际科技合作项目专题合作协议书范本
- 2025年度电影音乐创作与制作聘用合同
- 周口2024年河南周口市公安机关招聘辅警458人笔试历年参考题库附带答案详解
- 《头面部穴位按摩》课件
- 2024美团简化版商家合作合同标准文本一
- 2025年贵州黔源电力股份有限公司招聘笔试参考题库含答案解析
- 《休闲食品加工技术》 课件 1 休闲食品生产与职业生活
- 春季开学安全第一课
- 十大护理安全隐患
- 2025年新生儿黄疸诊断与治疗研究进展
- 税务师事务所收费标准
- 商场撤场申请书
- 《建筑固定消防设施》PPT课件

评论
0/150
提交评论