



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、v 醛和酮均含有醛和酮均含有羰基官能团羰基官能团:v 羰基碳原子上至少连有一个氢原子的叫醛:羰基碳原子上至少连有一个氢原子的叫醛: CHO 或或 叫醛基。叫醛基。 羰基碳原子上同时连有两个烃基的叫酮。羰基碳原子上同时连有两个烃基的叫酮。第十二章第十二章 醛和酮醛和酮ORHORRan aldehydean ketonesp2易受易受亲核试剂亲核试剂进攻,进攻,发生亲核加成发生亲核加成12.1 醛、酮的结构和命名醛、酮的结构和命名(1)醛酮的结构醛酮的结构甲醛的结构甲醛的结构羰基羰基电子云示意图电子云示意图偶极矩偶极矩 2.27D偶极矩偶极矩 2.85D(1)脂肪族醛酮命名脂肪族醛酮命名: 以含有
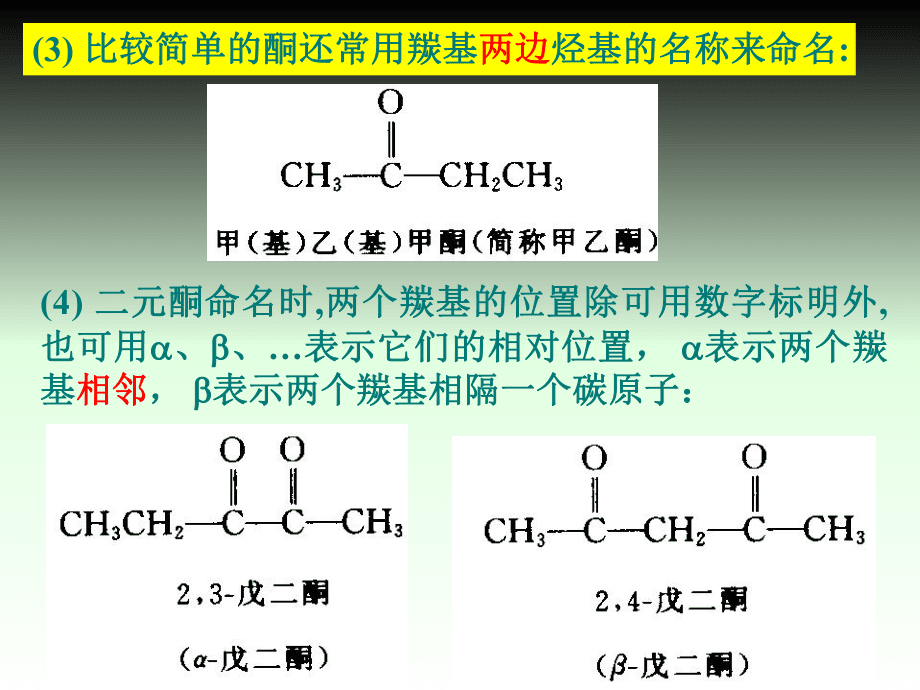
2、羰基的最长碳链为主链以含有羰基的最长碳链为主链,支链作为取代基支链作为取代基,主链中碳原子的编号从靠近羰基主链中碳原子的编号从靠近羰基的一端开始的一端开始(酮需要标明位次酮需要标明位次): 也可用希腊字母也可用希腊字母 表示靠近羰基的碳原子表示靠近羰基的碳原子,其次为其次为 、 、.(2)醛酮的命名醛酮的命名例如:例如: (2)芳香醛、酮的命名,常将脂链作为主链,芳环为取芳香醛、酮的命名,常将脂链作为主链,芳环为取代基代基:(4) 二元酮命名时二元酮命名时,两个羰基的位置除可用数字标明外两个羰基的位置除可用数字标明外, 也可用也可用 、 、表示它们的相对位置,表示它们的相对位置, 表示两个羰表
3、示两个羰基基相邻相邻, 表示两个羰基相隔一个碳原子:表示两个羰基相隔一个碳原子:(3) 比较简单的酮还常用羰基比较简单的酮还常用羰基两边两边烃基的名称来命名烃基的名称来命名:v 伯醇和仲醇氧化或脱氢反应,可分别生成醛、酮。伯醇和仲醇氧化或脱氢反应,可分别生成醛、酮。 例例1:例例2:12.2 醛酮的制法醛酮的制法12.2.1 醇的氧化和脱氢醇的氧化和脱氢CH3CH2CHCH3CH3CH2CCH3OHOCrO3H2SO4OHONa2Cr2O7H2SO4CHCH2CH3CCH2CH3H2CrO4OHO例例3:以三氧化铬和吡啶的络合物为催化剂制醛产率高:以三氧化铬和吡啶的络合物为催化剂制醛产率高:例
4、例4: (主要制酮主要制酮):含有不饱和含有不饱和C=C双键的醛氧化,需采取特殊催化剂,如:双键的醛氧化,需采取特殊催化剂,如:丙酮丙酮-异丙醇异丙醇铝铝(或叔丁醇铝)或三氧化铬(或叔丁醇铝)或三氧化铬-吡啶络合物作氧化剂达吡啶络合物作氧化剂达到此目的。到此目的。欧芬脑尔氧化法欧芬脑尔氧化法羰基与羟基互换羰基与羟基互换例例5:醇在适当的催化剂条件下醇在适当的催化剂条件下脱脱去一分子去一分子氢氢,生成,生成醛酮。醛酮。 该反应得到的产品纯度高,但为一吸热反应,工业上该反应得到的产品纯度高,但为一吸热反应,工业上常在脱氢的同时,通入一定量的空气,使生成的氢与氧常在脱氢的同时,通入一定量的空气,使生
5、成的氢与氧结合放出的热量供脱氢反应。这种方法叫结合放出的热量供脱氢反应。这种方法叫氧化脱氢法氧化脱氢法。例例2:例例1:v在在汞盐催化汞盐催化下,生成羰基化合物,除乙炔外,其他下,生成羰基化合物,除乙炔外,其他炔烃炔烃水合水合均生成酮:均生成酮:12.2.2 炔烃水合炔烃水合v 生成相应的羰基化合物,该法主要制备生成相应的羰基化合物,该法主要制备芳香族醛酮芳香族醛酮(因为芳环侧链上(因为芳环侧链上 - 容易被卤化。)容易被卤化。)例例1:例例2:12.2.3 同碳二卤化物水解同碳二卤化物水解补充:补充:用甲苯及其他必要的有机、无机试剂合成:用甲苯及其他必要的有机、无机试剂合成:注意注意v芳烃在
6、无水三氯化铝催化下,与芳烃在无水三氯化铝催化下,与酰卤酰卤或或酸酐酸酐作用,作用,生成芳酮:生成芳酮: 该反应也是一个芳环上的亲电取代反应:该反应也是一个芳环上的亲电取代反应:12.2.4 傅傅-克酰基化反应克酰基化反应苯甲酰氯苯甲酰氯二苯甲酮二苯甲酮加酸处理得酮加酸处理得酮 傅傅-克酰基化反应历程:克酰基化反应历程:v 芳烃与直链卤烷发生烷基化反应,往往得到重排产芳烃与直链卤烷发生烷基化反应,往往得到重排产物,但酰基化反应物,但酰基化反应没有重排没有重排现象:现象: 在在AlCl3-Cu2Cl2催化剂下,芳烃与催化剂下,芳烃与CO、HCl作用可在环作用可在环上引入一个甲酰基的产物,上引入一个
7、甲酰基的产物,叫叫 。伽特曼伽特曼-科赫反应科赫反应补充:补充:完成下列转换完成下列转换伽特曼伽特曼-科赫反应科赫反应v 芳烃侧链上的芳烃侧链上的 - 活泼易被氧化活泼易被氧化.v控制条件控制条件可生成相应的芳醛和芳酮(注意选择适当可生成相应的芳醛和芳酮(注意选择适当的催化剂)。的催化剂)。12.2.5 芳烃侧链的氧化芳烃侧链的氧化v烯烃与烯烃与CO和和H2在某些金属的羰基化合物催化下,与在某些金属的羰基化合物催化下,与110200、1020 MPa下,发生反应,生成多一个下,发生反应,生成多一个碳原子的醛。碳原子的醛。 羰基合成的原料多采用双键在链端的羰基合成的原料多采用双键在链端的 -烯烃
8、烯烃,其产,其产物以物以直链醛为主直链醛为主(直(直:支支 = 4:1)。)。12.2.6 羰基合成羰基合成(主要)(主要)v 室温下,甲醛为气体,室温下,甲醛为气体,12个碳原子以下的醛酮个碳原子以下的醛酮为液体,高级醛酮为固为液体,高级醛酮为固体。体。v 低级醛有刺鼻的气味,低级醛有刺鼻的气味,中级醛中级醛(C8C13)则有)则有果香果香。v低级醛酮的沸点比相对低级醛酮的沸点比相对分 子 量 相 近 的 醇 低 。分 子 量 相 近 的 醇 低 。(分子间无氢键)。(分子间无氢键)。 12.3 醛酮的物理性质醛酮的物理性质醛酮沸点与烷烃沸点的比较醛酮沸点与烷烃沸点的比较v 由于羰基是个极性
9、基团,分子间偶极的静电引力比由于羰基是个极性基团,分子间偶极的静电引力比较大,所以醛酮的沸点一般比相对分子量的非极性化较大,所以醛酮的沸点一般比相对分子量的非极性化合物(如烃类)高。合物(如烃类)高。 低级醛酮易溶于水。丙酮能溶解很多有机化合物,低级醛酮易溶于水。丙酮能溶解很多有机化合物,是很好的有机溶剂。是很好的有机溶剂。v 烯烃的加成一般为亲电加成烯烃的加成一般为亲电加成;v 醛酮的加成为亲核加成醛酮的加成为亲核加成,易于易于HCN、NaHSO3、ROH、RMgX等发生等发生亲核加成反应亲核加成反应。 在碱性溶液中反应加在碱性溶液中反应加速,在酸性溶液中反速,在酸性溶液中反应变慢:应变慢:
10、-(氰醇)(氰醇) 12.4 醛酮的化学性质醛酮的化学性质12.4.1 加成反应加成反应(1)与氰化氢加成)与氰化氢加成v CN-离子为强的亲核试剂,它与羰基的加成离子为强的亲核试剂,它与羰基的加成反应历程反应历程:注意:注意:由于氰化氢剧毒,易挥发。通常由氰化钠和无由于氰化氢剧毒,易挥发。通常由氰化钠和无机酸与醛(酮)溶液反应。机酸与醛(酮)溶液反应。pH值约为值约为8有利于反应。有利于反应。v 羟基腈是一类很有用的有机合成中间体。氰基羟基腈是一类很有用的有机合成中间体。氰基-CN能能水解成羧基水解成羧基,能还原成氨基。,能还原成氨基。例如:例如: 聚聚 -甲基丙烯酸甲酯的单体的合成:甲基丙
11、烯酸甲酯的单体的合成: 第二步包含:水解、酯化和脱水等反应。第二步包含:水解、酯化和脱水等反应。有机玻璃有机玻璃丙酮氰醇丙酮氰醇(78%) -甲基甲基丙烯酸甲酯(丙烯酸甲酯(90%)氯甲基化反应氯甲基化反应伽特曼伽特曼-科赫反应科赫反应补充:v 醛醛和和脂肪族甲基酮脂肪族甲基酮(或或七元环以下的环酮七元环以下的环酮)与之与之反应,生成反应,生成 -羟基磺酸钠羟基磺酸钠: -羟基磺酸钠易溶于水,羟基磺酸钠易溶于水,不溶于饱和亚硫酸氢钠。将。将醛酮与醛酮与过量的饱和亚硫酸氢钠水溶液过量的饱和亚硫酸氢钠水溶液混合在一起,醛和混合在一起,醛和甲基酮很快会有甲基酮很快会有结晶析出结晶析出。可以此来鉴别醛
12、酮。可以此来鉴别醛酮。 (2)与亚硫酸氢钠加成)与亚硫酸氢钠加成(注意:苯甲醛可以,但苯乙酮不与之反应注意:苯甲醛可以,但苯乙酮不与之反应) 该反应是个可逆反应,常被用来分离和提纯某些羰该反应是个可逆反应,常被用来分离和提纯某些羰基化合物:基化合物: -羟基磺酸钠与等摩尔的羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可被氰作用,则磺酸基可被氰基取代,生成基取代,生成 -羟基腈,避免使用有毒的氰化氢,产率羟基腈,避免使用有毒的氰化氢,产率也比较高。也比较高。 反应历程反应历程(亚硫酸氢根离子为亲核试剂):(亚硫酸氢根离子为亲核试剂):v v将醛溶液在无水醇中通入将醛溶液在无水醇中通入HCl气体或其
13、他无水强酸,气体或其他无水强酸,则在酸的催化下,醛能与一分子醇加成,生成则在酸的催化下,醛能与一分子醇加成,生成半缩醛半缩醛。半缩醛不稳定,可以和另一分子醇进一步缩合,生成半缩醛不稳定,可以和另一分子醇进一步缩合,生成缩醛缩醛:(3)与醇加成与醇加成质子化质子化 半缩醛在酸催化下,可以失去一分子水,形成一个半缩醛在酸催化下,可以失去一分子水,形成一个碳正离子,然后再与另一个醇作用,最后生成稳定的碳正离子,然后再与另一个醇作用,最后生成稳定的缩醛:缩醛: 半缩醛反应历程:半缩醛反应历程: 缩醛的反应历程:缩醛的反应历程:v 缩醛对缩醛对碱碱和和氧化剂氧化剂都相当稳定。由于在酸催化下生都相当稳定。
14、由于在酸催化下生成缩醛的反应是成缩醛的反应是可逆可逆反应,故缩醛可以水解成原来的反应,故缩醛可以水解成原来的醛和醇:醛和醇: 在有机合成中常利用缩醛的生成和水解来保护醛基。在有机合成中常利用缩醛的生成和水解来保护醛基。v 醛与二元醇反应生成环状缩醛:醛与二元醇反应生成环状缩醛:例如:例如: 制造合成纤维制造合成纤维“维尼纶维尼纶”:聚乙烯醇聚乙烯醇甲醛甲醛聚乙烯醇缩甲醛聚乙烯醇缩甲醛纤维纤维(维尼纶维尼纶) v 酮也能与醇生成酮也能与醇生成半缩酮半缩酮或或缩酮缩酮,但反应较为困难。,但反应较为困难。而酮和而酮和1,2-或或1,3-二元醇比较容易生成环状缩酮:二元醇比较容易生成环状缩酮: 常用常
15、用1,2-或或1,3-二元醇与生成环状缩醛以保护羰基!二元醇与生成环状缩醛以保护羰基!例例1例例2:例例3:v醛酮与格利雅试剂加成,后水解成醇:醛酮与格利雅试剂加成,后水解成醇:强亲核试剂强亲核试剂 利用其水解得醇反应,可以使许多卤化物转变为一利用其水解得醇反应,可以使许多卤化物转变为一定的醇:定的醇:例例1:(4)与格利雅试剂的加成)与格利雅试剂的加成醇醇 例例2:例例3:同一种醇可由不同的格利雅试剂和不同的羰基化同一种醇可由不同的格利雅试剂和不同的羰基化合物生成:合物生成:v 与氨的衍生物与氨的衍生物,例如:例如:羟胺羟胺(NH2OH),肼肼(NH2NH2),2,4-二硝基苯肼和二硝基苯肼
16、和氨基脲氨基脲等反应等反应.羟胺羟胺例例1:例例2:肟(肟(w)(5)与氨的衍生物反应)与氨的衍生物反应 例例4:2,4-二硝基苯肼二硝基苯肼氨基脲氨基脲例例3:腙腙(zong)脲脲(niao)第一步第一步:羰基的亲核加成羰基的亲核加成,生成不稳定的加成产物生成不稳定的加成产物;第二步第二步:失去一分子水失去一分子水. 醛酮与氨衍生物的反应是醛酮与氨衍生物的反应是加成加成-脱水反应脱水反应. 氨衍生物对羰基的氨衍生物对羰基的加成加成一般可在弱酸催化下进行,一般可在弱酸催化下进行,其历程和醇对羰基的加成相类似。其历程和醇对羰基的加成相类似。 醛酮与氨衍生物的反应历程醛酮与氨衍生物的反应历程:v
17、醛酮与氨衍生物的反应,也常用来对羰基化合物的醛酮与氨衍生物的反应,也常用来对羰基化合物的鉴定鉴定和和分离分离:(1)生成物为具有)生成物为具有一定熔点的固体一定熔点的固体,可利用来鉴别,可利用来鉴别醛酮;醛酮;(2)它们在稀酸作用下可水解成原来的醛酮,因此)它们在稀酸作用下可水解成原来的醛酮,因此可利用来可利用来分离、提纯分离、提纯醛酮。醛酮。R(R)HNY + H2OH+R(R)HO + H2NY 亚胺极不稳定,极容易水解成原来的醛酮。亚胺极不稳定,极容易水解成原来的醛酮。 希夫碱还原可得仲胺。在有机合成上常利用芳醛与伯希夫碱还原可得仲胺。在有机合成上常利用芳醛与伯胺作用生成希夫碱,加以还原
18、以制备胺作用生成希夫碱,加以还原以制备仲胺。仲胺。 (A)醛酮与氨的反应:)醛酮与氨的反应:(B)醛酮与伯胺的反应)醛酮与伯胺的反应生成取代亚胺(生成取代亚胺(希夫碱希夫碱) 总结总结醛酮加成反应都是亲核加成;在加成反应过醛酮加成反应都是亲核加成;在加成反应过程中,羰基碳原子由原来程中,羰基碳原子由原来sp2杂化的三角形结构变成了杂化的三角形结构变成了sp3杂化的四面体结构;当碳原子所连接基团体积较大杂化的四面体结构;当碳原子所连接基团体积较大时,加成可能产生立体障碍。时,加成可能产生立体障碍。v 醛酮加成反应活性,一般具有如下由易到难的顺序:醛酮加成反应活性,一般具有如下由易到难的顺序: 例
19、如:例如:醛醛和和脂肪族甲基酮脂肪族甲基酮能与能与NaHSO3加成,而非加成,而非甲基酮就难于加成。甲基酮就难于加成。(1)酮)酮-烯醇互变异构烯醇互变异构接受质子的方向接受质子的方向 在微量酸或碱的存在下,酮和烯醇相互转变很快达在微量酸或碱的存在下,酮和烯醇相互转变很快达到动态平衡,这种能够相互转变而同时存在的异构到动态平衡,这种能够相互转变而同时存在的异构体叫互变异构体。(酮体叫互变异构体。(酮-烯醇互变异构)烯醇互变异构) 12.4.2 氢原子的活泼性氢原子的活泼性C6H5CH3CHCOCH3C6H5H3COHCH3C6H5CHH3CCOCH3(R)-酮式(S)-酮式烯醇式(无手性)(R
20、)-3-苯基苯基-2-丁酮溶解在丁酮溶解在NaOH或或HCl的醇水溶液中,的醇水溶液中,发生消旋化:发生消旋化:v 简单的醛酮(乙醛、丙酮等)的烯醇式在互变平衡简单的醛酮(乙醛、丙酮等)的烯醇式在互变平衡混合物中含量很少(酮式的总键能大于烯醇式):混合物中含量很少(酮式的总键能大于烯醇式):v -二羰基化合物,由于共轭效应,烯醇式的能量低,二羰基化合物,由于共轭效应,烯醇式的能量低,因而比较稳定:因而比较稳定:(1)与)与FeCl3显色反应显色反应(2)使溴水褪色)使溴水褪色v在稀碱存在下,醛可以两分子相互作用,生成在稀碱存在下,醛可以两分子相互作用,生成 -羟羟基醛,叫羟醛缩合(或醇醛缩合)
21、反应:基醛,叫羟醛缩合(或醇醛缩合)反应: (2)羟醛缩合反应)羟醛缩合反应+第二步:负离子作为亲核试剂与另一分子乙醛发生亲第二步:负离子作为亲核试剂与另一分子乙醛发生亲核加成,生成烷氧负离子核加成,生成烷氧负离子 羟醛缩合反应历程羟醛缩合反应历程第一步:在碱作用下,生成烯醇负离子第一步:在碱作用下,生成烯醇负离子+ 凡凡 碳上有碳上有氢原子的氢原子的 -羟基醛都容易失去一分子水羟基醛都容易失去一分子水,生成生成烯醛。烯醛。 含有含有 氢原子的酮氢原子的酮也能起类似反应,生成也能起类似反应,生成 , -不饱和不饱和酮酮 -羟基醛羟基醛受热受热时容易失去一分子水,生成时容易失去一分子水,生成 ,
22、 -不饱和醛不饱和醛例例1: 完成下列反应,写出主要产物。完成下列反应,写出主要产物。O思考思考1:思考思考2:O3NaOH 10%O思考思考3:NaOH 10%?OOO +OOH-, H2OO+ H2Ov 两种不同的含有两种不同的含有 氢原子的羰基化合物之间进行羟氢原子的羰基化合物之间进行羟醛缩合反应(称为醛缩合反应(称为交叉羟醛缩合交叉羟醛缩合);若参加反应的一);若参加反应的一种化合物种化合物不含不含 -H原子,产物种类减少:原子,产物种类减少: 苯甲醛与含有苯甲醛与含有 氢原子的脂肪族醛酮缩合,可以生成氢原子的脂肪族醛酮缩合,可以生成芳香族的芳香族的 , -不饱和醛、酮:不饱和醛、酮:
23、(甲醛、三甲基乙醛、苯甲醛、糠醛等)(甲醛、三甲基乙醛、苯甲醛、糠醛等)CHO + CH3CHOdil. OH-?CH=CHCHO肉桂醛90%HCH + CH3CHCHOOCH3dil. Na2CO340oCCH3CCH3CHOCH2OHOHOH10例例2:糠醛糠醛!思考:在思考:在碱碱催化下的催化下的产物有变化吗?产物有变化吗?例例2v 醛、酮分子中的醛、酮分子中的 -H容易被卤素取代,生成容易被卤素取代,生成 -卤卤代醛、酮代醛、酮。例例1 一卤代醛、酮往往可以继续卤化成二卤代、三卤代产物一卤代醛、酮往往可以继续卤化成二卤代、三卤代产物 (3)卤化反应和卤仿反应)卤化反应和卤仿反应(A)碱
24、催化碱催化(不易控制不易控制,直至同碳三卤代物直至同碳三卤代物,易被碱分解易被碱分解):烯醇负离子烯醇负离子 卤代物继续反应卤代物继续反应: -卤代醛、酮反应的历程卤代醛、酮反应的历程 由于卤原子是吸电子的由于卤原子是吸电子的, 碳上的氢原子在碱作用下碳上的氢原子在碱作用下容易离去容易离去,因此第二个因此第二个 氢原子更易被取代氢原子更易被取代.(B) 酸催化酸催化历程历程酸催化可停酸催化可停留一卤代留一卤代v 凡具有凡具有CH3-CO-结构的醛、酮结构的醛、酮(乙醛和甲基酮乙醛和甲基酮)与卤与卤素的素的碱碱溶液作用时溶液作用时,反应总是得到反应总是得到同碳三卤代物同碳三卤代物: 三卤代物在碱
25、存在下,会进一步发生三卤甲基和羰基三卤代物在碱存在下,会进一步发生三卤甲基和羰基碳之间的裂解,得到三卤甲烷和羧酸盐:碳之间的裂解,得到三卤甲烷和羧酸盐: 三卤甲烷俗称卤仿(氯仿、溴仿和碘仿三卤甲烷俗称卤仿(氯仿、溴仿和碘仿(亮黄色亮黄色))。)。该反应叫卤仿反应,通式:该反应叫卤仿反应,通式:3-能发生碘仿反应的结构:能发生碘仿反应的结构:v乙醛乙醛v甲基甲基酮酮v含含CH3CHOH的醇的醇NaOX为强的氧化剂,可将此类结为强的氧化剂,可将此类结构构氧化氧化成:成:CH3-CO- CH3CO 、CH3CHOH下列化合物哪些能发生碘下列化合物哪些能发生碘仿反应?仿反应?(1)CH3CH2OH(2
26、)CH3CHO(3)异丙醇)异丙醇(4) -苯乙醇苯乙醇(5)CH3-CO-CH2-CH2-COOH答:都可以。答:都可以。 注意注意:乙酸不可以乙酸不可以(Why?)思考题 乙酸中也含有乙酸中也含有CH3CO基团基团,但不发生碘仿反应但不发生碘仿反应,为什么?为什么? 乙酸在乙酸在NaOI条件下,形成条件下,形成CH3COO-,氧负离子,氧负离子与羰基共轭,电子均匀化的结果,降低了羰基碳的与羰基共轭,电子均匀化的结果,降低了羰基碳的正电性,因此正电性,因此 氢活泼性降低,不能发生碘仿反应。氢活泼性降低,不能发生碘仿反应。(1)氧化反应)氧化反应v 由于醛的羰基碳上有一个氢原子,所以醛比酮容易
27、由于醛的羰基碳上有一个氢原子,所以醛比酮容易氧化;使用弱的氧化剂都能使醛氧化:氧化;使用弱的氧化剂都能使醛氧化:硝酸银的氨溶液硝酸银的氨溶液,与醛反应,形成,与醛反应,形成银镜银镜。以酒石酸盐为络合剂的以酒石酸盐为络合剂的碱性氢氧化铜溶液碱性氢氧化铜溶液(绿色),(绿色),能与醛作用(能与醛作用(但芳醛较慢!但芳醛较慢!),铜被还原成红色的氧),铜被还原成红色的氧化亚铜沉淀。化亚铜沉淀。12.4.3 氧化和还原氧化和还原(B) 费林试剂费林试剂(Fehling): (A) 托伦斯试剂托伦斯试剂(Tollens): 制备制备 , -不饱和酸可使用这些弱氧化剂不饱和酸可使用这些弱氧化剂(托伦斯试剂
28、托伦斯试剂):例如例如:v 酮不易发生氧化酮不易发生氧化,但在强氧化剂作用下但在强氧化剂作用下,发生羰基和发生羰基和 碳原子间发生碳碳键的断裂碳原子间发生碳碳键的断裂,生成低级羧酸混合物生成低级羧酸混合物: 工业上己二酸的制备工业上己二酸的制备: (2)还原反应)还原反应在不同的条件下,使用不同的试在不同的条件下,使用不同的试剂可得到不同的产物:剂可得到不同的产物:v在催化剂(在催化剂(Ni、Cu、Pt、Pd等)作用下与氢气作用,等)作用下与氢气作用,生成醇,产率高。醛生成伯醇,酮生成仲醇:生成醇,产率高。醛生成伯醇,酮生成仲醇:(A)催化加氢)催化加氢v 若醛、酮分子中有其他不饱和基团(若醛
29、、酮分子中有其他不饱和基团(C=C、CC、 NO2、CN等),也同时被还原:等),也同时被还原: 制醇制醇,产率高产率高,选择性好选择性好v 只还原醛、酮中的羰基,只还原醛、酮中的羰基, 不影响其他不饱和键:不影响其他不饱和键: 还原性比还原性比NaBH4强强,对对C=C、CC没有还原作用没有还原作用, ,但对醛酮但对醛酮, ,以及以及羧酸和酯的羰基、羧酸和酯的羰基、NO2、 CN 等都能还原。等都能还原。(B)用金属氢化物还原)用金属氢化物还原 硼氢化钠硼氢化钠NaBH4: 氢化锂铝氢化锂铝LiAlH4:v 将醛、酮用锌汞齐加将醛、酮用锌汞齐加盐酸盐酸还原成烃:还原成烃: 这是将羰基还原成这
30、是将羰基还原成亚甲基亚甲基的一个较好方法,在有机合成上的一个较好方法,在有机合成上常应用常应用(注意注意:对醛对醛-CHO而言还原到甲基而言还原到甲基-CH3)。芳烃与直链卤烷进行傅芳烃与直链卤烷进行傅-克烷基化反应有重排,所以可先进克烷基化反应有重排,所以可先进行傅行傅-克酰基化反应再用克莱门森还原反应制取克酰基化反应再用克莱门森还原反应制取直链烷基苯直链烷基苯:(C) 克莱门森克莱门森(Clemmensen)还原还原转化为烃转化为烃l 醛、酮与肼在高沸点溶剂(如一缩乙二醇)中与醛、酮与肼在高沸点溶剂(如一缩乙二醇)中与碱碱一起加热,羰基先与肼生成腙,腙在碱性加热条件一起加热,羰基先与肼生成
31、腙,腙在碱性加热条件下失去氮,结果羰基变成亚甲基。下失去氮,结果羰基变成亚甲基。黄鸣龙的贡献黄鸣龙的贡献原工艺:醛、酮与肼生成腙,在原工艺:醛、酮与肼生成腙,在KOH或乙醇或乙醇钠作用下放出钠作用下放出N2,需要高温高压,不方便。后改用高沸点醇,如,需要高温高压,不方便。后改用高沸点醇,如三缩乙二醇为溶剂,要回流三缩乙二醇为溶剂,要回流100h。黄黄1946年改进:将醛、酮、年改进:将醛、酮、NaOH、肼的水溶液和高沸点醇一起加热使之生成腙后,先将水、肼的水溶液和高沸点醇一起加热使之生成腙后,先将水过量的肼蒸出,待温度达到腙的分解温度(过量的肼蒸出,待温度达到腙的分解温度(195200)时再回
32、)时再回流流34h即可。即可。优点优点:常压进行,时间短。:常压进行,时间短。(D) 沃尔夫沃尔夫-凯惜钠凯惜钠-黄鸣龙反应黄鸣龙反应 例:用用HCl,可使,可使之变为酚!之变为酚!-CO,-NO2均均还原!还原!例例1例例2v 不含不含 氢原子的醛在氢原子的醛在浓碱浓碱存在下可以发生歧化反应,存在下可以发生歧化反应,即两个分子醛相互作用,其中一分子醛还原成醇,一即两个分子醛相互作用,其中一分子醛还原成醇,一个氧化成酸:个氧化成酸: 两种不同的不含两种不同的不含 氢原子的醛在浓碱存在下可以发氢原子的醛在浓碱存在下可以发生交叉歧化反应,产物复杂(两个酸两个醇)。生交叉歧化反应,产物复杂(两个酸两
33、个醇)。(3) 坎尼扎罗(坎尼扎罗(Cannizzaro)反应)反应v :由于甲醛还原性强,反应:由于甲醛还原性强,反应结果总是另一种醛被还原成醇,而甲醛氧化成酸:如结果总是另一种醛被还原成醇,而甲醛氧化成酸:如甲甲醛醛和和乙醛乙醛制备季戊四醇包括交叉羟醛缩合和交叉歧化反制备季戊四醇包括交叉羟醛缩合和交叉歧化反应:应: 季戊四醇季戊四醇是重要化工原料,它的硝酸酯是心血管扩张是重要化工原料,它的硝酸酯是心血管扩张药物。药物。若两个醛之一为甲醛若两个醛之一为甲醛v 由于醛基直接连在芳环上的芳醛都没有由于醛基直接连在芳环上的芳醛都没有 氢原子,氢原子,所以可以用所以可以用坎尼扎罗反应坎尼扎罗反应来制
34、备来制备芳香族醇芳香族醇:v 甲醛是无色有刺激性气味的气体,易溶于水。甲醛是无色有刺激性气味的气体,易溶于水。v 含甲醛含甲醛37%40%、甲醇、甲醇8%的水溶液叫做的水溶液叫做“福尔马福尔马林林”,用作杀菌剂和防腐剂(制作标本)。,用作杀菌剂和防腐剂(制作标本)。 在酸性介质中加热在酸性介质中加热,可解聚再生成甲醛。可解聚再生成甲醛。 用此法储运甲醛。用此法储运甲醛。12.5 重要的醛和酮重要的醛和酮12.5.1 甲醛甲醛(1) 甲醛极易氧化和聚合甲醛极易氧化和聚合 (2)甲醛在水中与水加成)甲醛在水中与水加成甲二醇 浓缩甲醛水溶液和甲醛水溶液储存较久会生成白色浓缩甲醛水溶液和甲醛水溶液储存
35、较久会生成白色的多聚甲醛(加热重新分解成甲醛):的多聚甲醛(加热重新分解成甲醛):(3)甲醛与氨作用)甲醛与氨作用乌洛托品(橡胶促进剂)乌洛托品(橡胶促进剂)v 合成气合成气(CO+2H2)或天然气或天然气(CH4)制甲醇;制甲醇;v 甲醇氧化脱氢制甲醛甲醇氧化脱氢制甲醛: CH3OH + O2 2HCHO + 2H2OAg600700 甲醛用于制造酚醛树脂、脲醛树脂、合成纤维甲醛用于制造酚醛树脂、脲醛树脂、合成纤维(维尼纶)及(维尼纶)及季戊四醇季戊四醇等等 (4)甲醛的生产)甲醛的生产甲醇氧化脱氢法甲醇氧化脱氢法v 无色有刺激性气味的低沸点气体,易氧化和聚合。无色有刺激性气味的低沸点气体,
36、易氧化和聚合。v 用来合成乙酸、乙酐、用来合成乙酸、乙酐、季戊四醇季戊四醇、三氯乙醛三氯乙醛(1)乙醛的聚合乙醛的聚合三聚或四聚乙醛三聚或四聚乙醛 在硫酸存在下加热在硫酸存在下加热,可解聚再生成乙醛。可解聚再生成乙醛。 用此法储运乙醛。用此法储运乙醛。 补充补充三聚乙醛为香味液体;四聚乙醛为白色固体,三聚乙醛为香味液体;四聚乙醛为白色固体,熔点熔点246,燃烧时无烟,用作,燃烧时无烟,用作固体无烟燃料固体无烟燃料。 12.5.2 乙醛乙醛 A:乙炔与水加成:乙炔与水加成P70B: 乙烯的乙烯的Wacker氧化氧化 主要主要C: 由乙醇制备由乙醇制备CH3CH2OH + O2 CH3CHO +
37、H2O Ag(2)乙醛的制备)乙醛的制备v 具有愉快香味的液体。重要的有机溶剂;能溶解多具有愉快香味的液体。重要的有机溶剂;能溶解多种有机物。种有机物。(1)丙酮的制备)丙酮的制备A:玉米或糖蜜发酵:玉米或糖蜜发酵B:异丙苯氧化制苯酚和丙酮(:异丙苯氧化制苯酚和丙酮(P249)(2)用途:)用途: 有机合成原料;在高分子工业中用以制备有机合成原料;在高分子工业中用以制备有机玻璃有机玻璃、环氧树脂环氧树脂等。等。12.5.3 丙酮丙酮C:丙烯直接氧化:丙烯直接氧化 第十三章第十三章 羧酸及其衍生物羧酸及其衍生物 Carboxylic acids and derivatives一、羧酸的分类和命名
38、一、羧酸的分类和命名 1. 分类分类 根据分子中羧基的数目根据分子中羧基的数目 一元酸一元酸 二元酸二元酸 多元酸多元酸 根据根据R的性质的性质 芳香酸芳香酸 饱和酸饱和酸 脂肪酸脂肪酸 不饱和酸不饱和酸 2. 2. 命名命名a) 俗名俗名 HCOOH CH3COOH蚁酸 酒酒石石酸酸 乳乳酸酸醋醋酸酸 苹苹果果酸酸 柠柠檬檬酸酸HCCOOHOHHC OHCOOHC COOHHOH2C COOHCOOHHC OHH2C COOHHCCH3OHCOOHH2C COOHb) 系统系统命名法命名法u 选取含羧基的最长碳链选取含羧基的最长碳链主链主链u 从靠近羧基的一端开始编号从靠近羧基的一端开始编号
39、u 取代基、重键的位置用阿拉伯数字标出取代基、重键的位置用阿拉伯数字标出 3-甲基-2-丁烯酸3-硝基苯甲酸(或间-)-甲基戊酸(3-甲基戊酸)C CH COOHCH3CH3COOHNO2CH3CH2CHCH2COOHCH3二、羧酸的物理性质二、羧酸的物理性质 1. 分子中有两个部位可形成分子中有两个部位可形成H-键,常以二聚体存在键,常以二聚体存在 2. b.p很高(比很高(比M相近的醇高)相近的醇高) 例:例: M甲酸甲酸 = M乙醇乙醇, b.p 100.7 78.5 3. 与水形成与水形成H-键键=易溶于水易溶于水 C1C4 的酸与水混溶,的酸与水混溶,R增大,水溶性增大,水溶性 CR
40、OO HC ROOH三、羧酸的化学性质三、羧酸的化学性质 结构与反应性结构与反应性R CHHC O HO-+.Nu. .II亲核加成-消除 = 取代(OH)III-H反应IV失羧反应I酸性反应1. 1. 酸性酸性 酸性大小:酸性大小: 大多无机酸大多无机酸 羧酸羧酸 H2CO3 苯酚苯酚 ROH pKa(甲酸(甲酸3.75) 4.75-5 6.37 9.98 16-17 溶于溶于Na2CO3 不溶不溶酸根负电荷平均分布在两个酸根负电荷平均分布在两个O原子上原子上稳定稳定RCOOH + H2OR COO+ H3+O-电子效应对酸性的影响电子效应对酸性的影响 诱导效应:诱导效应:X-CH2COOH
41、-I-I使酸性增强使酸性增强 X= F Cl Br I CHO NO2 N+(CH3)3pKa 2.66 2.86 2.90 3.18 3.53 1.68 1.83+I+I使酸性减弱使酸性减弱 HCOOH CH3COOH (CH3)2CHCOOH pKa 3.75 4.76 4.86 共轭效应:共轭效应: X= OH OCHOH OCH3 3 CH CH3 3 H Cl NO H Cl NO2 2 pKa:4.57 4.47 4.38 4.57 4.47 4.38 4.204.20 3.97 3.42 3.97 3.42场效应:场效应:p pKa : 6.04 6.25COOHXHCOOHCl
42、COOHOOClH 2. 羧基中羟基被取代的反应羧基中羟基被取代的反应 PCl3PCl5 POCl3 + HClSOCl2SO2 + HClH3PO3回回流流COHORCORO CP2O5CORNH2H NH2H ORCOROR+ H2OH+COROH+ORCOClR+共同的反应历程:共同的反应历程:RCOOH+ Nu.RCOHRCONuO-+ -OHNu = X-, -NH2, -ORRCOO-消消除除取取代代产产物物.加加成成Nu 1)酯化)酯化 使反应进行到底:使反应进行到底:+ HORH+ H2OCOOHRCOORR反应慢,反应慢,H 催化可逆,催化可逆,+难进行完全难进行完全乙酸乙酸
43、 + 乙醇乙醇 K=2/3反应物之一过量反应物之一过量除去产物之一(常是除去产物之一(常是H O)使平衡向右移动)使平衡向右移动2例:例:OOHCH3+CH2HCH2CH3HHOCH2OO83%H+ (TsOH)苯苯, ref. (-H2O)反应机理:反应机理: 两种可能两种可能a.R C OHO+H O R+ H2OR C ORO+ HO RR C OOHb.+ H2OR C ORO实验事实:1. 同同位位素素标标记记: :2. 旋旋光光标标记记: :R C OHO+H18O RR C18ORO+ H2OCH3C OHO+H O CCH3(CH2)5CH3HC O CCH3(CH2)5CH3
44、HCH3O* *+ H2O* *说明反应是按说明反应是按a式式进行的进行的完整反应历程可以表示如下完整反应历程可以表示如下:R COOH+ H+R C+OHOHR COHOH+OHR- H+R COHOHORslowfast加成消除R C+OHOR+ -OH- H+R COOR+ H2OHO R.1、2醇的酯化按醇的酯化按a式进行:式进行: 亲核加成亲核加成消除,动力学上二级反应消除,动力学上二级反应3醇的酯化按醇的酯化按b式进行:式进行:消除消除加成,动力学上是一级反应加成,动力学上是一级反应R3COH + H+R3COH2+slowR3C+ + H2O+ +CR3fast- H+RCOOH
45、RCOHO CR3RCOO CR3+.进一步研究发现:进一步研究发现: 2)生成酰卤的反应)生成酰卤的反应 历程:历程: PCl3PCl5 POCl3 + HClSOCl2SO2 + HClH3PO3回回流流COROH+COClR+CO+ SOCl2OSOCl+ HCl+ SO2CROHCORClRO3)生成酸酐的反应)生成酸酐的反应 常用常用OROHOROOR+ H2OP2O52OOOOROOROOHOROH2+24)生成酰胺的反应)生成酰胺的反应 CH3CH2CH2COOH + NH3CH3CH2CH2COO- +NH425OC185OCCH3CH2CH2CONH2+ H2O5)与有机金属
46、化合物的反应)与有机金属化合物的反应 (也属加成(也属加成消除反应)消除反应) 因为中间体因为中间体 是不溶盐,不能继续反应!是不溶盐,不能继续反应! R COMgXORMgX不能进行上述反应不能进行上述反应COOHO+ CH3LiOOHROOLiRORR+ RLi+ RHRLiCROLiOLiRH2O3. -H的取代反应的取代反应羧酸的羧酸的-H不如醛酮的活泼,需红磷催化:不如醛酮的活泼,需红磷催化: X NH2,CN,OH等等 多功能基化合物多功能基化合物 -卤代酸在合成上很有用:卤代酸在合成上很有用:CH3COOHBr2 + PBrCH2COOH反应是分步进行的:RCH2COHO+PBr3RCH2CBrORCH2CBrORCH=CBrOHRCH=CBrOH+Br2RCHCBrOBrRCHCBrOBr+RCH2COHORCHCOHOBr+RCH2CBrO-C上有强吸电子基的羧酸不稳定上有强吸电子基的羧酸不稳定,容易
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 二零二五年度光伏发电站投资建设与运营承包合同样本3篇
- 2025年高校学生宿舍托管租赁服务合同范本3篇
- 二零二五年篮球运动场地照明节能改造合同2篇
- 四川省自贡市2024-2025学年八年级上学期期末考试道德与法治试题(含答案)
- 2025版围挡安装劳务分包合同范本(含气候影响调整)2篇
- 《浆细胞白血病》课件
- 外币存款利率的市场预测考核试卷
- 城市公共交通系统的创新与改进考核试卷
- 《明代的政治与制度》课件
- 二零二五年度木雕工艺品出口退税与税收筹划合同4篇
- 山东铁投集团招聘笔试冲刺题2025
- 真需求-打开商业世界的万能钥匙
- 2025年天津市政集团公司招聘笔试参考题库含答案解析
- GB/T 44953-2024雷电灾害调查技术规范
- 2024-2025学年度第一学期三年级语文寒假作业第三天
- 2024年列车员技能竞赛理论考试题库500题(含答案)
- 心律失常介入治疗
- 6S精益实战手册
- 展会场馆保洁管理服务方案
- 监理从业水平培训课件
- 广东省惠州市实验中学2025届物理高二第一学期期末综合测试试题含解析

评论
0/150
提交评论