



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、chapter 6chapter 6chapter 66.9 炔烃的分类和结构炔烃的分类和结构6.9.1 炔烃的分类炔烃的分类6.9.2 炔烃的结构炔烃的结构chapter 66.9.1 炔烃的分类炔烃的分类 按碳架分类:链炔烃和环炔烃。按碳架分类:链炔烃和环炔烃。 按三键位置分类:端炔烃和内炔烃。按三键位置分类:端炔烃和内炔烃。 按三键数目分类按三键数目分类: :单炔烃、二炔烃、多炔烃等。单炔烃、二炔烃、多炔烃等。 炔烃炔烃:分子中含有碳:分子中含有碳- -碳三键碳三键( CC )( CC )的烃的烃称为炔烃。炔烃官能团是称为炔烃。炔烃官能团是 。CCCH3CCH丙炔CC(CH2)10环十二
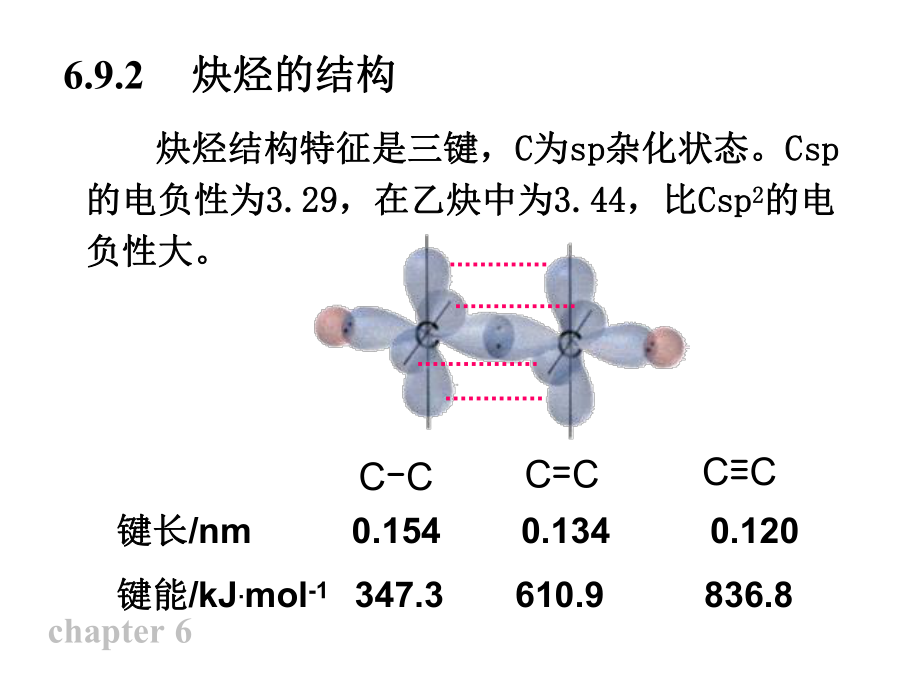
2、碳炔CH3CH2C CH1 1- -丁丁炔炔2 2- -丁丁炔炔C C CH3H3CC CHCH3CH2CH21-戊炔HC C C CH1 1,3 3- -丁丁二二炔炔C C C C C C CH3H3C2 2,4 4,6 6- -辛辛三三炔炔chapter 66.9.2 炔烃的结构炔烃的结构 炔烃结构特征是三键,炔烃结构特征是三键,C C为为spsp杂化状态。杂化状态。CspCsp的电负性为的电负性为3.293.29,在乙炔中为,在乙炔中为3.443.44,比,比CspCsp2 2的电的电负性大。负性大。C CC CC C键长键长/nm 0.154 0.134 0.120 键能键能/kJ.m
3、ol-1 347.3 610.9 836.8 chapter 6 三键由一个三键由一个键和两个键和两个键组成,两个键组成,两个键互键互相垂直,相垂直,CCCC上电子云的密度高,在上电子云的密度高,在C-CC-C间间形成筒状形成筒状分布分布, , 碳核对电子吸引较不牢,碳核对电子吸引较不牢,电子易流动,受分子结电子易流动,受分子结构影响,往往电荷不是均匀分布,构影响,往往电荷不是均匀分布,电子较易极化。电子较易极化。chapter 6chapter 6CCRH氧化氧化加成加成亲电加成亲电加成亲核加成亲核加成炔氢酸性炔氢酸性chapter 66.10.1 加成反应加成反应1. 炔烃与烯烃加成反应的
4、异同点炔烃与烯烃加成反应的异同点 炔烃与烯烃一样可以进行加成反应,两者有相炔烃与烯烃一样可以进行加成反应,两者有相同处和不同处。同处和不同处。相同处:相同处:(1) 能与卤素、卤化氢等亲电试剂进行亲电加成反能与卤素、卤化氢等亲电试剂进行亲电加成反应,遵守马氏加成规则。应,遵守马氏加成规则。(2) 与溴化氢加成时也有过氧化物效应。与溴化氢加成时也有过氧化物效应。chapter 6不同处:不同处:(1) 炔烃亲电加成比烯烃难,需要催化剂才能炔烃亲电加成比烯烃难,需要催化剂才能顺利进行。顺利进行。(2) 三键可以加成两分子试剂,加成是分步进三键可以加成两分子试剂,加成是分步进行的,可以控制停留在加一
5、分子试剂的阶段。行的,可以控制停留在加一分子试剂的阶段。(3) 三键可以进行三键可以进行亲核加成亲核加成,亲核加成烯烃比,亲核加成烯烃比炔烃难。炔烃难。chapter 62. 亲电加成反应亲电加成反应C C CH3CH3HCIC CCICH3HCH3HCIC CH3CICICH3CH2(1)加卤化氢反应加卤化氢反应 加一分子氯化氢得卤代烯烃,加入两分子氯化氢加一分子氯化氢得卤代烯烃,加入两分子氯化氢得到同碳二卤代烷:得到同碳二卤代烷: 乙炔加乙炔加HCl需要有催化剂才能顺利反应,是合成氯需要有催化剂才能顺利反应,是合成氯乙烯的工业方法:乙烯的工业方法:CHCHHCIHgCI2/CCH2CHCI
6、+chapter 6溴化氢也能与炔烃加成:溴化氢也能与炔烃加成:CH3CH2CH2CH2C CHBrHCH3CH2CH2CH2CBr CH2无水 Fe+15内炔烃加卤化氢是内炔烃加卤化氢是反式反式加成:加成:炔烃与炔烃与HBrHBr加成也能按自由基机理进行,得到加成也能按自由基机理进行,得到反马氏规则反马氏规则产物:产物:CH3CH2C CCH2CH3HCIC CCIC2H5C2H5H+(CH3)4N+CI-CH3COOH,251-溴丙烯(溴丙烯(88%) 2-溴丙烯溴丙烯(12%)CH3C CH+BrHCH3CH CHBr+CH3C CH2Brchapter 6(2)加卤素反应加卤素反应炔烃
7、与溴加成也是炔烃与溴加成也是反式反式加成加成: :CH3C CCH3Br2C CBrCH3BrCH3+-20乙醚乙醚反反-2,3-二溴二溴-2-丁烯丁烯(控制加成)(控制加成)CH3C CCH3Br22CH3CBr2CBr2CH3+20CCI42,2,3,3-四溴丁烷四溴丁烷chapter 6 分子中同时含有三键和双键时,加入限量的分子中同时含有三键和双键时,加入限量的溴,溴,优先加在双键上优先加在双键上:CHC CH2CHCH2Br2CHC CH2CHBrCH2Br+1-戊烯戊烯-4-炔炔4,5-二溴二溴-1-戊炔戊炔 (收率(收率95%)chapter 6(3)水合反应水合反应 烯烃水合反
8、应需酸催化,而炔烃水合反应需要在烯烃水合反应需酸催化,而炔烃水合反应需要在HgSOHgSO4 4的的H H2 2SOSO4 4溶液中才能顺利进行:溶液中才能顺利进行:CHCHOH2CH3CHOHC CHH OH HgSO4-H2SO4+98105重排重排乙烯醇乙烯醇乙醛乙醛是工业合成乙醛的方法之一是工业合成乙醛的方法之一chapter 6端炔烃水合得到甲基酮端炔烃水合得到甲基酮: 炔烃亲电加成反应,用的是毒性很大的汞炔烃亲电加成反应,用的是毒性很大的汞盐,现在大部分改成非汞催化剂。盐,现在大部分改成非汞催化剂。CH3CH2CH2CH2CCHOH H CHCH2CH2CH2C CHOH2CH3C
9、H2CH2CH2CCH3O+Hg2+/H+重排重排甲基酮甲基酮chapter 6(4)加醋酸反应加醋酸反应CH3COOHHC CHH2SO4C OCHOCH2H3C+7580生成的醋酸乙烯酯是合成聚乙烯醇的前体。生成的醋酸乙烯酯是合成聚乙烯醇的前体。chapter 63. 亲核加成反应亲核加成反应 (1)炔烃可以与醇、酸等亲核试剂进行亲核炔烃可以与醇、酸等亲核试剂进行亲核加成反应。加成反应。CHCHCH3OHCH2CHOCH3+CHCHCH3COOHCH2CH O CCH3O+20%KOH溶液溶液 60Zn(O2CCH3)2/C甲基乙烯基醚甲基乙烯基醚醋酸乙烯酯醋酸乙烯酯常称为常称为乙烯基化反
10、应乙烯基化反应,乙炔称为,乙炔称为乙烯基化试剂乙烯基化试剂。chapter 6(2)亲核加成反应的机理:亲核加成反应的机理: 以乙炔与甲醇在氢氧化钾催化下反应为例以乙炔与甲醇在氢氧化钾催化下反应为例说明:说明:CH3OHOHCH3OOH2CHCH2CH CHOCH3CH3OCH CHCH3OCH CH2CH3OHOCH3CH3O+-慢快 chapter 65. 加成反应规律加成反应规律 比较烯烃、炔烃的亲电加成和亲核加成反应,比较烯烃、炔烃的亲电加成和亲核加成反应,可知:可知:亲电加成双键比三键容易,亲核加成三键亲电加成双键比三键容易,亲核加成三键比双键容易比双键容易。4. 加氢氰酸反应加氢氰
11、酸反应HC CHHCNCuCl-NH4ClH2C CH CN+25由乙炔合成丙烯腈的工业方法。由乙炔合成丙烯腈的工业方法。chapter 61. 氧化反应氧化反应 炔烃经炔烃经KMnO4或臭氧氧化后再水解,在三键或臭氧氧化后再水解,在三键处断裂,生成相应的处断裂,生成相应的酸酸:CH3(CH2)7CC(CH2)7CH32C H3(CH2)7COOHCO2+H2OCH3CH2CH2CH2CCHCH3CH2CH2CH2COOHHCOOH+O3H2OKMnO4/OH- H3O+ 像烯烃一样,氧化反应可用来像烯烃一样,氧化反应可用来表征炔烃的结构和鉴定三表征炔烃的结构和鉴定三键的存在键的存在。6.10
12、.2 氧化和还原反应氧化和还原反应chapter 62. 还原反应还原反应 炔烃的还原反应可以还原到烯烃,也可以炔烃的还原反应可以还原到烯烃,也可以还原到烷烃。还原到烷烃。(1) 催化加氢反应催化加氢反应 炔烃加氢反应也需要催化剂,可以加一分炔烃加氢反应也需要催化剂,可以加一分子氢,也可以加两分子氢,实际应用中多数控子氢,也可以加两分子氢,实际应用中多数控制在加一分子氢。制在加一分子氢。CRC R + H2RCHCHRRCH2CH2RNiH2chapter 6如果使用钝化催化剂,可以得到如果使用钝化催化剂,可以得到顺式烯烃顺式烯烃:Pd+Pb(OOCCH3)4/CaCO3NPd+ /BaSO4
13、Ni(OOCCH3)2+NaBH4 NiB钝化催化剂钝化催化剂: Lindlar催化剂催化剂 Cram催化剂催化剂 Brawn催化剂催化剂 (又称(又称P-2催化剂)催化剂)有两个用途:有两个用途: a. .制备顺式烯烃。制备顺式烯烃。 b. .净化聚乙烯单体中微量乙炔。净化聚乙烯单体中微量乙炔。CH3CH2C CCH2CH3 + H2CCH3CH2HCCH2CH3H钝化催化剂chapter 6(2) 硼氢化反应硼氢化反应 与烯烃相似,三键能与硼烷进行硼氢化反应,若将与烯烃相似,三键能与硼烷进行硼氢化反应,若将烯基硼用乙酸处理,得到烯基硼用乙酸处理,得到顺式烯烃顺式烯烃:BH3醚C2H5C C
14、C2H5C CC2H5C2H5HB( )30CH3COOHC CC2H5C2H5HBC CC2H5C2H5HH(CH3COO)3B3( )+25a.在实验室中,可用这个反应制备少量的烯烃。在实验室中,可用这个反应制备少量的烯烃。b.在有机合成中,可作为引进顺式双键的方法。在有机合成中,可作为引进顺式双键的方法。chapter 6 三烯基硼在碱性水溶液中用过氧化氢处理得到酮和醛:三烯基硼在碱性水溶液中用过氧化氢处理得到酮和醛:若端炔烃为反应物得到醛:若端炔烃为反应物得到醛:这是实验室中制醛的方便方法。这是实验室中制醛的方便方法。H2O2-NaOHpH= 8C CC2H5C2H5HOH C CC2
15、H5C2H5HBC2H5CH2CC2H5O3( )H2O2-NaOHC CHC2H5HBC2H5CH2COHpH=3( )8chapter 6(3) 碱金属碱金属- -液氨还原成反式烯烃液氨还原成反式烯烃 炔在液氨中用碱金属如钠、锂等还原得到反炔在液氨中用碱金属如钠、锂等还原得到反式烯烃:式烯烃:C4H9C CC4H9C CHC4H9C4H9HNa-液液NH3 -33 烯烃没有此反应,炔烃还原停留在生成烯烃烯烃没有此反应,炔烃还原停留在生成烯烃这一步,这是制备反式烯烃的一种方法。这一步,这是制备反式烯烃的一种方法。chapter 61. 炔烃的齐聚反应炔烃的齐聚反应(1) 线性齐聚线性齐聚C
16、CHCHCH2CHCHCuCI2-NH4CICH2CHCCCH CH2+CHCHCHCHC CHCHCH2CuCI2-NH4CIHCI+乙烯基乙炔乙烯基乙炔1,5-己二烯己二烯-3-炔炔 乙烯基乙炔与乙烯基乙炔与HClHCl反应合成氯代丁二烯,后者是氯反应合成氯代丁二烯,后者是氯丁橡胶单体。丁橡胶单体。6.10.3 聚合反应聚合反应chapter 6(2) 环齐聚环齐聚CHCHWCI63该反应曾对证明苯的结构很有意义该反应曾对证明苯的结构很有意义环三聚:环三聚:CHCHNi(CN)24环辛四烯环辛四烯环四聚:环四聚:两种取代苯的比例取决于催化剂的种类。两种取代苯的比例取决于催化剂的种类。端炔环
17、三聚:端炔环三聚:C CHRRRRRRRNi+chapter 62. 乙炔的高聚反应乙炔的高聚反应 在齐格勒在齐格勒- -纳塔催化剂作用下,乙炔能聚合成高聚物纳塔催化剂作用下,乙炔能聚合成高聚物聚乙炔。聚乙炔。 聚乙炔分子具有较好的导电性,故称为聚乙炔分子具有较好的导电性,故称为“合成金属合成金属”,是有机导体。参杂金属原子后,导电性更强。是有机导体。参杂金属原子后,导电性更强。CHCHTi/AICH CHn( )n顺顺-聚乙炔聚乙炔CCCCCCHHHHHHCCHH反反-聚乙炔聚乙炔CCCCHHHCCHHHchapter 61. 炔氢的酸性炔氢的酸性 炔氢炔氢:与三键碳直接相连的氢称为炔氢。由
18、于三:与三键碳直接相连的氢称为炔氢。由于三键的影响炔氢有一定的酸性。键的影响炔氢有一定的酸性。 Csp-H-H键是一个极性键是一个极性键,电子偏向键,电子偏向Csp端,炔氢有酸性,端,炔氢有酸性,与其他原子连接的氢比较如下:与其他原子连接的氢比较如下:CH3CH2HNH2HCH3O HOHHCH2CHCHC HHpKa 50 40 35 26 16 15.7 炔氢的酸性比碳炔氢的酸性比碳- -碳双键上的氢酸性大得多。相应碳双键上的氢酸性大得多。相应的负的负离子的稳定性为离子的稳定性为: CHC-CH2CH-CH3CH2-6.10.4 炔氢的反应炔氢的反应chapter 62. 碱金属炔化物的生
19、成碱金属炔化物的生成 炔氢能与强碱性金属炔氢能与强碱性金属LiLi、NaNa、K K等氨基化物反应,生等氨基化物反应,生成碱金属炔化物。成碱金属炔化物。CHCHNaNH2CHCNaNH3CHCNaNaC CNaNaNH2NH3+氨基钠氨基钠 乙炔钠乙炔钠乙炔二钠乙炔二钠 碱金属炔化物是强碱,亲核试剂,可以与伯卤烷反应合碱金属炔化物是强碱,亲核试剂,可以与伯卤烷反应合成炔烃。例:成炔烃。例:端炔烃端炔烃内炔烃内炔烃CHCNaNaC CNaRC CHCHC RRC CNaC C RRRCC RX RNaNH2X RX R2+chapter 63. 过渡金属炔化物的生成过渡金属炔化物的生成 乙炔、端
20、炔烃能与硝酸银或氯化亚铜的氨溶液反应,乙炔、端炔烃能与硝酸银或氯化亚铜的氨溶液反应,生成白色炔化银或砖红色炔化铜沉淀,可用来生成白色炔化银或砖红色炔化铜沉淀,可用来鉴定乙炔和鉴定乙炔和端炔的存在端炔的存在:干燥的炔化银、炔化铜易爆炸。干燥的炔化银、炔化铜易爆炸。RC CHCHCHAgC CAgRC CCuAg(NH3)2Cu(NH3)2NH4NH3+22NH4NH3+2+chapter 66.10.5 异构反应异构反应 在强碱作用下,在强碱作用下, 可异构成可异构成 或或位置变化。位置变化。 CC CCCRCRC CCCHRCHCRCH2OH2 CHCHCRHCCRCHH2CHCRCH2CHC
21、CR2HCCRCH3CCHRC chapter 66.11 二烯烃的分类及结构二烯烃的分类及结构6.11.1 二烯烃的分类二烯烃的分类6.11.2 共轭二烯烃的结构共轭二烯烃的结构chapter 66.11.1 二烯烃的分类二烯烃的分类1. 累积二烯烃累积二烯烃H2C C CH2 两个双键与同一个碳原子相连接,即分子中含两个双键与同一个碳原子相连接,即分子中含 有有 结构的烃为结构的烃为累积二烯烃累积二烯烃。C C C2孤立二烯烃孤立二烯烃 两个双键间隔多于一个亚甲基结构的烃为孤两个双键间隔多于一个亚甲基结构的烃为孤立二烯烃。如立二烯烃。如1,5-1,5-己二烯,己二烯,1,4-1,4-环己二
22、烯等。环己二烯等。H2C C CHCH2CH3chapter 63共轭二烯烃共轭二烯烃 两个双键间隔一个单键,即含两个双键间隔一个单键,即含 结构的烃为共轭二烯烃,最简单的共轭二烯烃是结构的烃为共轭二烯烃,最简单的共轭二烯烃是1,31,3丁二烯,最简单的环状共轭二烯烃是环戊二丁二烯,最简单的环状共轭二烯烃是环戊二烯。烯。C C CC 累积二烯烃的用途不多,有待于开发;孤立二累积二烯烃的用途不多,有待于开发;孤立二烯烃的结构和性质与单烯烃相似;这里只讨论共烯烃的结构和性质与单烯烃相似;这里只讨论共轭二烯的结构。轭二烯的结构。chapter 6 以开链共轭二烯烃系列中最简单的以开链共轭二烯烃系列中
23、最简单的1,3-1,3-丁二烯丁二烯为例说明共轭二烯烃的结构特征。为例说明共轭二烯烃的结构特征。CCCCHHHHHH12346.11.2 共轭二烯烃的结构共轭二烯烃的结构chapter 61价键理论处理结果:价键理论处理结果: C=C的的C为为sp2杂化,有如下结构:杂化,有如下结构:键所在平面与纸面垂直,键所在平面与纸面垂直,键平面与纸面平行键平面与纸面平行键所在平面在纸面内键所在平面在纸面内chapter 6 四个四个C C原子的四个原子的四个p p轨道从侧面互相重叠(又称轨道从侧面互相重叠(又称电子离域电子离域)形成大)形成大键(或称键(或称离域键离域键)。)。C C1 1=C=C2 2
24、和和C C3 3=C=C4 4两两键平面平行,都垂直键平面平行,都垂直键平面,键平面,p p轨道有轨道有一定的重叠,出现键长平均化现象。一定的重叠,出现键长平均化现象。CH3CH3CH2CH2CH CH CH2CH21234键长/nm 0.154 0.1373 0.1483 0.1373 0.134chapter 61,3-丁二烯的丁二烯的分子轨道分子轨道 2. 分子轨道理论处理结果分子轨道理论处理结果 四个碳的四个四个碳的四个p p轨道线性组合成四个分子轨道轨道线性组合成四个分子轨道y y1 1、y y2 2、y y3 3、y y4 4。能量。能量y y1 1y y2 2y y3 3y y4
25、 4。chapter 6 在基态,在基态,y y2是充填电子的最高能量轨是充填电子的最高能量轨道称为道称为HOMO; y y3是未填电子的最低能量轨道,称为是未填电子的最低能量轨道,称为LUMO。chapter 66.12 共轭体系及共轭效应共轭体系及共轭效应6.12.1 共轭体系共轭体系 6.12.2 共轭效应共轭效应6.12.3 共轭效应与诱导效应比较共轭效应与诱导效应比较6.12.4 离域体系的表达离域体系的表达共振论共振论chapter 6 共轭体系共轭体系:不饱和的化合物中,有三个或三个以上互相:不饱和的化合物中,有三个或三个以上互相平行的平行的p p轨道形成大轨道形成大键,这种体系
26、称为共轭体系。键,这种体系称为共轭体系。 电子离域电子离域:共轭体系中,:共轭体系中,电子云扩展到整个体系的电子云扩展到整个体系的现象称做电子离域或离域键。现象称做电子离域或离域键。 共轭效应共轭效应:电子离域,能量降低,分子趋于稳定,键:电子离域,能量降低,分子趋于稳定,键长平均化等现象称做共轭效应,也称做长平均化等现象称做共轭效应,也称做C C效应效应。 结构特点结构特点:共轭体系的特征是各:共轭体系的特征是各键在同一平面内,参键在同一平面内,参加共轭的加共轭的p p轨道轴互相平行,且垂直于轨道轴互相平行,且垂直于键所在的平面,相键所在的平面,相邻邻p p轨道间从侧面重叠发生键离域。轨道间
27、从侧面重叠发生键离域。6.12.1 共轭体系共轭体系chapter 61-共轭体系共轭体系 双键、单键相间的共轭体系称做双键、单键相间的共轭体系称做- -共轭共轭体系。体系。C C CCC CC CCC C OC CCN共轭体系的分子骨架称做共轭体系的分子骨架称做共轭链共轭链。的氢化焓的氢化焓 D DH=126.6 kJmol-1,的氢化焓的氢化焓 D DH=239 kJmol-1 126.6 2 - 239 = 14.2 kJmol-1,称为称为1,3-丁二烯丁二烯共轭能共轭能。chapter 6的氢化焓的氢化焓D DH=254 kJmol-1,的氢化焓的氢化焓D DH=226 kJmol-
28、1 254 - 226 = 28 kJ mol-1,称为称为1,3-戊二戊二烯烯共轭能。共轭能。共轭能共轭能:共轭体系的稳定能。:共轭体系的稳定能。chapter 62p-共轭体系共轭体系 双键相连的原子上的双键相连的原子上的p轨道与轨道与键的键的p轨道形成轨道形成的共轭体系称做的共轭体系称做 p-共轭共轭体系。体系。C C CI.C C O CH3.C C C.C C C-C C C+烯丙基结构烯丙基结构chapter 6 分子轨道理论处理烯丙基三个中间体的结果分子轨道理论处理烯丙基三个中间体的结果如下图:如下图:chapter 6 三个三个p轨道线性组合的三个轨道线性组合的三个分子轨道,分
29、子轨道,y y1 是成键轨道,是成键轨道,y y2是非键轨道,是非键轨道,y y3是反键轨道。是反键轨道。烯丙基碳正离子烯丙基碳正离子: 烯丙基碳自由基烯丙基碳自由基: 烯丙基碳负离子烯丙基碳负离子: 22CHCHCH+y2是LUMO;22CHCHCH.y3是LUMO;22HCCHCHy1是HOMO,22HCCHCHy2是HOMO22HCCHCHy2是HOMO,22CHCHCH-y3是LUMO。chapter 63超共轭体系超共轭体系 超共轭体系,比共轭体系作用弱,稳定性差,超共轭体系,比共轭体系作用弱,稳定性差,共轭能小。共轭能小。(1) -超共轭体系超共轭体系 丙烯分子中的甲基可绕丙烯分子
30、中的甲基可绕CC键旋转,旋转到某一角度键旋转,旋转到某一角度时,甲基中的时,甲基中的C-H键与键与C=C的的键在同一平面内,键在同一平面内,C-H键键轴与轴与键键p轨道近似平行,形成轨道近似平行,形成-共轭共轭体系体系, ,称为称为-超共轭超共轭体系。体系。CH2CHCHHH丙烯分子的丙烯分子的-超共轭体系超共轭体系chapter 6乙烯氢化焓乙烯氢化焓D DH=137 kJmol-1,丙烯的氢化焓丙烯的氢化焓D DH=126 kJmol-1,丙烯丙烯-超共轭能:超共轭能:137-126 =11 kJmol-1。1,3-戊二烯戊二烯 氢化焓氢化焓226 kJmol-1 -共轭共轭1,3-丁二烯
31、丁二烯 氢化焓氢化焓239 kJmol-1 -共轭共轭CH CHCH2CHCH2CH3CH3CH3稳定性稳定性: 键键的的-H越多,形成超共轭的机会越多,超共轭作用越多,形成超共轭的机会越多,超共轭作用越强。越强。 chapter 6(2) -p超共轭体系超共轭体系 C-H的的键轨道与键轨道与p轨道形成的共轭体系称做轨道形成的共轭体系称做-p超共轭超共轭体系。如乙基碳正离子即为体系。如乙基碳正离子即为-p超共轭超共轭体系。体系。乙基碳正离子乙基碳正离子-p超共轭体系超共轭体系chapter 6烷基碳自由基也能形成烷基碳自由基也能形成-p超共轭体系:超共轭体系:碳自由基的稳定性:碳自由基的稳定性
32、: 碳正离子的稳定性:碳正离子的稳定性: 3R+2R+1R+CH3C CHHHCHHHCHHH.C CHHHCHHHH.C CHHHH.3123CHRRRchapter 66.12.2 共轭效应(共轭效应(C效应)效应) 共轭链两端的原子的电负性不同,共轭体系共轭链两端的原子的电负性不同,共轭体系中电子离域有方向性,在共轭链上正电荷、负电中电子离域有方向性,在共轭链上正电荷、负电荷交替出现,沿共轭链一直传递下去,称为荷交替出现,沿共轭链一直传递下去,称为电子电子共轭效应共轭效应(又称(又称C效应效应)。电子共轭效应有吸电子)。电子共轭效应有吸电子共轭效应(共轭效应(C效应)和给电子共轭效应(效
33、应)和给电子共轭效应(+C效效应)。应)。chapter 61. 吸电子共轭效应(吸电子共轭效应(-C效应)效应) 电负性大的原子接在共轭链端上,使共轭电子电负性大的原子接在共轭链端上,使共轭电子向电负性大的元素端离域,称做向电负性大的元素端离域,称做吸电子共轭效应吸电子共轭效应。CHCHCH3COH+-+-CCCN+-+-2-丁烯醛丁烯醛 丙烯氰丙烯氰C O C NH C N 、 、 连到共轭链上有连到共轭链上有-C效应效应C OC NH-C效应效应: chapter 62. 给电子的共轭效应(给电子的共轭效应(+C效应)效应) 含有孤对电子的原子接在共轭链一端,使共轭含有孤对电子的原子接在
34、共轭链一端,使共轭电子背离有电子对的原子端离域,称为电子背离有电子对的原子端离域,称为给电子共轭给电子共轭效应效应(+C效应)。效应)。+-CH2CHCI.CH2CHO R+-.氯乙烯氯乙烯 乙烯基醚乙烯基醚 一些原子或基团一些原子或基团的的+C效应强度顺序:效应强度顺序:-NR2 -OR -F.-F -CI -Br -I.-OR -SR.-.+O OR OR2chapter 63 动态共轭效应动态共轭效应 静态共轭效应静态共轭效应:上面讨论的是在静止条件,由元素:上面讨论的是在静止条件,由元素电负性或原子电子对引起的共轭效应称静态共轭效应电负性或原子电子对引起的共轭效应称静态共轭效应。 动态
35、共轭效应动态共轭效应:在外电场的作用下,共轭体系产生的:在外电场的作用下,共轭体系产生的共轭电子沿共轭链共轭电子沿共轭链-、+传递的电荷交替现象称做动态共传递的电荷交替现象称做动态共轭效应。轭效应。CCCCCCCC+-+-Br Br+-静态共轭效应静态共轭效应动态共轭效应动态共轭效应 在化学反应中,动态共轭效应作用比静态共轭效应在化学反应中,动态共轭效应作用比静态共轭效应作用大得多。作用大得多。chapter 6极性交替出现极性交替出现极性变化是单一方向极性变化是单一方向极性效果极性效果远,从共轭链一端到远,从共轭链一端到另一端另一端短,一般不超过三个短,一般不超过三个共价键共价键传递距离传递
36、距离沿共轭链传递沿共轭链传递沿共价键传递,或空沿共价键传递,或空间(场效应)传递间(场效应)传递传递路线传递路线共轭方式共轭方式诱导方式诱导方式传递方式传递方式共轭体系中共轭体系中任何键上任何键上存在存在电负性,(共轭)电电负性,(共轭)电子对子对电负性电负性起源起源共轭效应共轭效应(C效应)效应)诱导效应(诱导效应(I效应)效应)共轭效应与诱导效应比较表共轭效应与诱导效应比较表6.12.3 共轭效应与诱导效应比较共轭效应与诱导效应比较chapter 61. 共振论提出的历史背景共振论提出的历史背景 为了解决用经典的路易斯结构式表达复杂的为了解决用经典的路易斯结构式表达复杂的电子离域系的矛盾,
37、鲍林在电子离域系的矛盾,鲍林在19311933年间提出年间提出了了“共振论共振论”。共振论是用经典的结构式表达电。共振论是用经典的结构式表达电子离域体系。子离域体系。6.12.4 离域体系的表达离域体系的表达共振论共振论chapter 62. 共振论的基本概念共振论的基本概念共振杂化体共振杂化体:对于电子离域体系的化学物种(包括分:对于电子离域体系的化学物种(包括分子、离子、自由基等),不能用一个经典结构式表示子、离子、自由基等),不能用一个经典结构式表示清楚其结构,可用几个可能的经典结构式表示,真实清楚其结构,可用几个可能的经典结构式表示,真实物种是这几个可能的经典结构的叠加物种是这几个可能
38、的经典结构的叠加共振杂化体。共振杂化体。共振结构共振结构:表示离域体系的可能的经典结构称做极限结:表示离域体系的可能的经典结构称做极限结构或共振结构。共振结构的叠加得到共振杂化体,共振构或共振结构。共振结构的叠加得到共振杂化体,共振杂化体才能较确切地代表真实物种的结构。杂化体才能较确切地代表真实物种的结构。chapter 61,3-丁二烯可用一系列共振结构表示:丁二烯可用一系列共振结构表示:CH CH CH2CH2CH CHCH2CH2CH CHCH2CH2+ 每个结构式叫每个结构式叫共振结构式共振结构式或或共振极限结构式共振极限结构式,“”双箭头符号表示共振结构之间的叠加或共振;双箭头符号表
39、示共振结构之间的叠加或共振;合起来表示真实的合起来表示真实的1,3-丁二烯。丁二烯。 共振杂化体是一单一物种,只有一个结构。共振共振杂化体是一单一物种,只有一个结构。共振结构式表示电子离域的极限度。结构式表示电子离域的极限度。 一个物种的共振结构式越多,电子离域的范围越一个物种的共振结构式越多,电子离域的范围越大,体系能量越低,物种越稳定。大,体系能量越低,物种越稳定。chapter 6 任何一个共振结构的能量都高于共振杂化体任何一个共振结构的能量都高于共振杂化体的能量,真实物种与最低能量的共振结构(最稳的能量,真实物种与最低能量的共振结构(最稳定的极限结构)的能量差称为定的极限结构)的能量差
40、称为共振能共振能。它是由电。它是由电子离域而获得的子离域而获得的稳定化能稳定化能,与共轭能是一致的。,与共轭能是一致的。 每个共振结构对其共振杂化体的贡献是不相每个共振结构对其共振杂化体的贡献是不相等的。共振结构越稳定,对共振杂化体的贡献越等的。共振结构越稳定,对共振杂化体的贡献越大。相同的共振结构贡献相等。大。相同的共振结构贡献相等。chapter 6 是是最稳定的极限结构,对杂化体贡献最稳定的极限结构,对杂化体贡献最大,它与真实分子的能量差为共振能;后面几个极限结构是最大,它与真实分子的能量差为共振能;后面几个极限结构是不稳定的,能量较高,对共振杂化体的贡献小,有时可以不考不稳定的,能量较
41、高,对共振杂化体的贡献小,有时可以不考虑虑; 和和 相同,对共振杂相同,对共振杂化体的贡献相等。化体的贡献相等。CH CHCH2CH2CH CHCH2CH2.+.CH CHCH2CH2+1,3-丁二烯的共轭能为丁二烯的共轭能为14 kJmol-1,可用下列共振结构表示:,可用下列共振结构表示:CH CH CH2CH2.CH CHCH2CH2+CH CHCH CHCH CHCH CHCH2CH2CH2CH2CH2CH2CH2CH2.CH CHCH2CH2.+chapter 63. 共振结构式书写规则共振结构式书写规则 在各共振结构式中,原子在空间的位置相同,在各共振结构式中,原子在空间的位置相同
42、,只是电子排布有差别只是电子排布有差别: :CH CH CH2CH2.+CH CHCH2CH2.+.RCOO.-RCOO.-CCH2CH3OHCOCH3CH3CH CH CH3CH2CICH2CH CHCI CH3同分异构体同分异构体互变异构体互变异构体chapter 6(2) 所有的共振结构式都要符合经典的路易斯结构所有的共振结构式都要符合经典的路易斯结构式,如碳的化合价为式,如碳的化合价为4价,第二周期元素的价电子价,第二周期元素的价电子数不多于数不多于8个等。个等。.CH3NOO.CH3NOO.CH3NOO.-+N变成十变成十个价电子个价电子C OHHHH-+碳变成碳变成5价价CH CH
43、CH2CH CH2CH2CH CH2CHCH2CH CH2CHCH2CH CH2CHCH2CH2CHCH2CH2CHCH2CH2CHCH2H2C CHCH2.+.+.chapter 6(3) 所有共振结构式中,配对电子或不配对电子数所有共振结构式中,配对电子或不配对电子数目保持一致。目保持一致。 CH CHCH2CH CH2CH2CH CH2CHCH2CH CH2CHCH2CH CH2CHCH2CH2CHCH2CH2CHCH2CH2CHCH2H2C CHCH2.+.+.chapter 64. 共振结构的相对稳定性共振结构的相对稳定性(1) 极限结构式中共价键越多越稳定极限结构式中共价键越多越稳
44、定CH CH CH2CH2CH CHCH2CH2.+.CH CHCH2CH2+稳定稳定 不稳定不稳定 不稳不稳定定(2) 价电子层中达满电子数(惰性气体结构)结构稳定价电子层中达满电子数(惰性气体结构)结构稳定O CH3CH2.+O CH3CH2+稳定稳定碳价电子层碳价电子层6个价电子个价电子(3) 电荷分离的共振结构稳定性小电荷分离的共振结构稳定性小.CH2CH CI.CH CICH2.+稳定稳定 电荷分离电荷分离 不稳定不稳定chapter 65. 共振结构对杂化体的贡献比较共振结构对杂化体的贡献比较(1) 等同的共振结构贡献相等等同的共振结构贡献相等贡献相等贡献相等 贡献相等贡献相等(2
45、) 共价键数多的共振结构贡献大共价键数多的共振结构贡献大CH CHCH2CH2CH CH CH2CH2.+贡献大贡献大chapter 6(3) 电荷没有分离的共振结构贡献大电荷没有分离的共振结构贡献大(4) 原子价电子数目达到惰性气体原子电子结构的贡献大原子价电子数目达到惰性气体原子电子结构的贡献大(5) 键键长、键角变形小的贡献大长、键角变形小的贡献大.CH CICH2.+.CH2CH CI.贡献大贡献大贡献大贡献大O CH3CH2.+O CH3CH2+贡献大贡献大chapter 66. 共振论的应用共振论的应用(1) 可以解释电子离域体系中很多结构与性质方面的问题可以解释电子离域体系中很多
46、结构与性质方面的问题 可进行可进行1,2-加成,也可以进行加成,也可以进行1,4-加成,两种加成生成的加成,两种加成生成的活性中间体也存在共振,如加质子酸:活性中间体也存在共振,如加质子酸:1,3-丁二烯有下列共振表示:丁二烯有下列共振表示: CH CH CH2CH2CH CHCH2CH2.+CH CHCH2CH2.+CH2CH3CH CH+CH3CH CH CH2+chapter 6(2) 可帮助判断反应进行的难易和反应机理可帮助判断反应进行的难易和反应机理例例1. 1. 氯乙烯的氯不易被取代,因为存在下列共振氯乙烯的氯不易被取代,因为存在下列共振.CH CICH2.+.CH2CH CI.加
47、强了加强了C-C键键例例2.2.丙烯的丙烯的- -氢易进行自由型卤代反应,氢易进行自由型卤代反应,3-氯丙烯易进行氯丙烯易进行SN1取代反应,因为这两种取代反应生成的中间体有下列共取代反应,因为这两种取代反应生成的中间体有下列共振振:CH2CHCH2CH2CH2CHCH2CHCH2CH2CH2CH.+chapter 6 7. 共振论的局现性共振论的局现性 共振论在有机化学中用起来比较方便,能解释电共振论在有机化学中用起来比较方便,能解释电子离域体系的一些实验现象,但也存在一些问题,如共子离域体系的一些实验现象,但也存在一些问题,如共振论认为共振结构只是写出来的,实际上是不存在的。振论认为共振结
48、构只是写出来的,实际上是不存在的。又如环丁二烯与苯有相似的共振结构,但环丁二烯比苯又如环丁二烯与苯有相似的共振结构,但环丁二烯比苯活泼得多。这些都是共振论所不好解释的。活泼得多。这些都是共振论所不好解释的。 环丁二烯:环丁二烯: 苯:苯:chapter 66.13 共轭二烯烃的化学性质共轭二烯烃的化学性质6.13.1 共轭加成反应共轭加成反应6.13.2 聚合与共聚合反应聚合与共聚合反应6.13.3 电环化反应电环化反应6.13.4 双烯合成反应双烯合成反应chapter 61. 1,4加成(共轭加成)加成(共轭加成) 共轭二烯烃的官能团是共轭二烯烃的官能团是 ,应该即有单烯应该即有单烯烃的性
49、质,又应该有特殊性质。烃的性质,又应该有特殊性质。C C CC 共轭二烯能进行亲电加成,其加成反应比单烯烃容易,共轭二烯能进行亲电加成,其加成反应比单烯烃容易,也能进行催化加氢。也能进行催化加氢。1,3-丁二烯与一分子亲电试剂加成,生丁二烯与一分子亲电试剂加成,生成两种产物:成两种产物:6.13.1 共轭加成反应共轭加成反应CH CH CH2CH2Br2CHCH2CH2CHBrBrCH CHCH2BrBrCH2+3,4-二溴二溴-1-丁烯丁烯 1,2-加成加成1,4-二溴二溴-2-丁烯丁烯 1,4-加成加成chapter 61,2-加成加成:打开一个:打开一个键,试剂加到键,试剂加到键的两个碳
50、原键的两个碳原子上,这种加成与单烯烃加成反应一样,称为子上,这种加成与单烯烃加成反应一样,称为1,2-加成。加成。1,4-加成加成:打开两个:打开两个键,试剂加到两个键,试剂加到两个键的两端键的两端碳原子上,中间两个碳原子间形成一个新碳原子上,中间两个碳原子间形成一个新键,称键,称为为1,4-加成加成,也称为,也称为共轭加成。共轭加成。chapter 62. 影响影响1,4-加成的因素加成的因素 影响因素有反应物结构、试剂和溶剂的性质、产物的影响因素有反应物结构、试剂和溶剂的性质、产物的稳定性质,反应温度等。稳定性质,反应温度等。CH CH CH2CH2Br2CHCH2CH2CHBrBrCH
51、CHCH2BrBrCH2+极性溶剂中(极性溶剂中(40) 70% 30%非极性溶剂中(非极性溶剂中(-15) 46% 54% +HBr -80 19% 81% 45 85% 15% 极性溶剂有利于极性溶剂有利于1,4-加成,非极性溶剂有利于加成,非极性溶剂有利于1,2-加成。加成。反应温度的影响比较明显,低温有利于反应温度的影响比较明显,低温有利于1,2-加成,高温有加成,高温有利于利于1,4-加成。加成。chapter 6 反应物结构有影响反应物结构有影响,2,3-二甲基丁二烯与溴反应,主要二甲基丁二烯与溴反应,主要得反式得反式-2,3-二甲基二甲基-1,4-二溴二溴-2-丁烯:丁烯:C C
52、CH2CH2CH3CH3C CCH3BrCH2CH2BrCH3Br2CCl4+反应温度也有影响:反应温度也有影响:CH CHBrCH3CH2BrCH2CH2CH CHCH3CHCH CH2BrH+8081% 19%1,2-加成,遵守不对称烯烃加成规律加成,遵守不对称烯烃加成规律。HBrchapter 63. 1,4-加成反应的解释加成反应的解释 1,3-丁二烯与丁二烯与HCl反应,先加上一个反应,先加上一个H+生成碳生成碳正离子中间体,烯丙基碳正离子稳定,因此主要是正离子中间体,烯丙基碳正离子稳定,因此主要是生成烯丙基碳正离子:生成烯丙基碳正离子: CH CHCH2CH2+-+-CH2CHCH
53、2CH2+CH2CHCHCH3+H CI+-+chapter 6可以进行可以进行1,2-加成,也可以进行加成,也可以进行1,4-加成加成CH CH2CH3CH+CH3CH CH CH2+比比 稳定,低温稳定,低温下下1,2-加成容易加成容易。 的空间位阻小,的空间位阻小,在极性溶液中主要是在极性溶液中主要是1,4-加成加成。CH3CH CHCH2+CH CH2CH3CHCH3CHCH CH2+共振论观点:共振论观点:分子轨道计算结果:分子轨道计算结果:1,2-加成加成 1,4-加成加成chapter 64. 热力学控制与动力学控制热力学控制与动力学控制第一个过渡态能量较高,第一个过渡态能量较高
54、,是决定反应速率步骤;是决定反应速率步骤;第二个过渡态能量较低,第二个过渡态能量较低,决定是决定是1,2-加成还是加成还是1,4-加成。加成。chapter 6动力学控制动力学控制:1,2-加成活化加成活化能小,低温下反应速率快,能小,低温下反应速率快,产物由反应速度决定,产物由反应速度决定,称为动力学控制。称为动力学控制。 热力学控制热力学控制:1,4-加成产物稳定,在较高温度下,加成产物稳定,在较高温度下,1,2-加成反应活化能与加成反应活化能与1,4-加成活化能差加成活化能差(D DE1,4-D DE1,2)不重要,产物组成由产物稳定性决定,不重要,产物组成由产物稳定性决定,称为热力学控
55、制。称为热力学控制。chapter 6较高温度较高温度较高温度较高温度(少)(少)(多)(多)1,3-丁二烯与丁二烯与1 mol HBr反应,反应,45得到平衡产物得到平衡产物:BrCH3CHCH CH2BrHCH3CH CHCH2Br4515% 85%chapter 65. 三键双键共轭体系的三键双键共轭体系的1,4-加成加成乙烯基乙炔是共轭体系,能与乙烯基乙炔是共轭体系,能与HCl加成:加成:+-CH2CH C CHCH C CH2CH2CH C CH2CH2CICIHCI+ 1,4-加成生成累积二烯烃不稳定,重排得到加成生成累积二烯烃不稳定,重排得到2-氯氯-1,3-丁丁二烯。二烯。2-
56、氯氯-1,3-丁二烯是制备氯丁橡胶的单体。丁二烯是制备氯丁橡胶的单体。chapter 61. 1,3-丁二烯齐聚反应丁二烯齐聚反应(1) 环二聚反应环二聚反应 共轭二烯烃有两个共轭二烯烃有两个键,像单烯烃一样能进行键,像单烯烃一样能进行齐聚反应,高聚反应,也可以进行共聚反应。齐聚反应,高聚反应,也可以进行共聚反应。Ni/PR32两分子丁二烯进行两分子丁二烯进行1,2-加成的结果加成的结果6.13.2 聚合与共聚合反应聚合与共聚合反应chapter 6Ni/PR32一分子一分子1,2-加成,一分子加成,一分子1,4-加成的结果加成的结果Ni/PR32两分子丁二烯两分子丁二烯1,4-加成的结果加成
57、的结果chapter 6(2)环三聚反应环三聚反应 1,3-丁二烯在零价镍催化下环三聚反应主要得丁二烯在零价镍催化下环三聚反应主要得到反式到反式-1,5,9-环十二碳三烯:环十二碳三烯:(COD)2Ni390%产物是阻燃剂的原料。产物是阻燃剂的原料。2. 聚合反应聚合反应 2-甲基甲基-1,3-丁二烯聚合得顺式聚异戊二烯,其结构和性丁二烯聚合得顺式聚异戊二烯,其结构和性质与从橡胶树中得到的天然橡胶相同,故称为合成天然橡胶。质与从橡胶树中得到的天然橡胶相同,故称为合成天然橡胶。异戊二烯异戊二烯 聚异戊二烯聚异戊二烯合成天然橡胶合成天然橡胶chapter 6 1,3-丁二烯用丁二烯用环烷酸镍环烷酸
58、镍/ /三异丁基铝三异丁基铝催化剂进行聚合反应催化剂进行聚合反应得到顺式结构含量大于得到顺式结构含量大于96%的的1,4-聚丁二烯(又称顺丁橡聚丁二烯(又称顺丁橡胶),在低温下有很好的弹性,又耐磨,常用作轮胎。胶),在低温下有很好的弹性,又耐磨,常用作轮胎。nn( )顺式顺式-聚丁二烯聚丁二烯 用用烯丙基碘化镍烯丙基碘化镍作催化剂,可以得反式结构大于作催化剂,可以得反式结构大于99%的的1,4-聚丁二烯:聚丁二烯:nn( )反式反式-聚丁二烯聚丁二烯chapter 6 用用丁基锂丁基锂/ /醚醚催化催化1,3-丁二烯聚合反应,可使一部分丁二烯聚合反应,可使一部分1,3-丁二烯丁二烯1,2-聚合
59、,一部分聚合,一部分1,4-聚合,得到含聚合,得到含1,2-聚合结构聚合结构在在25% 65%的乙烯基聚丁二烯:的乙烯基聚丁二烯:CH2CH CHCH CH2CH2CH2CH1,4- 1,2-也可以得到高也可以得到高1,2-聚合结构的聚丁二烯:聚合结构的聚丁二烯:H2C CH CH CH2nCHHC CH2CH2nchapter 63. 共聚合反应共聚合反应 1,3-丁二烯可以与苯乙烯、丙烯腈、甲基丙烯酸甲酯等单丁二烯可以与苯乙烯、丙烯腈、甲基丙烯酸甲酯等单体进行共聚合反应,得到不同性能的高聚物:体进行共聚合反应,得到不同性能的高聚物:(1) 1,3-丁二烯与苯乙烯共聚合丁二烯与苯乙烯共聚合C
60、H CH CH2CH2CHCH2nn+苯乙烯苯乙烯 弹性体弹性体 聚聚- -1,4 - -丁二烯苯乙烯是弹性体,又称丁苯橡胶,是目丁二烯苯乙烯是弹性体,又称丁苯橡胶,是目前合成橡胶中产量最大的品种。前合成橡胶中产量最大的品种。chapter 6(2) 1,3-丁二烯,苯乙烯、丙烯腈共聚合丁二烯,苯乙烯、丙烯腈共聚合 这种聚合物性能优异,是广泛使用的工程塑料,通这种聚合物性能优异,是广泛使用的工程塑料,通常称常称ABS树脂。树脂。丁二烯丁二烯 苯乙烯苯乙烯 丙烯腈丙烯腈聚丁二烯、聚苯乙烯、聚丙烯腈嵌段聚合物聚丁二烯、聚苯乙烯、聚丙烯腈嵌段聚合物CNCH CHCH2CH2CHCH2CH2CHCN(
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 帮助考生的监理工程师试题及答案
- 学术论文投资咨询工程师试题及答案
- 完善备考育婴师考试试题及答案清单
- 全方位支持的陪诊师考试试题及答案
- 动物行为矫正初步试题及答案
- 2024年人力资源管理师考前资料试题及答案
- 黑龙江省七台河市重点中学2024-2025学年高三下第11次大练习英语试题含解析
- 传感器与检测技术课件 项目一识别与选用传感器1.1 识别传感器
- 黑龙江省哈尔滨三十二中2025届高三历史试题周练试卷含解析
- 黑龙江省哈尔滨市尚志市达标名校2025年初三中考冲刺压轴卷(一)化学试题含解析
- 2024年山东省济南市莱芜区中考一模化学试题
- 人教B版新课标高中数学选择性必修第三册电子课本
- 广东省深圳市宝安区2022-2023学年八年级下学期期中语文试题
- 2024年房屋租赁合同电子版pdf
- 【高尔夫挥杆技术训练探究8700字(论文)】
- 国际航空货运代理实务
- 《咯血的诊治》课件2
- 火力发电厂消防知识培训课件
- MSOP(测量标准作业规范)测量SOP
- 仓库温湿度记录表
- 营养风险筛查(NRS2002)解读

评论
0/150
提交评论