



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第二节第二节元素周期律和元素周期表元素周期律和元素周期表原子序数:原子序数: 不同的元素具有不同的核电荷数即质子数。不同的元素具有不同的核电荷数即质子数。为了研究方便,我们把不同的元素按核电荷数为了研究方便,我们把不同的元素按核电荷数由小到大的顺序对其进行编号,这种编号又叫由小到大的顺序对其进行编号,这种编号又叫原子序数。原子序数。原子序数原子序数 核电荷数核电荷数(质子数)(质子数)1-18号元素核外电子排布号元素核外电子排布原子序数与最外层电子数直方图原子序数与最外层电子数直方图原子序数原子序数 电子层数电子层数 最外层电最外层电子数子数 达到稳定结构达到稳定结构时的最外层电时的最外层电子
2、数子数 12 310 1118 结论:随着原子序数的递增,元素原子的最外层电子结论:随着原子序数的递增,元素原子的最外层电子排布呈现排布呈现 变化。变化。 123121818882周期性周期性原子半径原子半径原子序数与原子半径折线图原子序数与原子半径折线图原子序数原子序数 原子半径的变化原子半径的变化 391117 结论:随着原子序数的递增,元素原子半结论:随着原子序数的递增,元素原子半径呈现径呈现 变化。变化。 逐渐减小逐渐减小逐渐减小逐渐减小周期性周期性思考题:思考题: 粒子半径的大小与哪些因素有关?粒子半径的大小与哪些因素有关?怎样根据粒子结构示意图来判断原子怎样根据粒子结构示意图来判断
3、原子半径和简单离子半径半径和简单离子半径的大小呢?的大小呢? 粒子半径粒子半径核电荷数核电荷数电子层数电子层数核外电子数核外电子数1.当电子层数及核电荷数均不相同时,电子层数越多,当电子层数及核电荷数均不相同时,电子层数越多, 半径越大。半径越大。2.当电子层数相同,核电荷数不相同时,核电荷数越大,当电子层数相同,核电荷数不相同时,核电荷数越大, 半径越小。半径越小。3.当电子层数相同,核电荷数相同时,最外层电子数目越多,当电子层数相同,核电荷数相同时,最外层电子数目越多, 半径越大半径越大【课堂练习】1.下列化合物中阳离子半径与阴离子半径比值最小下列化合物中阳离子半径与阴离子半径比值最小的是
4、(的是( )A.NaF B.MgI2 C.BaI2 D.KBrB2.下列各组微粒半径大小比较中,不正确的是(下列各组微粒半径大小比较中,不正确的是( )A. r(K) r(Na) r(Li)B. r(Mg2+) r(Na+) r(F-)C. r(Na+) r(Mg2+) r(Al3+)D. R(Cl -) r(F-) r(F)B元素化合价原子序数原子序数 化合价的变化化合价的变化 12 310 1118 结论:随着原子序数的递增,元素化合价呈现结论:随着原子序数的递增,元素化合价呈现 变化。变化。 101517410410周期性周期性思考:思考: 化合价和原子结构的哪些因素有化合价和原子结构的
5、哪些因素有关?关?最高正价最外层电子数最高正价最外层电子数负价负价=最外层电子数最外层电子数81.在水溶液中:在水溶液中:YO3n-3S2-6H+=Y-+3S +3H2O(1)YO3n-中中Y元素的化合价是:元素的化合价是:(2)Y元素原子的最外层电子数是:元素原子的最外层电子数是:(3)比较比较S2-和和Y-的还原性:的还原性:2.元素元素R的最高价含氧酸的化学式为的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中则在气态氢化物中R元素的化合价为(元素的化合价为( ) A.12-3n B. 3n-12 C.4-3n D.3n-4A+57S2- Y- 随着随着原子序数原子序数的递增,核
6、外的递增,核外电子排布、原子半径、化合价等电子排布、原子半径、化合价等元素的性质呈周期性变化。元素的性质呈周期性变化。 这个规律叫这个规律叫元素周期律元素周期律。元素性质元素性质的周期性变化是的周期性变化是核外电子排布周期核外电子排布周期性变化性变化的必然结果的必然结果元素周期表 18691869年门捷列夫在继承和分析了年门捷列夫在继承和分析了前人工作的基础上,对大量实验前人工作的基础上,对大量实验事实进行了订正、分析和概括,事实进行了订正、分析和概括,成功地对元素进行了科学分类成功地对元素进行了科学分类。他总结出一条规律:元素(以及他总结出一条规律:元素(以及由它所形成的单质和化合物)的由它
7、所形成的单质和化合物)的性质随着相对原子质量的递增而性质随着相对原子质量的递增而呈现周期性的变化。这就是元素呈现周期性的变化。这就是元素周期。周期。 他还预言了一些未知元素的性质他还预言了一些未知元素的性质都得到了证实。但是由于时代的局都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原形成元素性质周期性变化的根本原因。因。螺旋型周期表螺旋型周期表这么多种元素,是按这么多种元素,是按照怎样的规律排布在照怎样的规律排布在周期表中的呢?周期表中的呢?一、周期表的编排原则一
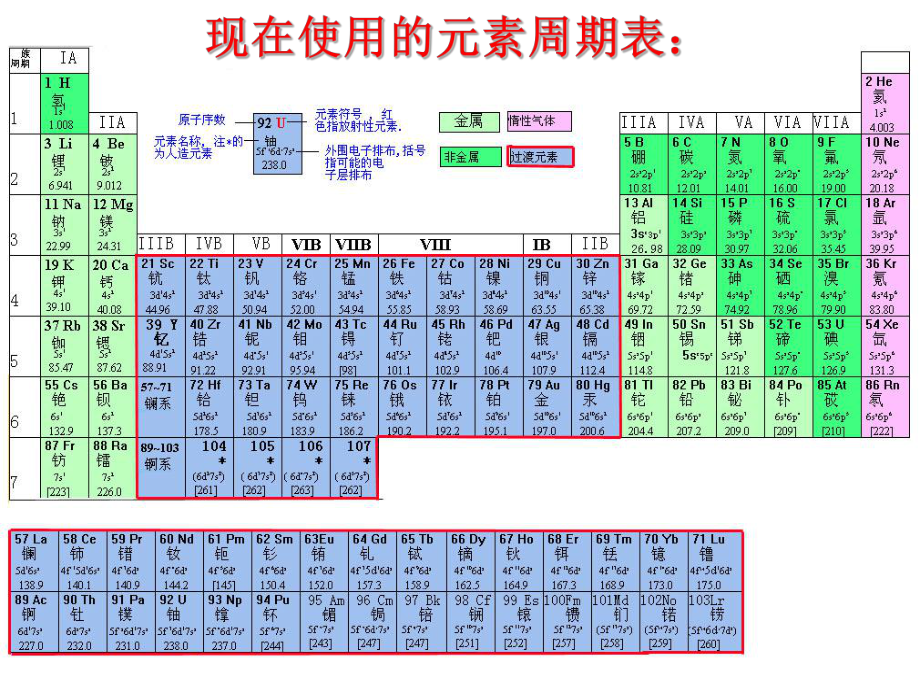
8、、周期表的编排原则原子序数递增原子序数递增电子层数相同电子层数相同最外层电子数相同最外层电子数相同电子层数递增电子层数递增元素周期律元素周期律1. 编制的依据:编制的依据:把把的元素排成一个横行的元素排成一个横行按按的顺序从左到右排列的顺序从左到右排列把把的元素排成一个纵行的元素排成一个纵行按按的顺序从上到下排成的顺序从上到下排成 横行横行纵行纵行(He例外例外)1234567短周期短周期长周期长周期种类种类28818181、周期、周期二、周期表的结构二、周期表的结构电子层数相同,原子序数递增电子层数相同,原子序数递增3226不完全周期不完全周期元素周期表的结构周期周期短周期短周期长周期长周期
9、第第1周期:周期:2 种元素种元素第第2周期:周期:8 种元素种元素第第3周期:周期:8 种元素种元素第第4周期:周期:18 种元素种元素第第5周期:周期:18 种元素种元素第第6周期:周期:32 种元素种元素不完全周期不完全周期第第7周期:周期:26种元素种元素镧镧57La 镥镥71Lu 共共15 种元素称镧系元素种元素称镧系元素锕锕89Ac 铹铹103Lr 共共15 种元素称锕系元素种元素称锕系元素(行行)周期序数周期序数 = 电子层数电子层数 原子结构原子结构相同点相同点:递变规律递变规律最外层电子最外层电子1-8原子半径逐渐减小原子半径逐渐减小电子层数相同电子层数相同VIII 零族零族
10、 0副族副族IA 主族主族 IIAIIIAIVAVAVIAVIIA7个个 IBIIBIIIBIVBVBVIBVIIB第八族第八族7个个2、族、族 用罗马数字表示序数用罗马数字表示序数元素周期表的结构 族族主族主族:副族:副族:A A A A A A A 第第VIII 族:族:稀有气体元素稀有气体元素(列列) 零族零族:共七个主族共七个主族B B B B B B B 共七个副族共七个副族三个纵行,位于三个纵行,位于 B 与与B中间中间 主族序数主族序数 = 最外层电子数最外层电子数=最高正价最高正价 原子结构原子结构相同点相同点:递变规律递变规律最外层数电子相同最外层数电子相同电子层数增多电子层
11、数增多原子半径增大原子半径增大元素周期表元素周期表周期周期个(共个(共个横行)个横行)族族个(共个(共个纵行)个纵行)短周期(第短周期(第周期)周期)长周期(第长周期(第周期)周期)不完全周期(第不完全周期(第周期)周期)主族主族个,用个,用字母表示字母表示副族副族个,用个,用字母表示字母表示第第族族个,包括个,包括纵行纵行族族1个(稀有气体)个(稀有气体)7161871.2.34.5.677A7B130元素周期表的结构:元素周期表的结构:七个周期分长短;七个周期分长短;三短、三长、一不全。三短、三长、一不全。十八纵行十六族;十八纵行十六族;七主七主 、 七副七副 、 VIII与与 0。思思
12、考考 题题 观察元素周期表中,从观察元素周期表中,从B到到B之间的元素之之间的元素之间存在哪些共同特征?间存在哪些共同特征?且只包括且只包括族、副族元素;族、副族元素;非金属元素都属于主族和零族。非金属元素都属于主族和零族。都是金属元素,统称作都是金属元素,统称作过渡金属。过渡金属。1、在元素周期表中,原子最外电子层只有、在元素周期表中,原子最外电子层只有1个或个或2个电子的元素是个电子的元素是( ) A金属元素金属元素 B稀有气体元素稀有气体元素 C非金属元素非金属元素 D无法确定为哪一类元素无法确定为哪一类元素D小练习小练习1、同周期元素,其原子结构相同之处是:、同周期元素,其原子结构相同
13、之处是: A、最外层电子数、最外层电子数 B、核电荷数、核电荷数 C、电子层数、电子层数 D、核外电子数、核外电子数2、周期表填空:、周期表填空:原子序数为原子序数为17的元素的符号是的元素的符号是 ,位,位于于 周期,周期, 族。族。Cl三三A3.已知已知a为为 A族元素,族元素,b为为 A族元族元 素,且它们的原子序数分别为素,且它们的原子序数分别为m和和n, 且且a、b为同一周期,关系式必定错为同一周期,关系式必定错 误的是误的是( ) A.n=m+10 B. n=m+1C. n=m+11 D. n=m+25A4.4.下列各表为周期表的一部分(表中为下列各表为周期表的一部分(表中为原子序
14、数),其中正确的是(原子序数),其中正确的是( )(A A) (B B)(C C) (D D)2341119210 1118 19611 12 1324671431 32D原子 N S O Si 半径/nm 0.075 0.102 0.074 0.117 5. 已知下列元素的原子半径为:已知下列元素的原子半径为: 根据以根据以上数据,磷原子的半径可能是(根据以根据以上数据,磷原子的半径可能是( ) A 0.080nmB 0.110nm C. 0.120nmD. 0.070nmB 练习与思考:练习与思考:6 6、下列各表为周期表的一部分(表中为原子序数),、下列各表为周期表的一部分(表中为原子序
15、数),其中正确的是(其中正确的是( )(A A) (B B)(C C) (D D)2341119210 1118 19611 12 1324671431 32D7、写出、写出114号元素的原子结构示意图,并说明它在号元素的原子结构示意图,并说明它在元素周期表位置,是金属还是非金属?元素周期表位置,是金属还是非金属?第七周期第七周期IVA族族金属金属8、下列元素中,、下列元素中, Na 、Fe Cu He K F(1)属于短周期的主族元素是:)属于短周期的主族元素是: 。 (2)属于长周期的主族元素是:)属于长周期的主族元素是: 。(3)属于非金属主族元素是:)属于非金属主族元素是: 。(4)属
16、于零族元素是:)属于零族元素是: 。(5)属于副族元素是:)属于副族元素是: 。(6)属于第八族元素是:)属于第八族元素是: 。NaFKFHeCuFe9、写出下列、写出下列1-20号元素符号:号元素符号:(1)Na元素的原子序数为元素的原子序数为11,相邻的同族元素是:,相邻的同族元素是: (2)短周期元素中,族序数周期序数的元素有:)短周期元素中,族序数周期序数的元素有: (3)族序数等于周期序数)族序数等于周期序数2倍的元素有:倍的元素有: (4)周期序数族序数)周期序数族序数2倍的有:倍的有:Li、KH、Be 、 Al S Li、a 10、在短周期元素中,原子最外电子层只有、在短周期元素
17、中,原子最外电子层只有1个或个或2个电子的元素是个电子的元素是( )A金属元素金属元素 B稀有气体元素稀有气体元素C非金属元素非金属元素 D无法确定为哪一类元素无法确定为哪一类元素D12、X、Y是短周期元素,两者形成化合物是短周期元素,两者形成化合物X2Y3,若,若Y的原子序数为的原子序数为 n , 则则X的原子序数不可能为(的原子序数不可能为( ) A. n + 8 B).n3 C. n11 D. n + 5 A11、已知、已知A是是a号元素,则核内质子数为:号元素,则核内质子数为: , An -中的核外电子数为:中的核外电子数为: 。已知已知An+ 的核外电子数为的核外电子数为b,则,则0
18、.5mol的的An+ 中核内质子中核内质子数是数是 mola + na0.5(b+n)练习:练习: 13、下列递变情况、下列递变情况 的是:的是: A. Na、Mg、Al最外层电子数依次增多,其单最外层电子数依次增多,其单 质的还原性依次减弱质的还原性依次减弱 B. P、S、Cl最高正价依次升高,对应气态氢化最高正价依次升高,对应气态氢化 物稳定性增强物稳定性增强 C. C、N、O原子半径依次增大原子半径依次增大 D. Na、K、Rb氧化物对应的水化物碱性依次增强氧化物对应的水化物碱性依次增强不正确不正确 C15、同一横行、同一横行X、Y、Z三种元素,已知最高价氧化物三种元素,已知最高价氧化物
19、对应的水化物的酸性是对应的水化物的酸性是 HXO4 H2YO4 H3ZO4,则,则下列说法判断下列说法判断 的是的是 A. 阴离子半径阴离子半径 X Y Z B. 气态氢化物稳定性气态氢化物稳定性 HX H2Y ZH3 C. 元素的元素的非金属性非金属性 X Y Z D. 单质的氧化性单质的氧化性 X Y Z错误错误 A14、写出、写出Na、Al、S、Cl元素的离子半径大小顺序:元素的离子半径大小顺序: 阳离子半径比原子半径小,阴离子半径比原子半径大;阳离子半径比原子半径小,阴离子半径比原子半径大;具有相同核外电子层排布的离子,核电荷数大的离子半具有相同核外电子层排布的离子,核电荷数大的离子半
20、径小。径小。 16.16.下列有关元素周期律的叙述,正确的是(下列有关元素周期律的叙述,正确的是( ) A. A. 元素周期律的本质是元素原子核外电子排布呈周元素周期律的本质是元素原子核外电子排布呈周期性变化期性变化 B. B. 元素周期律的本质是原子半径呈周期性变化元素周期律的本质是原子半径呈周期性变化 C. C. 元素周期律的本质是元素的性质随原子序数的递元素周期律的本质是元素的性质随原子序数的递增呈周期性变化增呈周期性变化 D. D. 元素周期律的本质是元素的性质随原子量的递增元素周期律的本质是元素的性质随原子量的递增而呈周期性变化而呈周期性变化练习:练习:A1717、下列性质的递变中,
21、正确的是、下列性质的递变中,正确的是( )( ) A A、O O、S S、NaNa的原子半径依次增大的原子半径依次增大 B B、LiOHLiOH、KOHKOH、CsOHCsOH的碱性依次增强的碱性依次增强 C C、HFHF、NHNH3 3、SiHSiH4 4的稳定性依次增强的稳定性依次增强 D D、HClHCl、HBrHBr、HIHI的还原性依次减弱的还原性依次减弱 ABAB错错18、判断正误:每一周期元素中都是以碱金属、判断正误:每一周期元素中都是以碱金属开始,以稀有气体结束。开始,以稀有气体结束。第一周期以第一周期以H元素开始。元素开始。19、下列各组中,属于同位素的是:(、下列各组中,属
22、于同位素的是:( )AH2、D2、T2 B .金刚石和足球烯金刚石和足球烯C60 C . H2O和和D2O D . 16O和和18OD 质子数相同,电子总数相同的粒子互称质子数相同,电子总数相同的粒子互称等电子体等电子体,它们结构相似,物质性质相近。,它们结构相似,物质性质相近。 如如N2和和CO,N2O和和CO2看,那里坐着一个人看,那里坐着一个人, 带着紫红色的礼(锂)帽,带着紫红色的礼(锂)帽,腰扎黄绿色的钡带,腰扎黄绿色的钡带,坐在含钙的红砖上,坐在含钙的红砖上,正用他那刻有紫色金鱼(铷)的绿色铜剪刀正用他那刻有紫色金鱼(铷)的绿色铜剪刀,修理他那蜡(钠)黄蜡黄的浅指(紫)甲(钾)修理
23、他那蜡(钠)黄蜡黄的浅指(紫)甲(钾),还不时鼓起他那洋红色的腮(锶)帮子还不时鼓起他那洋红色的腮(锶)帮子。焰色反应口诀焰色反应口诀一、元素的性质与元素在周期表中位置的关系一、元素的性质与元素在周期表中位置的关系性质性质+ 3 5278 1 8第三节 元素周期表的应用原子结构原子结构元素在周期表中的位置元素在周期表中的位置决定决定决定决定第四周期第四周期第第A族族较强的非金属较强的非金属性性原子结构原子结构决定决定反映反映元素性质元素性质决定决定反映反映元素在表中位置元素在表中位置反映反映决定决定二、元素金属性与非金属 性强弱的判断方法判断元素金属性强弱的依据判断元素金属性强弱的依据单质与水
24、或酸置换出氢的难易程度;单质与水或酸置换出氢的难易程度;(即反应的剧烈程度)(即反应的剧烈程度) 最高价氧化物对应水化物的碱性强弱;最高价氧化物对应水化物的碱性强弱; 金属间的置换反应。金属间的置换反应。 判断元素非金属性强弱的依据判断元素非金属性强弱的依据单质与氢气化合的难易程度;单质与氢气化合的难易程度;生成氢化物的稳定性;生成氢化物的稳定性; 最高价氧化物对应水化物酸性强弱;最高价氧化物对应水化物酸性强弱; 非金属单质间的置换反应非金属单质间的置换反应 。三、认识同周期元素 的递变规律 第一组实验:第一组实验:NaNa、MgMg与水的反应与水的反应金属性:金属性:Na MgNa Mg反反
25、 应应 物物 现现 象象 方方 程程 式式 Na Na、水、水、 酚酞酚酞 Mg Mg、水、水、 酚酞酚酞 大量气泡、溶液变红大量气泡、溶液变红加热前加热前无明显现象,无明显现象, 加热后加热后大量气泡,大量气泡, 红色明显红色明显 2Na + 2H2O 2NaOH + H2 Mg + 2H2O Mg(OH)2 + H2 (缓慢缓慢)第二组实验:第二组实验:Mg、Al与盐酸反应与盐酸反应 反反 应应 物物 现现 象象 离子方程式离子方程式 Mg、盐酸、盐酸 Al、盐酸、盐酸 反应迅速,产生反应迅速,产生大量气泡大量气泡反应较慢,缓反应较慢,缓缓产生气泡缓产生气泡金属性:金属性:Mg AlMg
26、+ 2H+ Mg2+ +H2 2Al + 6 H+ 2Al 3+ + 3H2 现象:现象: 白色沉淀白色沉淀Mg(OH)2白色沉淀白色沉淀Al(OH)3加稀硫酸加稀硫酸加加NaOH溶液溶液 加稀硫酸加稀硫酸 加加NaOH溶液溶液现象:现象:NaOH溶液溶液MgCl2溶液溶液AlCl3溶液溶液第三组实验第三组实验金属元素性质金属元素性质NaMgAl单质和水(或酸)单质和水(或酸)的反应情况的反应情况最高价氧化物对最高价氧化物对应水化物碱性应水化物碱性跟冷水剧跟冷水剧烈反应烈反应NaOH强碱强碱跟沸水反应跟沸水反应放放H2;跟酸;跟酸剧烈反应放剧烈反应放H2Mg(OH)2中强碱中强碱跟酸较为跟酸较
27、为迅速反应迅速反应放放H2Al(OH)3两性两性氢氧化物氢氧化物结论:结论:Na Mg Al金属性逐渐减弱金属性逐渐减弱性性 质质SiSiP PS SClCl非金属单质非金属单质与氢气反应与氢气反应的条件的条件高高 温温(生成少量生成少量)须加热须加热最最高价含高价含氧酸氧酸的酸的酸性强弱性强弱H H4 4SiOSiO4 4弱酸弱酸H H3 3POPO4 4中强酸中强酸H H2 2SOSO4 4强酸强酸HClOHClO4 4最强酸最强酸Si P S Cl 性质的比较性质的比较Si P S Cl非金属性逐渐增强非金属性逐渐增强结论:结论:氢化物的氢化物的稳定性稳定性较稳定较稳定高温分高温分解解很
28、稳定很稳定很不稳很不稳定定点燃或点燃或光照光照高高 温温不稳定不稳定Na Mg AlSi P S Cl金属性逐渐减弱、非金属性逐渐增强金属性逐渐减弱、非金属性逐渐增强Ar稀有气稀有气体元素体元素小小 结:结:同一周期的主族元素,同一周期的主族元素, 相同,但从相同,但从左到右,左到右, 逐渐增大,原子半径逐逐渐增大,原子半径逐渐渐 ,失电子能力逐渐,失电子能力逐渐 , 得电子能力逐渐得电子能力逐渐 ,金属性逐,金属性逐渐渐 ,非金属性,非金属性 逐渐逐渐 。四、同主族元素性质的预测四、同主族元素性质的预测元素元素最外层电子数最外层电子数原子半径原子半径最高化合价最高化合价最低化合价最低化合价气
29、态氢化物气态氢化物最高价含氧酸最高价含氧酸逐渐增大逐渐增大()()+HFHCl HBrHI HClO4 HBrO4 HIO4卤族元素性质比较卤族元素性质比较FClBrI单质单质F2Cl2Br2I2反应条件反应条件反应程度反应程度氢化物的氢化物的稳定性稳定性冷暗处冷暗处光照或点光照或点燃燃加热加热不断加热不断加热爆炸爆炸剧烈剧烈缓慢缓慢缓慢缓慢很稳定很稳定稳定稳定较稳定较稳定不稳定不稳定卤族元素单质与氢气反应比较卤族元素单质与氢气反应比较根据钠和钾性质比较,预测族元素单质的性质根据钠和钾性质比较,预测族元素单质的性质相似性:相似性:递变性:递变性:都是活泼金属,都是活泼金属,+价,单质都能与价,
30、单质都能与氧气、水等反应,氧化物对应的水氧气、水等反应,氧化物对应的水化物都能有较强的碱性化物都能有较强的碱性从锂到铯,原子失电子能力逐渐从锂到铯,原子失电子能力逐渐增强,表现在与氧气以及和水的增强,表现在与氧气以及和水的反应上反应上同一主族的元素,同一主族的元素, 相同,从上往下,电相同,从上往下,电子层数依次子层数依次 ,原子半径逐渐,原子半径逐渐 ,失,失电子能力逐渐电子能力逐渐 ,得电子能力,得电子能力 逐逐渐渐 ,金属性逐渐,金属性逐渐 ,非金属性逐,非金属性逐渐渐 。同主族元素性质的递变规律原子半径依次减小原子半径依次减小原子半径依次增大原子半径依次增大失电子能力依次增强失电子能力
31、依次增大非金属性依次增强得电子能力依次增强得电子能力依次增大非金属性依次增强金属性依次增强金属性依次增强 1B Al SiGeAs Sb Te 2 3 4 5 6 7A AAA AAA 0 Po At得电子能力逐渐增强得电子能力逐渐增强失电子能力逐渐增强失电子能力逐渐增强失电子能力逐渐增强失电子能力逐渐增强得电子能力逐渐增强得电子能力逐渐增强非金属区非金属区 金属区金属区(除(除H外)外)NaNaAlClClSi用元素符号回答原子序数用元素符号回答原子序数1118号元素的有关问题号元素的有关问题(1)除稀有气体外,原子半径最大的是)除稀有气体外,原子半径最大的是(2)最高价氧化物的水化物碱性最
32、强的是)最高价氧化物的水化物碱性最强的是(3)最高价氧化物的水化物呈两性的是)最高价氧化物的水化物呈两性的是(4)最高价氧化物的水化物酸性最强的是)最高价氧化物的水化物酸性最强的是(5)能形成气态氢化物且最稳定的是)能形成气态氢化物且最稳定的是(6)最高正化合价与最低负化合价绝对值相等的是)最高正化合价与最低负化合价绝对值相等的是 1.下列性质的递变中正确的是下列性质的递变中正确的是.( )A. O, S, Na的原子半径依次减小的原子半径依次减小B. LiOH, KOH, CsOH的碱性依次增强的碱性依次增强C. HF, NH3, SiH4的稳定性依次增强的稳定性依次增强D. HCl, HB
33、r, HI的还原性依次减弱的还原性依次减弱2.下列各组性质比较不正确的是下列各组性质比较不正确的是.( )A. 酸性:酸性:HClO4 HBrO4 HIO4B. 碱性:碱性:Ba(OH)2 Mg(OH)2 B(OH)3C. 氧化性:氧化性:Cl S OD. 稳定性:稳定性:HCl H2S SiH4BC在周期表中一定的区域内在周期表中一定的区域内寻找特定性质的物质寻找特定性质的物质根据周期表预言新元素的存在根据周期表预言新元素的存在氟里昂的发现与元素周期表氟里昂的发现与元素周期表元素周期表的实际应用元素周期表的实际应用在周期表中一定的在周期表中一定的区域内寻找特定性质的物质区域内寻找特定性质的物
34、质寻找用于制取农药的元素寻找用于制取农药的元素寻找半导体材料寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找用于制取农药的元素寻找半导体材料寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找用于制取农药的元素寻找半导体材料寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找催化剂、耐高温、耐腐蚀的合金材料根据元素周期表预言新元素的存在根据元素周期表预言新元素的存在 类铝(镓)的发现:类铝(镓)的发现:v1875年,法国化学家布瓦博德朗在分析比里牛斯山的年,法国化学家布瓦
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年心理咨询师的心理咨询环境分析试题及答案
- 第22课《陈涉世家》教学设计-2023-2024学年统编版语文九年级下册
- 中小学教师资格笔试学习障碍排除法试题及答案
- 2023-2024学年高中化学 5.1.1 元素周期律和元素周期表教学设计 苏教版必修第一册
- 2025年计算机二级考试历年试题及答案分析
- 2024年西医临床考试综合提升知识试题及答案
- 优化健康管理师考试的学习资源利用策略试题及答案
- 2024-2025学年高中历史 第五单元 经济全球化的趋势 第27课 综合探究:中国如何应对全球化的挑战(1)教学教学设计 岳麓版必修2
- 信托受益权质押合同
- 物业公司承包合同范例
- 高职机电专业《机电一体化技术》说课课件
- 政府专项债业务培训
- 2024理疗馆合作协议书范本
- NB-T+33008.1-2018电动汽车充电设备检验试验规范 第1部分:非车载充电机
- 停工责任的告知函(联系单)
- 2024广东省高级人民法院劳动合同制书记员招聘笔试参考题库含答案解析
- 2025届新高考生物精准复习:基因和染色体的关系+
- CHT 8023-2011 机载激光雷达数据处理技术规范(正式版)
- 《煤矿建设安全规范》
- 《人类起源的演化过程》阅读测试题及答案
- 《无人机组装、调试与维护》课程标准(高职)

评论
0/150
提交评论