



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
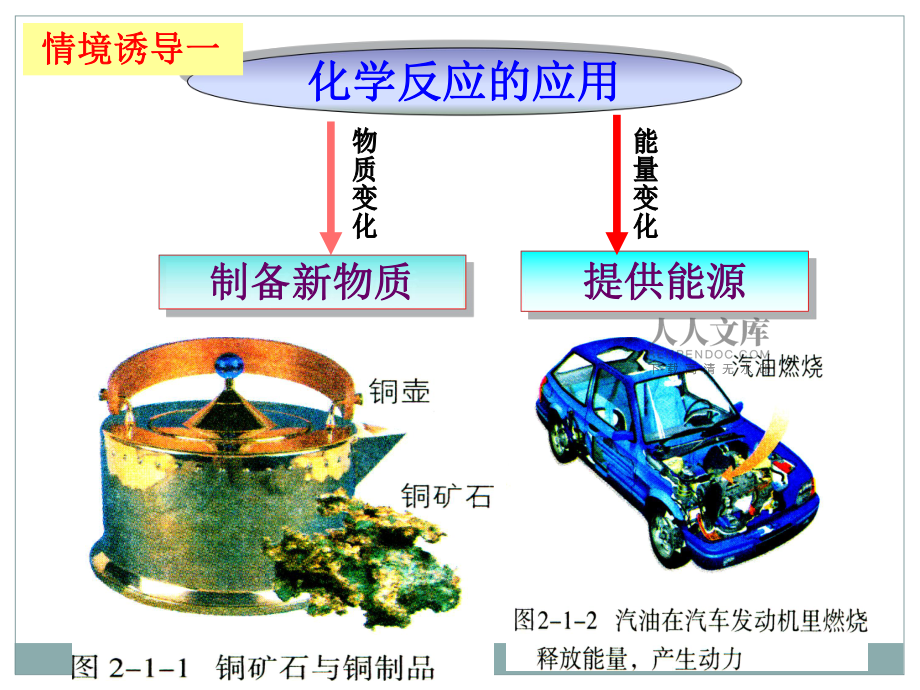
1、FUTUREFUTUREPAST化学反应的应用化学反应的应用制备新物质制备新物质提供能源提供能源 情境诱导一情境诱导一一百多种元素一百多种元素 千千万万种物质千千万万种物质 情境诱导二情境诱导二苹果能够落在地上,人在地球上生活而不自动脱离地球,均是因为地球的吸引力,也就是说宏观物质之间存在力的作用才能够“稳定存在”。那么化学物质(如:NaCl、HCl、 H2O等)能够稳定存在,构成这些物质的微观粒子之间是不是也存在着作用力呢?苹果能够落在地上,人在地球上生活而不自动脱离地球,均是因为地球的吸引力,也就是说宏观物质之间存在力的作用才能够“稳定存在”。那么化学物质(如:NaCl、HCl、 H2O等
2、)能够稳定存在,构成这些物质的微观粒子之间是不是也存在着作用力呢? 情境诱导三情境诱导三钠在氯气中燃烧实验现象:现象:剧烈燃烧,剧烈燃烧,黄色火焰,黄色火焰,大量白烟。大量白烟。【思考】Na与Cl是如何结合成NaCl的呢? 【讨论讨论】请同学们运用核外电子排布的知识分析氯化钠的形成过程。Na+Cl电子转移电子转移不稳定不稳定较稳定较稳定在氯化钠中Na+和Cl- 间存在哪些作用力?1、Na+离子和Cl-离子间的相互吸引;2、电子与电子、原子核与原子核间的相互排斥作用阴、阳离子通过静电作用而形成的化学键叫做离子键。离子键。(1 1)定义:)定义:(2 2)成键微粒:)成键微粒:(3 3)相互作用:
3、)相互作用:(4 4)成键过程:)成键过程:1.1.离子键离子键使使阴阳离子阴阳离子结合成化合物的静电作用结合成化合物的静电作用阴、阳离子阴、阳离子静电作用(静电作用(静电引力静电引力和和静电斥力静电斥力) 原子间通过得失电子,变成阴阳离子;阴阳离子接近原子间通过得失电子,变成阴阳离子;阴阳离子接近到某一定距离时,吸引和排斥达到平衡;体系的能量降到某一定距离时,吸引和排斥达到平衡;体系的能量降低,就形成了离子键。低,就形成了离子键。(5 5)离子化合物:)离子化合物:含有离子键的化合物,叫离子化合物。含有离子键的化合物,叫离子化合物。2.2.离子键的存在:离子键的存在:从元素间的相互化合分析从
4、元素间的相互化合分析活泼的金属元素(活泼的金属元素(IAIA、IIAIIA)和活泼的非金属元素()和活泼的非金属元素(VIAVIA、VIIAVIIA)之间形成的化合物之间形成的化合物;活泼金属与酸根离子之间活泼金属与酸根离子之间;铵根离子与酸铵根离子与酸根离子之间。根离子之间。从物质的类别分析从物质的类别分析a.强碱:强碱:b.大部分盐:大部分盐:c.部分金属氧化物、过氧化物:部分金属氧化物、过氧化物: 活泼金属对应的碱活泼金属对应的碱如:如:NaOHNaOH、KOHKOH、Ba(OH)Ba(OH)2 2等等除除AlClAlCl3 3等少数盐等少数盐如:如:NaNa2 2O O、CaOCaO、
5、NaNa2 2O O2 2等等 练习练习 1.1.下列各数值表示有关元素的原子序数下列各数值表示有关元素的原子序数, ,能形成能形成ABAB2 2 型离子化合物的是型离子化合物的是( ) ( ) A.6 A.6与与8 B.118 B.11与与13 C. 1113 C. 11与与16 D.1216 D.12与与1717D思考思考: :如何形象地表示离子化合物的形成?(1 1)定义:)定义:(2 2)原子的电子式)原子的电子式(3 3)阳离子的电子式)阳离子的电子式3.3.电子式电子式在元素符号周围用在元素符号周围用“ ”或或“”来表示原子来表示原子最外层电子最外层电子的式子的式子H Na Mg
6、Ca O Cl 简单阳离子的电子式就是它的简单阳离子的电子式就是它的离子符号离子符号:H+、Na+、Ca2+(4 4)阴离子的电子式:)阴离子的电子式: 不但要画出最外层电子数,而且还要用中括号不但要画出最外层电子数,而且还要用中括号“ ”括起来,并在右上角标出所带电荷括起来,并在右上角标出所带电荷“n n- -” O 2- : : Cl - : :(5 5)离子化合物的电子式:)离子化合物的电子式: Cl - : :Na+Ca2+ Cl - : : Cl - : :Na+Na+ O 2- : :AB型型AB2型型A2B型型(6 6)用电子式表示离子化合物的形成过程)用电子式表示离子化合物的形
7、成过程 MgCl2: :ClMgClMg2ClCl离子要注明正负电荷及数离子要注明正负电荷及数目,且正负电荷总数应相目,且正负电荷总数应相等等 相同的原子可以合并写,相同的原子可以合并写,相同的离子要单个写相同的离子要单个写箭头左方相同的微粒可以合并箭头左方相同的微粒可以合并箭头右方相同的微粒不可以合并箭头右方相同的微粒不可以合并用箭头表明电子转移方向用箭头表明电子转移方向(也可不标)(也可不标)不能把不能把 “” 写成写成 “ = ”(6 6)用电子式表示离子化合物的形成过程)用电子式表示离子化合物的形成过程 ClNaClNaSK KBr2MgBrBrMgBrNaClNaCl: :K K2
8、2S:S:MgBrMgBr2 2: : KS2-2- KBye Bye! 温故知新活泼金属原子活泼金属原子失去电子失去电子阳离子阳离子活泼非金属原子活泼非金属原子得到电子得到电子阴离子阴离子静电作用静电作用离子键离子键电子式电子式离子化合物离子化合物思考1:下列电子式是否正确:O: :Na:+ :S:-2:Ca2+:Cl: - Na2+:O:2-:氧原子氧原子 钠离子钠离子 硫离子硫离子:Cl: -:氯化钙氯化钙 氧化钠氧化钠Cl HCl H思考3:下列用电子式表示化合物的形成过程正确的是: K O KO K2 2KMg F F Mg F2 2 2 2 Ba Cl Cl2 2BaClClA A
9、B BC CD D思考2: 某A族元素 X 和A族元素 Y 可形成离子化合物,请用电子式表示该离子化合物。 X2+ Y - : : Y - : : 活泼的金属元素和活泼非金属元素的原子之间化合时形成离子键。那么,非金属元素的原子之间能形成离子键吗?为什么? 一般不能,因非金属元素的原子均有获得一般不能,因非金属元素的原子均有获得电子的倾向。电子的倾向。【 思考】 非金属元素的原子间通过什么使双方最外电子层均达到稳定结构。【讨论】FUTUREFUTUREPAST从反应:从反应:H H2 2 + Cl + Cl2 2 = 2HCl = 2HCl 的演示实验的演示实验中,谈中,谈谈谈你的收获?你的收
10、获? 1 1、黄绿色消失、黄绿色消失2 2、爆、爆 炸炸 3 3、HClHCl的生成的生成有有H H、ClCl原子存在原子存在有新物质生成有新物质生成有热量放出有热量放出氯化氢的形成过程 原子之间通过原子之间通过共用电子对共用电子对的相互作用所形成的化学键,的相互作用所形成的化学键,叫做叫做共价键共价键。通过共用电子对通过共用电子对H2+Cl2=2HCl点燃点燃222共价键形成条件:共价键形成条件:一般是非金属元素原子间的相互作用。一般是非金属元素原子间的相互作用。非金属元素可以是同种,也可以是不同种;如:非金属元素可以是同种,也可以是不同种;如:H H2 2、ClCl2 2、HClHCl、C
11、OCO2 2 等分子中均含有共价键。等分子中均含有共价键。l2 气体分子H2 气体分子分开后,她们为什么不高兴?让我们听听她们说些什么?我我只有一个电只有一个电子,太子,太少少了了我我也也少少一一个电子个电子e 原子Cl 原子二位好!我有一个好办法你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有行吗?e好呵谢谢好呵谢谢愿意愿意愿意愿意电子电子电子电子H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献共价键 【分析】问题问题: :1.1. 非金属元素之间化合时,能形成离子键吗?为什么?非金属元素之间化合时,能形成离
12、子键吗?为什么?不能,因非金属元素的原子均有获得电子的倾向不能,因非金属元素的原子均有获得电子的倾向2.2.非金属元素之间化合时,核外电子排布是通过什么方式非金属元素之间化合时,核外电子排布是通过什么方式 达到稳定结构的?达到稳定结构的?H HH H HH(结构式)(结构式)以以H H2 2、HClHCl分子的形成为例分子的形成为例 探讨探讨: : Cl :H Cl H HCl(结构式)(结构式)结论结论: :在在H H2 2、HClHCl分子的形成过程中,没有发生分子的形成过程中,没有发生电子的得失电子的得失,而是通过形成而是通过形成共用电子对共用电子对 达到稳定结构的达到稳定结构的 用一根
13、短线表示用一根短线表示一个共用电子对一个共用电子对共用电子对共用电子对(1 1)定义:)定义:(2 2)成键微粒:)成键微粒:(3 3)相互作用:)相互作用:(4 4)成键条件:)成键条件:1.1.共价键共价键原子之间原子之间【通常为非金属原子之间通常为非金属原子之间】共用电子对(静电作用,包括静电共用电子对(静电作用,包括静电引力和静电斥力。)引力和静电斥力。)原子之间通过共用电子对所形成的相互作用原子之间通过共用电子对所形成的相互作用a.a.非金属元素原子之间相结合非金属元素原子之间相结合b.b.部分部分金属元素与非金属元素之间的结合金属元素与非金属元素之间的结合 (如(如AlCl3等)等
14、) 不同原子不同原子之间以之间以共用电子对共用电子对形成分子的化合物,叫做形成分子的化合物,叫做共价化合物共价化合物。【两个两个“一定一定”和两个和两个“不一定不一定”】两个两个“一定一定”:”:1.1.共价化合物一定共价化合物一定只含有只含有共价键共价键 。2.2.共价化合物一定不含有离子键。共价化合物一定不含有离子键。2.2.共价化合物共价化合物两个两个“不一定不一定”:1.含共价键的物质不一定是共价化合物。2.含共价键的化合物不一定是共价化合物,也可能是离子化合物。思考与讨论思考与讨论哪些物质属于共价化合物?哪些物质属于共价化合物?(1)酸:如HCl、H2SO4等。(2)非金属氧化物:如
15、CO、NO2、SO2等。(3)非金属氢化物:如NH3、H2S、H2O等。(4)有机物:如CH4、CCl4等。(5)少数盐。(1 1)氯气)氯气 练习:练习: 1.1.写出下列物质的电子式和结构式写出下列物质的电子式和结构式(2 2)溴化氢)溴化氢 (5 5)过氧化氢)过氧化氢(4 4)甲烷)甲烷(3 3)氮气)氮气Cl Cl: N N ClCl HBr NN HC HHH HOOHH Br H C H H H H O O H (9 9)用电子式表示共价化合物的形成过程)用电子式表示共价化合物的形成过程 2. HCl3. H2O1. H25. NH34. CO2H HH H Cl :H Cl H
16、 O H H O H H : O :C: O C:O O :3H : N N H : : H H 注意:注意:不标电荷和中括号不标电荷和中括号 “ ”HHHClHHOO=C=OHHH- -N- -结构式结构式:离子键和共价键的比较离子键和共价键的比较键型键型离子键离子键共价键共价键形成过程形成过程电子得失电子得失形成共用电子对形成共用电子对成键微粒成键微粒阴、阳离子阴、阳离子原子原子成键本质成键本质阴阳离子间静电作用阴阳离子间静电作用共用电子对共用电子对成键元素成键元素活泼的金属元素与活泼的活泼的金属元素与活泼的非金属元素之间非金属元素之间非金属元素非金属元素存在存在只存在于离子化合物中只存在
17、于离子化合物中非金属单质、共价化合非金属单质、共价化合物、物、 部分离子化合物部分离子化合物电子式电子式以以NaCl为例为例以以HCl为例为例 +NaCl: Cl H 2.2.共价键的分类共价键的分类问题:问题:探讨:探讨:结论:结论:在在HClHCl中,为什么中,为什么H H元素显元素显+1+1价、价、ClCl元素显元素显-1-1价价? ?共用电子对偏移的共价键叫做共用电子对偏移的共价键叫做极性共价键极性共价键在在HClHCl分子中:分子中:a.a.1717ClCl原子核内质子数大于原子核内质子数大于1 1H H原子核内质子数原子核内质子数b.b.1717ClCl原子核对共用电子对的吸引力大
18、于原子核对共用电子对的吸引力大于1 1H H原子核对原子核对 共用电子对的吸引力共用电子对的吸引力c.c.共用电子对偏向于对其吸引力强的一方共用电子对偏向于对其吸引力强的一方 (显负电性(显负电性, ,化合价为负)化合价为负) 共用电子对偏离于对其吸引力弱的一方共用电子对偏离于对其吸引力弱的一方 (显正电性(显正电性, ,化合价为正)化合价为正)+1 -1 Cl :H . (1)(1)极性共价键极性共价键共用电子对不偏移的共价键叫做共用电子对不偏移的共价键叫做非极性共价键非极性共价键问题:问题:在在H H2 2分子中,分子中,H H元素的化合价为何为元素的化合价为何为0 0?共用电子对有无偏移
19、共用电子对有无偏移? ?探讨:探讨:结论:结论:(2)(2)非极性共价键非极性共价键在在H H2 2分子中:分子中:a.a.1 1H H原子核内质子数相同原子核内质子数相同b.b.两个两个1 1H H原子核对共用电子对的吸引力大小相等原子核对共用电子对的吸引力大小相等c.c.共用电子对位于两原子核的正中央不偏向于任何一方共用电子对位于两原子核的正中央不偏向于任何一方 (不显电性(不显电性, ,化合价为化合价为0 0)H . H思考:思考:极性键与非极性键的区别?极性键与非极性键的区别?小小 结结化学键化学键 离子键离子键阴阳离子通过静电作用阴阳离子通过静电作用共价键共价键通过共用电子对通过共用
20、电子对化学变化的实质化学变化的实质旧键断裂,新键生成旧键断裂,新键生成共价化合物共价化合物离子化合物离子化合物含有离子键含有离子键只只含有共价键含有共价键极性键与非极性键的区别极性键与非极性键的区别 非极性键非极性键 极极 性性 键键原子种类原子种类原子吸引共用原子吸引共用电子对能力电子对能力共用电子对有共用电子对有无偏移无偏移成键原子的成键原子的电性电性实例实例同种原子同种原子不同种原子不同种原子相同相同不相同不相同不偏向任何不偏向任何一个原子一个原子偏向吸引电子能力强的原子一方偏向吸引电子能力强的原子一方不显电性不显电性吸引电子能力强的显负电性吸引电子能力强的显负电性吸引电子能力弱的显正电
21、性吸引电子能力弱的显正电性H2、N2、O2、Cl2等等HCl、H2O、NH3、CO2等等 思考思考 1.1.为什么为什么H H2 2 、ClCl2 2 、N N2 2 是双原子分子,而稀有气体为是双原子分子,而稀有气体为 单原子分子?单原子分子?2.2.以上共用电子对都是由成键双方提供的,共用电子对能以上共用电子对都是由成键双方提供的,共用电子对能 否由成键原子单方面提供?否由成键原子单方面提供?H H NN ClCl Ar 从结构的稳定性分析:从结构的稳定性分析:H + + HHHN + HHHN H 孤对电子:孤对电子:原子最外层存在的没有跟其它原子原子最外层存在的没有跟其它原子 共用的电
22、子对共用的电子对孤对电子孤对电子共用电子对共用电子对FUTUREFUTUREPAST键型键型概念概念特点特点形成条件形成条件存在存在离子键离子键共共价价键键非非极极性性键键极极性性键键阴、阳离子间阴、阳离子间通过静电作用通过静电作用形成的化学键形成的化学键阴、阳离阴、阳离子相互作子相互作用用活泼金属和活活泼金属和活泼非金属得失泼非金属得失电子成键电子成键离子离子化合物化合物原子间通过共原子间通过共用电子对(电用电子对(电子云的重叠)子云的重叠)而形成的化学而形成的化学键键共用电子共用电子对不发生对不发生偏移偏移相同非金属相同非金属元素原子的元素原子的电子配对成电子配对成键键非金属单非金属单质、
23、某些质、某些化合物化合物共用电子共用电子对偏向一对偏向一方原子方原子不同非金不同非金属元素原属元素原子的电子子的电子配对成键配对成键共价化合共价化合物和某些物和某些离子化合离子化合物物三、化学键三、化学键 1.1.定义:定义:使离子相结合或原子相结合的作用力使离子相结合或原子相结合的作用力2.2.分类:分类:相邻相邻的两个或多个原子之间的两个或多个原子之间强烈强烈的相互作用的相互作用注意注意: : 化学键的存在化学键的存在(1 1)稀有气体单质中不存在化学键)稀有气体单质中不存在化学键(2 2)多原子单质分子中存在共价键,)多原子单质分子中存在共价键, 如:如:H H2 2、O O2 2、O O3 3等等(3 3)共价化合物分子中只存在共价键,不存在离子键)共价化合物分子中只存在共价键,不存在离子键(4 4)离子化合物中一定存在离子键,可能存在共价键)离子化合物中一定存在离子键,可能存在共价键
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 专业育婴指导试题及答案总结
- 海洋资源开发现状分析-试题及答案
- 2024年注会考试反馈试题及答案
- 巧记2024年人力资源管理师试题及答案
- 北师大版七年级上册第3课《传说时代的文明曙光》教学设计
- 黑龙江生态工程职业学院《文化原典研读(Ⅱ)》2023-2024学年第一学期期末试卷
- 黑龙江省佳木斯中学2025届高三第六次考试英语试题含解析
- 黑龙江省双鸭山市友谊县2024-2025学年数学五年级第二学期期末经典试题含答案
- 黑龙江省哈尔滨市名校2025年高三年级调研测试(生物试题)试卷含解析
- 黑龙江省哈尔滨市阿城区朝鲜族中学2025届初三教学质量检测试题含解析
- 带押过户申请书
- 临边防护安全培训课件
- 专题04-完形填空2023年高考英语三模试题分项汇编(新高考八省专用)-(原卷版)
- 诗词接龙完整版本
- 上海市2024年中考英语试题及答案
- 房屋市政工程生产安全重大事故隐患判定标准(2024版)宣传画册
- 湖北省黄冈八模2025届高三第一次模拟考试数学试卷含解析
- 2024-2030年中国建筑垃圾处理行业发展分析及投资规划研究报告
- DB11∕T 1842-2021 市政基础设施工程门式和桥式起重机安全应用技术规程
- 2025年湖北省武汉市高考数学模拟试卷附答案解析
- 部编版五年级语文上册快乐读书吧测试题及答案

评论
0/150
提交评论