



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
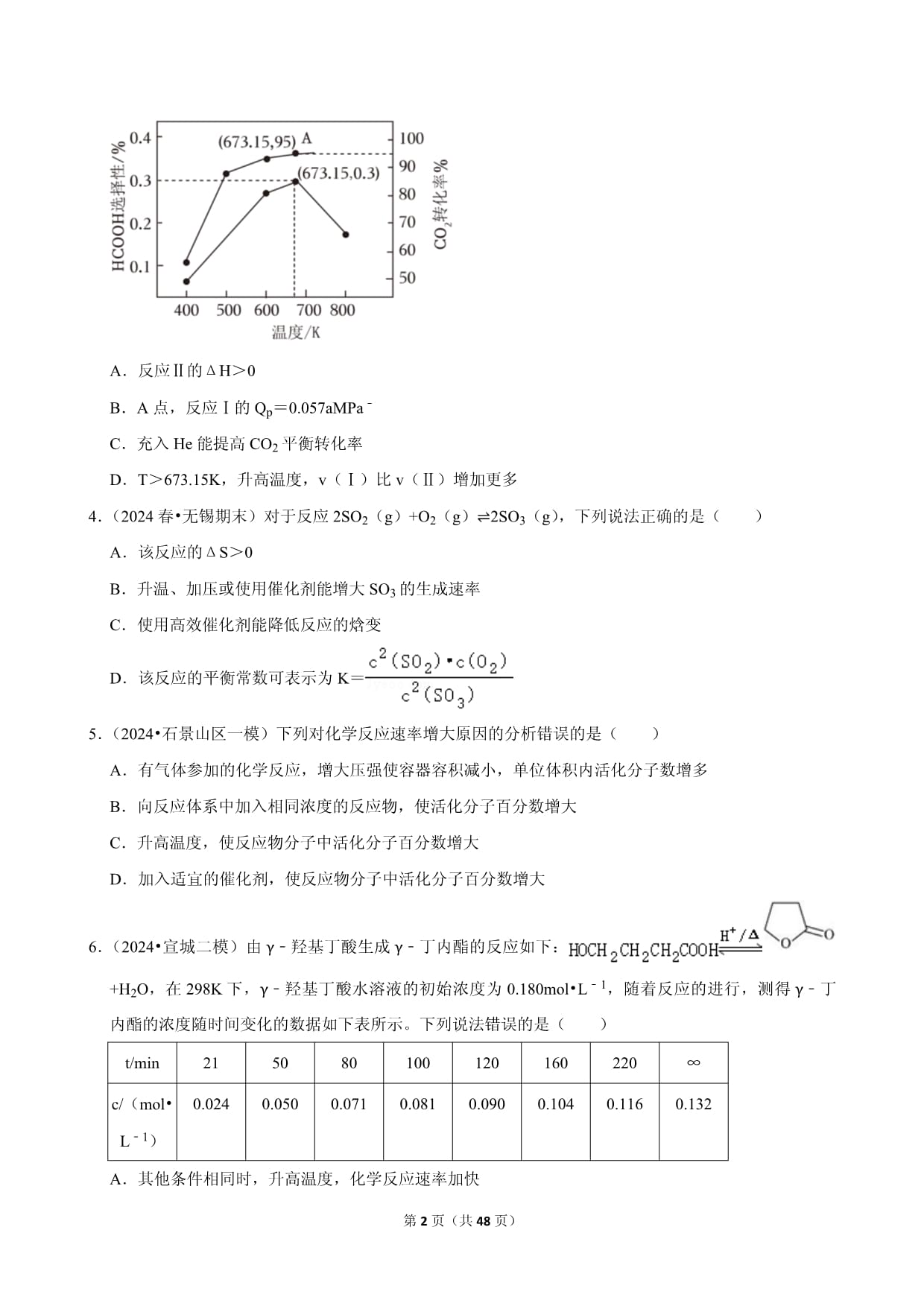
第1页(共1页)2025年高考化学复习热搜题速递之化学反应速率与化学平衡(2024年7月)一.选择题(共16小题)1.(2024春•南充期末)工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O22SO3,该反应是一个放热反应,如果反应在密闭容器中进行,下列说法错误的是()A.该反应中,SO2不能完全转化为SO3 B.使用催化剂是为了增大反应速率,提高生产效率 C.升高温度可以减慢SO2的反应速率 D.通过调控反应条件,可以提高该反应进行的程度2.(2024春•滨海新区期末)在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是()A.反应的化学方程式为2Y(g)═X(g) B.平衡时Y的转化率为75% C.若t1=4,0∼t1时间段,Y的平均反应速率为0.5mol/(L•min) D.t2时,反应的正、逆反应速率相等,反应达到平衡状态3.(2024•两江新区校级模拟)CO2与H2在固载金属催化剂上存在以下两个反应:反应Ⅰ:CO2(g)+H2(g)⇌HCOOH(g)反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g)在恒压条件下,按n(H2):n(CO2)=1:1投料比进行反应,CO2的转化率与HCOOH选择性随温度的变化如图所示,A点H2分压为aMPa。下列说法正确的是()A.反应Ⅱ的ΔH>0 B.A点,反应Ⅰ的Qp=0.057aMPa﹣ C.充入He能提高CO2平衡转化率 D.T>673.15K,升高温度,v(Ⅰ)比v(Ⅱ)增加更多4.(2024春•无锡期末)对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是()A.该反应的ΔS>0 B.升温、加压或使用催化剂能增大SO3的生成速率 C.使用高效催化剂能降低反应的焓变 D.该反应的平衡常数可表示为K=5.(2024•石景山区一模)下列对化学反应速率增大原因的分析错误的是()A.有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多 B.向反应体系中加入相同浓度的反应物,使活化分子百分数增大 C.升高温度,使反应物分子中活化分子百分数增大 D.加入适宜的催化剂,使反应物分子中活化分子百分数增大6.(2024•宣城二模)由γ﹣羟基丁酸生成γ﹣丁内酯的反应如下:+H2O,在298K下,γ﹣羟基丁酸水溶液的初始浓度为0.180mol•L﹣1,随着反应的进行,测得γ﹣丁内酯的浓度随时间变化的数据如下表所示。下列说法错误的是()t/min215080100120160220∞c/(mol•L﹣1)0.0240.0500.0710.0810.0900.1040.1160.132A.其他条件相同时,升高温度,化学反应速率加快 B.在80∼100min内,以γ﹣丁内酯的浓度变化表示的反应速率为5.0×10﹣4mol•L﹣1•min﹣1 C.120min时γ﹣羟基丁酸的转化率为60% D.298K时该反应的平衡常数K=2.757.(2024春•建邺区校级期末)在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol•L﹣1。下列判断不正确的是()A.x=1 B.2min内D的反应速率为0.3mol•L﹣1•min﹣1 C.A的转化率为40% D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态8.(2024春•长沙期中)氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的效率。工业上用化学气相沉积法制备氮化硅,其反应为3SiCl4(g)+2N2(g)+6H2(g)⇌Si3N4(s)+12HCl(g)ΔH<0。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是()A.Si3N4属于共价晶体 B.N2(g)与H2(g)生成NH3(g)的反应属于固氮反应 C.当混合气体的密度不再随时间变化时,该反应达到平衡 D.该反应的能量变化形式与盐酸和碳酸氢钠反应的能量变化形式相同9.(2024•宿迁一模)以CuZnOAl2O3作催化剂发生反应2CH3CHO(g)+H2O(g)⇌C2H5OH(g)+CH3COOH(g)ΔH<0,下列说法正确的是()A.该反应的平衡常数K= B.反应物的键能总和小于生成物的键能总和 C.该反应中每消耗1molH2O(g),转移电子数约为6.02×1023 D.将C2H5OH移出一段时间后,v正增大10.(2024春•南开区校级期中)为研究不同状态(块状、粉末状)碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的()A.曲线乙表示的是粉末状碳酸钙固体与盐酸反应 B.随着反应进行,盐酸浓度降低,反应速率不断降低 C.若用单位时间内CO2的体积变化来表示该反应的速率,则t2~t3时间内平均反应速率为 D.两次实验,粉末状固体最终生成的CO2的量更多11.(2024春•无锡期末)反应:2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),起始时,n(SiHCl3)=1mol,恒容1L容器。已知:x为物质的量分数。不同温度下x(SiHCl3)随时间的变化如题图所示。下列说法正确的是()A.T1>T2 B.该反应为吸热反应 C.K(T1)>K(T2) D.K(T1)=156.25×10﹣412.(2024春•济南期末)工业上可利用CO废气与H2合成甲醇,原理是CO(g)+2H2(g)⇌CH3OH(g),正反应为放热反应。某研究团队实验模拟该反应,在一定温度下2L恒容密闭容器中,充入1mol废气(其中CO体积分数为40%,其余物质此条件下不反应)和1molH2,在第5分钟达到平衡时,测得容器内压强为0.8p0kPa(起始压强为p0kPa)。下列说法正确的是()A.混合气体密度不再改变,能说明此反应已达到平衡状态 B.平衡时刻CO的转化率小于H2的转化率 C.在0﹣5min内该反应的平均速率2v(H2)=v(CH3OH)=0.02mol•L﹣1•min﹣1 D.若向此体系中再加入1molH2,平衡时气体总物质的量一定大于2.2mol13.(2024•石家庄模拟)将1molCO2(g)和3molH2(g)充入2L恒容密闭容器中发生反应:Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1<0(慢反应)Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0(快反应)测得相同时间内c(CO2)、v正(CO2)与温度的关系如图所示。下列说法错误的是()A.200℃前,加入催化剂可使a线转化为b线 B.300℃时,M点对应的反应体系中,v正(CO2)>v逆(CO2) C.400℃时,若5min时达到平衡,则v(CO2)=0.04mol•L﹣1•min﹣1 D.400℃后,温度对正反应速率的影响比浓度大14.(2024春•丰台区期中)变量控制是科学研究的重要方法。实验室用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸分别在下列条件下反应制取CO2,开始阶段化学反应速率最大的是()选项ABCD盐酸的浓度/(mol•L﹣1)0.530.53实验温度/℃25254040A.A B.B C.C D.D15.(2024•广西模拟)工业上利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,发生反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g),达到平衡时,测得c(N2)=0.2mol•L﹣1,下列说法不正确的是()A.加入催化剂使正反应速率加快,逆反应活化能减小 B.升高温度,正、逆反应速率增大的倍数不同 C.该温度下,该反应的平衡常数K≈0.25 D.若平衡时,往容器中通入2molCO和1molN2,则此时v正<v逆16.(2024•海淀区校级模拟)某小组进行“反应物浓度对反应速率影响”实验研究。分别取2mL不同浓度的葡萄糖溶液和H2C2O4溶液于试管中,再依次向试管中滴加4mL0.01mol•L﹣1酸性KMnO4溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。已知:(1)溶液透光率与溶液中显色微粒的浓度成反比。(2)酸性KMnO4溶液与H2C2O4溶液反应时,某种历程可表示如下。下列说法中不合理的是()A.从图1可知,该实验条件下,葡萄糖溶液浓度越大,反应速率越大 B.理论上,KMnO4和H2C2O4的反应中参与反应的n(KMnO4):n(H2C2O4)=2:5 C.图2中曲线甲反应速率加快的原因可能与反应生成有催化作用的物质有关 D.图2中H2C2O4溶液浓度不同时,数据呈现的原因是:随H2C2O4浓度增大,反应历程中①、②、③、④速率均减小二.实验题(共1小题)17.(2023春•赣县区校级月考)将浓度均为0.01mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应:H2O2+2S2+2H+=S4+2H2O。反应分两步进行:反应A为H2O2+2I﹣+2H+=I2+2H2O,反应B为••••••(1)反应B的离子方程式是。(2)为证明反应A、B的存在,进行如下实验。a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。试剂X是。(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ。(溶液浓度均为0.01mol/L)实验序号H2O2溶液/mLH2SO4溶液/mLNa2S2O3溶液/mLKI溶液(含淀粉)/mLH2O/mL实验Ⅰ54830实验Ⅱ52xyz溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30min、实验Ⅱ是40min。①实验Ⅱ中,x、y、z所对应的数值分别是。②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是。三.解答题(共5小题)18.(2024•广西三模)2023年第19届杭州亚运会上,主火炬塔的燃料首次使用废碳再生的绿色甲醇,实现循环内的零排放,这也是首次在大型体育赛事上使用这种绿色燃料。回答下列问题:(1)已知:①2CH3OH(g)+3O2(g)⇌2CO2(g)+4H2O(l)ΔH1②2H2(g)+O2(g)⇌2H2O(l)ΔH2③H2O(l)⇌H2O(g)ΔH3则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应热ΔH=kJ•mol﹣1(用含ΔH1、ΔH2、ΔH3的代数表示)。(2)在恒容的密闭体系中进行反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是(填标号)。(3)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示CO2吸附在催化剂表面;图中*H已省略)①上述合成甲醇的反应历程中,最大能垒(活化能)E正=eV。②下列措施有利于提高平衡时CO2转化率的有(填标号)。a.使用更高效的催化剂b.加压c.增大CO2的初始投入量(4)恒压下,将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH<0和反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH>0,在相同时间段内CH3OH的选择性和产率随温度的变化如图(其中,CH3OH的选择性=)。①温度高于230℃时,CH3OH的产率随温度升高而降低的原因可能是。②恒压下,通过上述过程合成甲醇的适宜条件是(填标号)。A.210℃B.230℃C.催化剂CZTD.催化剂CZ(Zr﹣1)T(5)一定条件下,将2molCO2和4molH2充入密闭容器中,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),CO2的平衡转化率与温度、平衡总压强的关系如图所示。①p1、p2、p3由大到小的顺序为。②在p3条件下255℃时,该反应的压强平衡常数Kp=(MPa)﹣2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。19.(2024•江西)石油开采的天然气含有H2S。综合利用天然气制氢是实现“碳中和”的重要途径。CH4和H2S重整制氢的主要反应如下:反应Ⅰ:CH4(g)+2H2S(s)⇌CS2(g)+4H2(g)ㅤΔH1=+260kJ/mol反应Ⅱ:CH4(g)⇌C(s)+2H2(g)ㅤΔH2=+90kJ/mol反应Ⅲ:2H2S(g)⇌S2(g)+2H2(g)ㅤΔH3=+181kJ/mol回答下列问题:(1)H2S分子的电子式为。(2)反应Ⅳ:CS2(g)⇌S2(g)+C(s)ㅤΔH4=kJ/mol。(3)保持反应器进料口总压为100kPa。分别以8kPaCH4、24kPaH2S(He作辅气)与25kPaCH4、75kPaH2S进料。CH4平衡转化率与温度的关系如图1,含有He的曲线为,理由是。(4)假设在10L的恒温刚性容器中,通入0.3molCH4和0.15molH2S发生反应Ⅰ、Ⅱ和Ⅲ,起始总压为P0。CH4和H2S的转化率与时间的关系如图2,0~5min内H2的化学反应速率为mol/(L•min);5min时,容器内总压为。(5)假设H2S和CH4的混合气体在某固体催化剂上的吸附服从Langmuir等温吸附(吸附分子彼此不发生相互作用,且气体分子为单分子层吸附)。吸附等温式为:其中a是气体的吸附系数,Vm是气体在固体表面的饱和吸附量(标态),P是气体的分压,V是气体分压为P时的平衡吸附量(标态)。在一定温度下,H2S的吸附系数是CH4的4倍,当H2S的分压为2MPa及4MPa,CH4和H2S的分压相同时,H2S平衡吸附量分别为0.6m3/kg和0.8m3/kg(已换算成标态),则H2S的吸附系数为MPa﹣1。(6)与传统天然气制氢中需要脱硫将H2S转化为硫黄和水相比,上述方法优点是。20.(2024•阜阳模拟)甲醇(CH3OH)属于基础化工原料,在化学工业中占有重要地位。回答下列问题:(1)工业上制备甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH。已知CO2、H2、CH3OH、H2O的能量依次为akJ•mol﹣1、bkJ•mol﹣1、ckJ•mol﹣1、dkJ•mol﹣1,则ΔH=kJ•mol﹣1。将物质的量之比1:3的CO2和H2以相同的流速分别通过两种催化剂(Cat﹣a或Cat﹣b),相同时间内测得CO2的转化率随温度变化的关系如图1所示:两种催化剂(Cat﹣a或Cat﹣b)相比效果好的是(填“Cat﹣a”或“Cat﹣b”),与另一催化剂相比,使用该催化剂存在的弊端是。(2)甲醇可分解生成水煤气(CO、H2),反应为CH3OH(g)⇌CO(g)+2H2(g)。起始时,向某刚性容器中通入一定量的CH3OH(g),平衡时各物质的物质的量与温度的关系如图2所示。①图2中曲线1表示的物质是(填化学式)。②A点处体系中CO的体积分数为。③B点处,若容器的压强为pkPa,则B点处CH3OH的转化率为,此温度下该反应的平衡常数Kp=(kPa)2(用平衡压强代替平衡浓度,分压=总压×物质的量分数)。(3)甲醇可催化制备丙烯,反应为3CH3OH(g)⇌C3H6(g)+3H2O(g),反应的Arrhenius公式的实验数据如图3中a所示,已知Arhenius经验公式为Rlnk=﹣+C(其中Ea为活化能,k为速率常数,只与温度有关,R和C为常数)。①该反应的活化能Ea=kJ•mol﹣1。②当使用更高效催化剂时,实验数据变成图3中的曲线(填“b”或“c”)。21.(2024•枣庄一模)到2024年,我国空间站天和号核心舱已在轨1000多天。空间站必须给航天员提供基本的生存条件,涉及氧气供给、一氧化碳清除、水处理等。电解水技术除用于供氧外,生成的氢气通过萨巴蒂尔反应,实现了二氧化碳的清除,同时将氢气转化为更安全的甲烷,原理:CO2(g)+4H2(g)2H2O(g)+CH4(g)ΔH1=﹣168.5kJ/mol。回答下列问题:(1)已知同条件下甲烷摩尔燃烧焓约是氢气的3.1倍,H2O(g)═H2O(l)ΔH=﹣44kJ/mol,CH4的摩尔燃烧焓约为kJ/mol。(2)在恒容密闭容器中加入等量CO2和H2,分压均为20kPa,一定条件下发生萨巴蒂尔反应,随着反应的进行,CO2的体积分数会(填“变大”变小”或“不变”)。某时刻测得H2O(g)的分压5kPa,若CH4的反应速率v(CH4)=1.2×10﹣6•p(CO2)•p4(H2)kPa•s﹣1,计算该时期v(H2)=kPa•s﹣1;当测得CH4(g)的分压为4kPa时,求得浓度商Qp=。(3)某条件下,萨巴蒂尔反应发生的同时也会发生副反应:反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g)将CO2和H2按体积比1:4混合(n总=5mol),匀速通入装有催化剂的反应容器中发生以上反应相同时间,CO2转化率,CH4选择性(选择性;转化的CO2中生成CH4的百分比)随温度变化曲线分别如图所示。已知反应Ⅰ为吸热反应,能较快建立平衡。图中A、B、C三点,能表示萨巴蒂尔反应达到平衡的点是。由图分析320℃时反应Ⅱ是否已经平衡:(填“是”“否”或“不能确定”),原因是。22.(2024•天津三模)Ⅰ.环氧乙烷()常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:CH2=CH2(g)+O2(g)⇌(g)ΔH=﹣120kJ/mol。(1)该反应在(填“高温”或“低温”)条件下自发进行。(2)化工生产设计时,常用串联多个反应器的工艺方法进行合成,并在两个相同的反应器中间加产物吸收装置和热交换降温装置,设计这种工艺的目的。Ⅱ.反应过程中常伴随副反应CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(g)ΔH=﹣1350kJ/mol,在恒容密闭容器中充入1mol乙烯和含1molO2的净化空气,在Ag(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率α及O2的分压随温度变化如图所示:(3)比较a点:v正v逆(填“>”“<”或“=”)。(4)若200℃时测得环氧乙烷的选择性为(某产物的选择性=)计算该温度下主反应的平衡常数(用物质分压表示)Kp=,(用含P0的式子表示)Ⅲ.我国化学工作者最新发明用电解法制乙烯,原理如图所示。该电解池中用到了CeO2多孔单晶,其在氧化过程可以促进晶格氧向活性氧的转变。(5)①阳极的电极反应式为;②图为CeO2的晶胞(●、〇分别表示Ce或O),该晶胞中Ce的配位数为,若晶胞边长为apm,则该CeO2晶体的密度为g•cm﹣3(设阿伏加德罗常数的值为NA,CeO2的摩尔质量用M表示,1pm=10﹣12m)。
2024年高考化学复习热搜题速递之化学反应速率与化学平衡(2024年7月)参考答案与试题解析一.选择题(共16小题)1.(2024春•南充期末)工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O22SO3,该反应是一个放热反应,如果反应在密闭容器中进行,下列说法错误的是()A.该反应中,SO2不能完全转化为SO3 B.使用催化剂是为了增大反应速率,提高生产效率 C.升高温度可以减慢SO2的反应速率 D.通过调控反应条件,可以提高该反应进行的程度【分析】A.在可逆反应中,反应物不能100%转化,故SO2不能完全转化为SO3,B.使用正催化剂等能加快反应速率,提高生产效率,C.升温能加快反应速率,D.对于可逆反应,改变条件使平衡发生正向移动,就可以提高该反应进行的程度。【解答】解:A.在可逆反应该反应中,反应物不能100%转化,由于该反应为可逆反应,所以SO2不能完全转化为SO3,故A正确;B.在这反应中,催化剂能加快反应速率,提高生产效率,故B正确;C.升高温度,化学反应速率加快,不会减慢SO2的反应速率,故C错误;D.对于可逆反应在一定条件下达到平衡,当改变条件,使平衡正向移动,例如对于题目所给反应,通过增大氧气通入量,加压,降低温度等,使平衡正向移动,可以提高该反应进行的程度,故D正确;故选:C。【点评】本题考查可逆反应中的常见问题,包括转化率问题、催化剂作用,温度对速率的影响以及反应的进行程度等问题。易错点在于反应放热,升温使平衡逆向移动。2.(2024春•滨海新区期末)在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是()A.反应的化学方程式为2Y(g)═X(g) B.平衡时Y的转化率为75% C.若t1=4,0∼t1时间段,Y的平均反应速率为0.5mol/(L•min) D.t2时,反应的正、逆反应速率相等,反应达到平衡状态【分析】A.t3时,X、Y的物质的量不再改变,达到平衡,该反应为可逆反应;B.转化率为已转化物质的量与原有总物质的量的比值,据此分析计算;C.容器容积不确定,无法计算浓度变化量,平均反应速率无法计算;D.但随着反应的进行,反应物、生成物物质的量不再改变即达平衡。【解答】解:A.从开始到t3,X、Y的物质的量不再改变,达到平衡,该反应为可逆反应,期中,Y的物质的量减少8mol﹣2mol=6mol,X的物质的量增加5mol﹣2mol=3mol,物质的量的变化量之比等于化学计量数之比,则反应的化学方程式为2Y⇌x,故A错误;B.开始至平衡时,Y由8mol减少为2mol,转化了8mol﹣2mol=6mol,故平衡时Y的转化率为=75%,故B正确;C.若t1=4,0∼t1时间段,Y由8mol减少为6mol,但容器容积不确定,无法计算Y的浓度变化量,Y的平均反应速率无法计算,故C错误;D.t2时,由图可知X、Y物质的量相等,但随着反应的进行,X继续增多,Y继续减少,即反应继续正向进行,未达平衡,故D错误;故选:B。【点评】本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量的变化、平衡的判断、转化率的概念为解答的关键,侧重分析与应用能力的考查,注意化学计量数的确定方法,题目难度不大。3.(2024•两江新区校级模拟)CO2与H2在固载金属催化剂上存在以下两个反应:反应Ⅰ:CO2(g)+H2(g)⇌HCOOH(g)反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g)在恒压条件下,按n(H2):n(CO2)=1:1投料比进行反应,CO2的转化率与HCOOH选择性随温度的变化如图所示,A点H2分压为aMPa。下列说法正确的是()A.反应Ⅱ的ΔH>0 B.A点,反应Ⅰ的Qp=0.057aMPa﹣ C.充入He能提高CO2平衡转化率 D.T>673.15K,升高温度,v(Ⅰ)比v(Ⅱ)增加更多【分析】A.图象中温度在400~700K的转化率与HCOOH选择性随温度升高而增大,升温二氧化碳转化率增大;B.设起始时投料n(H2)=n(CO2)=1mol,发生反应Ⅰ和反应Ⅱ,若A点反应已达到平衡状态,CO2的转化率为95%,HCOOH选择性为0.3%,则平衡时n(H2)=n(CO2)=0.05mol,n(HCOOH)=1mol×95%×0.3%=0.00285mol,体系中CO2、H2的分压均为aMPa,HCOOH的分压为×aMPa=0.057aMPa;C.恒压条件下充入He气,容器体积增大,相当于减压,反应Ⅰ为气体体积减小的反应,则压强减小,平衡逆向进行;D.由图可知,温度在673.15K时CO2的转化率及HCOOH选择性均较高,温度低于400K时CO2的转化率及HCOOH选择性均较低,所以适当升高温度可提高甲酸选择性,由图可知当温度高于673.15K,随温度升高,CO2的转化率增大,HCOOH选择性明显减小,说明CO的选择性明显增大。【解答】解:A.图象中温度在400~700K的转化率与HCOOH选择性随温度升高而增大,升温二氧化碳转化率增大,平衡正向进行,反应Ⅱ为吸热反应,反应的ΔH>0,故A正确;B.不妨设初始投料为n(H2)=n(CO2)=1mol,673.15K时,CO2的转化率为95%,HCOOH的选择性为0.3%,所以n(HCOOH)=1×95%×0.3%mol,由于反应Ⅰ和反应Ⅱ中H2和CO2都是1:1反应,所以此时n(H2)=n(CO2)=1×5%mol,则此时p(CO2)=p(H2)=aMPa,p(HCOOH)=×aMPa=0.057aMPa,所以反应Ⅰ的压力商计算式Qp=MPa﹣1=MPa﹣1,故B错误;C.恒压条件下充入He气,容器体积增大,相当于减压,反应Ⅰ为气体体积减小的反应,则压强减小,平衡逆向进行,CO2平衡转化率减小,故C错误;D.由图可知,当温度高于673.15K,随温度升高,CO2的转化率增大,HCOOH选择性明显减小,说明CO的选择性明显增大,此时主要发生反应Ⅱ,反应Ⅱ的反应速率增加高于反应Ⅰ,故D错误;故选:A。【点评】本题考查了化学平衡影响因素、平衡计算、图象的分析判断等知识点,注意知识的熟练掌握,题目难度中等。4.(2024春•无锡期末)对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是()A.该反应的ΔS>0 B.升温、加压或使用催化剂能增大SO3的生成速率 C.使用高效催化剂能降低反应的焓变 D.该反应的平衡常数可表示为K=【分析】A.反应为气体体积减小的反应;B.升温、加压或使用催化剂可以加快反应速率;C.催化剂降低反应活化能,加快了反应速率,不改变化学平衡;D.反应2SO2(g)+O2(g)⇌2SO3(g),反应的平衡常数K=。【解答】解:A.反应2SO2(g)+O2(g)⇌2SO3(g)的ΔS<0,故A错误;B.升温、加压或使用催化剂,能增大反应速率,增大了SO3的生成速率,故B正确;C.催化剂降低反应活化能,加快了反应速率,不改变化学平衡,不改变反应焓变,故C错误;D.反应2SO2(g)+O2(g)⇌2SO3(g),K=,故D错误;故选:B。【点评】本题考查了化学反应速率影响因素分析、平衡常数表达式等知识点,注意周四的熟练掌握,题目难度不大。5.(2024•石景山区一模)下列对化学反应速率增大原因的分析错误的是()A.有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多 B.向反应体系中加入相同浓度的反应物,使活化分子百分数增大 C.升高温度,使反应物分子中活化分子百分数增大 D.加入适宜的催化剂,使反应物分子中活化分子百分数增大【分析】A.增大压强后容器容积减小,活化分子总个数不变;B.向反应体系中加入相同浓度的反应物,活化分子总个数增多;C.温度升高,反应物获得能量;D.催化剂能降低反应所需活化能,部分非活化分子转化为活化分子。【解答】解:A.对有气体参加的化学反应,增大压强使容器容积减小,活化分子总个数不变,则单位体积内活化分子数增多,故A正确;B.向反应体系中加入相同浓度的反应物,使活化分子总个数增多,但活化分子百分数不变,故B错误;C.升高温度,反应物分子获得能量,部分非活化分子转化为活化分子,可使反应物分子中活化分子的百分数增大,故C正确;D.催化剂能降低反应所需活化能,部分非活化分子转化为活化分子,则活化分子百分数增大,故D正确;故选:B。【点评】本题考查外界条件对化学反应速率影响,侧重考查基础知识的掌握和灵活运用能力,明确外界条件对化学反应速率影响原理内涵是解本题关键,题目难度不大。6.(2024•宣城二模)由γ﹣羟基丁酸生成γ﹣丁内酯的反应如下:+H2O,在298K下,γ﹣羟基丁酸水溶液的初始浓度为0.180mol•L﹣1,随着反应的进行,测得γ﹣丁内酯的浓度随时间变化的数据如下表所示。下列说法错误的是()t/min215080100120160220∞c/(mol•L﹣1)0.0240.0500.0710.0810.0900.1040.1160.132A.其他条件相同时,升高温度,化学反应速率加快 B.在80∼100min内,以γ﹣丁内酯的浓度变化表示的反应速率为5.0×10﹣4mol•L﹣1•min﹣1 C.120min时γ﹣羟基丁酸的转化率为60% D.298K时该反应的平衡常数K=2.75【分析】A.升高温度,化学反应速率加快;B.反应速率υ(γ﹣丁内酯)=;C.γ﹣羟基丁酸转化率=×100%;D.该反应的平衡常数K=。【解答】解:A.其他条件相同时,升高温度,增大化学反应速率,化学反应速率加快,故A正确;B.在80∼100min内,以γ﹣丁内酯的浓度变化表示的反应速率==5.0×10﹣4mol•L﹣1•min﹣1,故B正确;C.120min时,γ﹣丁内酯的浓度为0.09mol/L,消耗γ﹣羟基丁酸的浓度为0.09mol/L,γ﹣羟基丁酸的转化率=×100%=50%,故C错误;D.298K时该反应的平衡常数K===2.75,故D正确;故选:C。【点评】本题考查化学平衡、平衡计算应用、影响化学反应速率的因素等,侧重考查学生速率、转化率、平衡常数计算,题目难度中等。7.(2024春•建邺区校级期末)在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol•L﹣1。下列判断不正确的是()A.x=1 B.2min内D的反应速率为0.3mol•L﹣1•min﹣1 C.A的转化率为40% D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态【分析】平衡时生成的C的物质的量为0.2mol•L﹣1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,利用三步计算法可知,3A(g)+B(g)⇌C(g)+2D(g)。起始量(mol/L)1.50.500变化量(mol/L)0.60.20.20.4平衡量(mol/L)0.90.30.20.4以此解答该题。【解答】解:A.由以上分析可知x=1,故A正确;B.2min内D的反应速率为mol•L﹣1•min﹣1=0.2mol•L﹣1•min﹣1,故B错误;C.A的转化率为×100%=40%,故C正确;D.反应前后质量不变,气体体积变化,则混合气体的平均相对分子质量始终在变,若混合气体的平均相对分子质量不变,能说明反应达到平衡状态,故D正确;故选:B。【点评】本题考查化学平衡计算,为高频考点,侧重考查判断及计算能力,把握基本公式、平衡状态判断方法、各个物理量与计量数的关系是解本题关键,注意:只有反应前后改变的物理量才能作为平衡状态判断标准,题目难度不大。8.(2024春•长沙期中)氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的效率。工业上用化学气相沉积法制备氮化硅,其反应为3SiCl4(g)+2N2(g)+6H2(g)⇌Si3N4(s)+12HCl(g)ΔH<0。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是()A.Si3N4属于共价晶体 B.N2(g)与H2(g)生成NH3(g)的反应属于固氮反应 C.当混合气体的密度不再随时间变化时,该反应达到平衡 D.该反应的能量变化形式与盐酸和碳酸氢钠反应的能量变化形式相同【分析】A.根据Si3N4材料耐高温、耐磨的性能;B.将游离氮转化为化合态氮的过程,称为固氮;C.该反应过程中气体质量减小,气体总体积不变,则混合气体的密度减小;D.盐酸和碳酸氢钠的反应为吸热反应。【解答】解:A.根据Si3N4材料耐高温、耐磨的性能可知,其具有熔点高、硬度大的性质,则氮化硅属于共价晶体,故A正确;B.氮的固定是将游离氮转化为化合态氮的过程;N2(g)与H2(g)生成NH3(g)的反应属于固氮反应,故B正确;C.该反应过程中气体质量减小,气体总体积不变,则混合气体的密度减小,当混合气体的密度不再随时间变化时,该反应达到平衡,故C正确;D.盐酸和碳酸氢钠的反应为吸热反应,其能量变化形式与题述反应的能量变化形式不同,故D错误;故选:D。【点评】本题考查化学平衡,侧重考查学生平衡状态判断的掌握情况,试题难度中等。9.(2024•宿迁一模)以CuZnOAl2O3作催化剂发生反应2CH3CHO(g)+H2O(g)⇌C2H5OH(g)+CH3COOH(g)ΔH<0,下列说法正确的是()A.该反应的平衡常数K= B.反应物的键能总和小于生成物的键能总和 C.该反应中每消耗1molH2O(g),转移电子数约为6.02×1023 D.将C2H5OH移出一段时间后,v正增大【分析】A.平衡常数是指平衡时生成物浓度幂之积与反应物浓度幂之积的比值;B.ΔH=反应物的键能总和﹣生成物的键能总和<0;C.CH3CHO转化为CH3COOH相当于增加一个O原子,转移2个电子;D.将C2H5OH移出生成物浓度减小,逆反应速率减小,平衡正向移动。【解答】解:A.平衡常数是指平衡时生成物浓度幂之积与反应物浓度幂之积的比值,该反应的平衡常数K=,故A错误;B.ΔH=反应物的键能总和﹣生成物的键能总和<0,可得反应物的键能总和小于生成物的键能总和,故B正确;C.CH3CHO转化为CH3COOH相当于增加一个O原子,转移2个电子,该反应中每消耗1molH2O(g),转移2mol电子,转移电子数约为2×6.02×1023,故C错误;D.将C2H5OH移出生成物浓度减小,逆反应速率减小,平衡正向移动,一段时间后,反应物浓度减小,则v正减小,故D错误;故选:B。【点评】本题考查化学平衡,侧重考查学生平衡常数的掌握情况,试题比较简单。10.(2024春•南开区校级期中)为研究不同状态(块状、粉末状)碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的()A.曲线乙表示的是粉末状碳酸钙固体与盐酸反应 B.随着反应进行,盐酸浓度降低,反应速率不断降低 C.若用单位时间内CO2的体积变化来表示该反应的速率,则t2~t3时间内平均反应速率为 D.两次实验,粉末状固体最终生成的CO2的量更多【分析】A.粉末状碳酸钙固体与盐酸反应,生成二氧化碳的量不变,但接触面积增大、反应速率加快,时间减少;B.碳酸钙与盐酸反应放热,升高温度加快反应速率,则反应开始时,温度对反应速率的影响起主要作用;C.由题意,v=,可知;D.探究反应速率的影响因素时,只控制一个变量。【解答】解:A.粉末状碳酸钙固体与盐酸反应生成二氧化碳的量不变,但接触面积增大、反应速率加快,时间减少,而曲线甲用时小,则曲线甲表示的是粉末状碳酸钙固体与盐酸反应,故A错误;B.碳酸钙与盐酸反应放热,升高温度加快反应速率,则反应开始时,温度对反应速率的影响起主要作用,导致0﹣t1内的反应速率逐渐增大,随着反应的进行,浓度降低起主要作用,反应速率才不断降低,故B错误;C.由v=可知,t2﹣t3的速率v(CO2)=mL•s﹣1,故C正确;D.研究不同状态(块状、粉末状)碳酸钙固体与盐酸反应的反应速率,两次实验所取碳酸钙固体质量一样,与足量的盐酸反应,生成二氧化碳的量相同,故D错误;故选:C。【点评】本题考查反应速率,侧重考查学生影响速率因素的掌握情况,试题难度中等。11.(2024春•无锡期末)反应:2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),起始时,n(SiHCl3)=1mol,恒容1L容器。已知:x为物质的量分数。不同温度下x(SiHCl3)随时间的变化如题图所示。下列说法正确的是()A.T1>T2 B.该反应为吸热反应 C.K(T1)>K(T2) D.K(T1)=156.25×10﹣4【分析】A.先拐先平数值大;B.温度升高,平衡向吸热反应分方向移动;C.正反应为吸热反应,升高温度,平衡正向移动,平衡常数K增大;D.由图可知,T1温度下,反应达到平衡时,x(SiHCl3)不能确定具体值,无法计算K(T1)。【解答】解:A.由图可知,T2温度下,反应先达到平衡,根据先拐先平数值大,可知T1<T2,故A错误;B.由图可知,T2温度下,反应先达到平衡,x(SiHCl3)小,说明温度升高,平衡正向移动,则正反应为吸热反应,故B正确;C.正反应为吸热反应,升高温度,平衡正向移动,平衡常数K增大,K(T1)<K(T2),故C错误;D.由图可知,T1温度下,反应达到平衡时,x(SiHCl3)不能确定具体值,无法计算K(T1),故D错误;故选:B。【点评】本题主要考查温度对化学平衡的影响,同时考查化学平衡常数K的计算,对学生的能力要求较高,难度中等。12.(2024春•济南期末)工业上可利用CO废气与H2合成甲醇,原理是CO(g)+2H2(g)⇌CH3OH(g),正反应为放热反应。某研究团队实验模拟该反应,在一定温度下2L恒容密闭容器中,充入1mol废气(其中CO体积分数为40%,其余物质此条件下不反应)和1molH2,在第5分钟达到平衡时,测得容器内压强为0.8p0kPa(起始压强为p0kPa)。下列说法正确的是()A.混合气体密度不再改变,能说明此反应已达到平衡状态 B.平衡时刻CO的转化率小于H2的转化率 C.在0﹣5min内该反应的平均速率2v(H2)=v(CH3OH)=0.02mol•L﹣1•min﹣1 D.若向此体系中再加入1molH2,平衡时气体总物质的量一定大于2.2mol【分析】反应的三段式为CO(g)+2H2(g)⇌CH3OH(g)起始量(mol)0.410变化量(mol)x2xx平衡量(mol)0.4﹣x1﹣2xx达到平衡时,测得容器内压强为0.8p0kPa(起始压强为p0kPa),恒温恒容条件下混合气体的物质的量之比等于其压强之比,则(1+1):(2﹣2x)=p0:0.8p0,解得x=0.2,结合v=、转化率=×100%、化学平衡状态判断分析解答该题。【解答】解:反应的三段式为CO(g)+2H2(g)⇌CH3OH(g)起始量(mol)0.410变化量(mol)x2xx平衡量(mol)0.4﹣x1﹣2xx恒温恒容条件下混合气体的物质的量之比等于其压强之比,则(1+1):(2﹣2x)=p0:0.8p0,解得x=0.2;A.反应为CO(g)+2H2(g)⇌CH3OH(g),体系中各物质均为气体,则恒容条件下混合气体的质量、密度始终不变,即混合气体密度不再改变的状态不一定是化学平衡状态,故A错误;B.由上述分析可知,CO的平衡转化率为×100%=50%,H2的平衡转化率为×100%=40%<50%,故B错误;C.反应为CO(g)+2H2(g)⇌CH3OH(g),则0﹣5min内该反应的平均速率v(H2)=2v(CH3OH)====0.04mol•L﹣1•min﹣1,故C错误;D.1mol废气中n(CO)=0.4mol,再加入1molH2时n(H2)=2mol,反应为CO(g)+2H2(g)⇌CH3OH(g)△n=2,若0.4molCO完全转化为甲醇时,则反应物总量减少0.8mol,剩余气体为(1+1+1)mol﹣0.8mol=2.2mol,但可逆反应不可能反应完全,所以平衡时气体总物质的量一定大于2.2mol,故D正确;故选:D。【点评】本题考查化学平衡计算、平衡状态判断,侧重分析能力和计算能力考查,把握可逆反应特点、平衡状态特征及判定、反应速率和转化率计算、三段式格式的应用是解题关键,题目难度中等。13.(2024•石家庄模拟)将1molCO2(g)和3molH2(g)充入2L恒容密闭容器中发生反应:Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1<0(慢反应)Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0(快反应)测得相同时间内c(CO2)、v正(CO2)与温度的关系如图所示。下列说法错误的是()A.200℃前,加入催化剂可使a线转化为b线 B.300℃时,M点对应的反应体系中,v正(CO2)>v逆(CO2) C.400℃时,若5min时达到平衡,则v(CO2)=0.04mol•L﹣1•min﹣1 D.400℃后,温度对正反应速率的影响比浓度大【分析】A.由图可知,200℃前,升高温度,二氧化碳的浓度减小、反应速率加快,说明反应未达到平衡,则加入催化剂,二氧化碳的反应速率加快,反应消耗二氧化碳的浓度增大;B.由图可知,300℃时,二氧化碳的浓度呈增大趋势,说明平衡向逆反应方向移动;C.由图可知,400℃时,反应达到平衡状态,二氧化碳的浓度为0.3mol/L,据此计算;D.由图可知,400℃后,二氧化碳正反应速率增大,而二氧化碳的浓度减小,说明温度对正反应速率的影响比浓度大。【解答】解:A.由图可知,200℃前,升高温度,二氧化碳的浓度减小、反应速率加快,说明反应未达到平衡,则加入催化剂,二氧化碳的反应速率加快,反应消耗二氧化碳的浓度增大,可使a线转化为b线,故A正确;B.由图可知,300℃时,二氧化碳的浓度呈增大趋势,说明平衡向逆反应方向移动,则二氧化碳的正反应速率小于逆反应速率,故B错误;C.由图可知,400℃时,反应达到平衡状态,二氧化碳的浓度为0.3mol/L,则5min内二氧化碳的反应速率为=0.04mol/(L•min),故C正确;D.由图可知,400℃后,二氧化碳正反应速率增大,而二氧化碳的浓度减小,说明温度对正反应速率的影响比浓度大,故D正确;故选:B。【点评】本题考查化学平衡的计算,为高频考点,试题侧重考查学生的分析能力及化学计算能力,题目难度中等。14.(2024春•丰台区期中)变量控制是科学研究的重要方法。实验室用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸分别在下列条件下反应制取CO2,开始阶段化学反应速率最大的是()选项ABCD盐酸的浓度/(mol•L﹣1)0.530.53实验温度/℃25254040A.A B.B C.C D.D【分析】反应物浓度大,温度高,反应速率快。【解答】解:由表格可知,温度为40℃,盐酸浓度为3mol/L时,反应速率最快,故选:D。【点评】本题考查化学反应速率,题目难度中等,掌握化学反应速率的影响因素是解题的关键。15.(2024•广西模拟)工业上利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,发生反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g),达到平衡时,测得c(N2)=0.2mol•L﹣1,下列说法不正确的是()A.加入催化剂使正反应速率加快,逆反应活化能减小 B.升高温度,正、逆反应速率增大的倍数不同 C.该温度下,该反应的平衡常数K≈0.25 D.若平衡时,往容器中通入2molCO和1molN2,则此时v正<v逆【分析】A.加入催化剂使活化能减小,反应速率加快;B.反应一定伴随能量变化,升高温度,平衡一定发生移动,则正、逆反应速率不同;C.一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g)平衡时,测得c(N2)=0.2mol/L,则可结合三段式列式计算平衡浓度,2CO(g)+2NO(g)⇌N2(g)+2CO2(g)起始量(mol/L)1100变化量(mol/L)0.40.40.20.4平衡量(mol/L)0.60.60.20.4得到平衡常数K=;D.若往容器中再通入2molCO和1molN2,计算此时的Qc=≈0.079<K=0.25,平衡正向移动。【解答】解:A.加入催化剂使活化能减小,反应速率加快,则该催化剂降低正反应的活化能,则逆反应活化能减小,故A正确;B.反应一定伴随能量变化,升高温度,平衡一定发生移动,则正、逆反应速率不同,增大的倍数不同,故B正确;C.一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g)平衡时,测得c(N2)=0.2mol/L,则可结合三段式列式计算平衡浓度,2CO(g)+2NO(g)⇌N2(g)+2CO2(g)起始量(mol/L)1100变化量(mol/L)0.40.40.20.4平衡量(mol/L)0.60.60.20.4得到平衡常数K==≈0.25,故C正确;D.若往容器中再通入2molCO和1molN2,计算此时的Qc=≈0.079<K=0.25,平衡正向移动,v正>v逆,故D错误;故选:D。【点评】本题考查了化学反应能量变化、影响化学反应速率的因素、平衡常数的计算等知识点,题目难度中等。16.(2024•海淀区校级模拟)某小组进行“反应物浓度对反应速率影响”实验研究。分别取2mL不同浓度的葡萄糖溶液和H2C2O4溶液于试管中,再依次向试管中滴加4mL0.01mol•L﹣1酸性KMnO4溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。已知:(1)溶液透光率与溶液中显色微粒的浓度成反比。(2)酸性KMnO4溶液与H2C2O4溶液反应时,某种历程可表示如下。下列说法中不合理的是()A.从图1可知,该实验条件下,葡萄糖溶液浓度越大,反应速率越大 B.理论上,KMnO4和H2C2O4的反应中参与反应的n(KMnO4):n(H2C2O4)=2:5 C.图2中曲线甲反应速率加快的原因可能与反应生成有催化作用的物质有关 D.图2中H2C2O4溶液浓度不同时,数据呈现的原因是:随H2C2O4浓度增大,反应历程中①、②、③、④速率均减小【分析】A.由图1,葡萄糖浓度越大,透光率上升越快;B.高锰酸钾氧化草酸,生成二价锰离子和二氧化碳,锰化合价从+7变为+2,得5个电子,碳化合价+3变为+4,1个草酸分子失2个电子;C.由历程图,Mn2+可以作为高锰酸钾和草酸反应的催化剂;D.随H2C2O4浓度增大,草酸根浓度增大。【解答】解:A.由图1,葡萄糖浓度越大,透光率上升越快,即高锰酸根浓度下降越快,故反应速率越大,故A正确;B.高锰酸钾氧化草酸,生成二价锰离子和二氧化碳,锰化合价从+7变为+2,得5个电子,碳化合价+3变为+4,1个草酸分子失2个电子,根据氧化还原反应得失电子守恒,KMnO4和H2C2O4的反应中参与反应的n(KMnO4):n(H2C2O4)=2:5,故B正确;C.由历程图,Mn2+可以作为高锰酸钾和草酸反应的催化剂,故图2中曲线甲反应速率加快的原因可能与反应生成Mn2+有催化作用有关,故C正确;D.随H2C2O4浓度增大,草酸根浓度增大,反应历程①中,草酸根是反应物,随浓度增大,历程①速率是增大的,故D错误;故选:D。【点评】本题考查化学反应速率,为高频考点,把握温度、浓度对速率的影响为解答的关键,侧重分析与实验能力的考查,注意控制变量法的应用,题目难度不大。二.实验题(共1小题)17.(2023春•赣县区校级月考)将浓度均为0.01mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应:H2O2+2S2+2H+=S4+2H2O。反应分两步进行:反应A为H2O2+2I﹣+2H+=I2+2H2O,反应B为••••••(1)反应B的离子方程式是。(2)为证明反应A、B的存在,进行如下实验。a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。试剂X是淀粉﹣KI。(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ。(溶液浓度均为0.01mol/L)实验序号H2O2溶液/mLH2SO4溶液/mLNa2S2O3溶液/mLKI溶液(含淀粉)/mLH2O/mL实验Ⅰ54830实验Ⅱ52xyz溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30min、实验Ⅱ是40min。①实验Ⅱ中,x、y、z所对应的数值分别是8、3、2。②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是其它条件不变,增大氢离子(或硫酸)浓度可以加快反应速率。【分析】该“碘钟实验“的总反应:①H2O2+2S2+2H+=S4+2H2O的反应,分两步进行:反应A:②H2O2+2I﹣+2H+=I2+2H2O,反应B:,根据淀粉遇碘变蓝和控制变量法,改变单一变量探究溶液变蓝快慢的影响因素。【解答】解:(1)该“碘钟实验“的总反应:①H2O2+2S2+2H+=S4+2H2O的反应,分两步进行:反应A:②H2O2+2I﹣+2H+=I2+2H2O反应B:①﹣②得到反应的离子方程式:,故答案为:;(2)过氧化氢具有氧化性会将KI氧化为碘单质,碘单质遇到淀粉变蓝色,碘单质具有氧化性,可以氧化Na2S2O3溶液,发生反应:,碘单质被还原为I﹣,则试剂X为淀粉﹣KI溶液,故答案为:淀粉﹣KI;(3)①为了方便研究在反应中要采取控制变量方法进行研究,即只改变一个反应条件,其它条件相同,依据表格数据可知,实验Ⅲ跟实验Ⅰ比硫酸体积减少,所以其它条件都相同,而且混合后总体积也要相同,故实验Ⅰ中,x、y、z所对应的数值分别是:8、3、2,故答案为:8、3、2;②对比实验Ⅰ、实验m,可得出的实验结论是:其它条件不变,溶液酸性越强,氢离子浓度越大,即可得出其它条件不变,增大氢离子(或硫酸)浓度可以加快反应速率的结论,故答案为:其它条件不变,增大氢离子(或硫酸)浓度可以加快反应速率。【点评】本题考查反应速率,侧重考查学生控制变量法的掌握情况,试题难度中等。三.解答题(共5小题)18.(2024•广西三模)2023年第19届杭州亚运会上,主火炬塔的燃料首次使用废碳再生的绿色甲醇,实现循环内的零排放,这也是首次在大型体育赛事上使用这种绿色燃料。回答下列问题:(1)已知:①2CH3OH(g)+3O2(g)⇌2CO2(g)+4H2O(l)ΔH1②2H2(g)+O2(g)⇌2H2O(l)ΔH2③H2O(l)⇌H2O(g)ΔH3则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应热ΔH=kJ•mol﹣1(用含ΔH1、ΔH2、ΔH3的代数表示)。(2)在恒容的密闭体系中进行反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是BC(填标号)。(3)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示CO2吸附在催化剂表面;图中*H已省略)①上述合成甲醇的反应历程中,最大能垒(活化能)E正=1.36eV。②下列措施有利于提高平衡时CO2转化率的有b(填标号)。a.使用更高效的催化剂b.加压c.增大CO2的初始投入量(4)恒压下,将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH<0和反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH>0,在相同时间段内CH3OH的选择性和产率随温度的变化如图(其中,CH3OH的选择性=)。①温度高于230℃时,CH3OH的产率随温度升高而降低的原因可能是反应Ⅰ的ΔH<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率降低。②恒压下,通过上述过程合成甲醇的适宜条件是BD(填标号)。A.210℃B.230℃C.催化剂CZTD.催化剂CZ(Zr﹣1)T(5)一定条件下,将2molCO2和4molH2充入密闭容器中,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),CO2的平衡转化率与温度、平衡总压强的关系如图所示。①p1、p2、p3由大到小的顺序为p3>p2>p1。②在p3条件下255℃时,该反应的压强平衡常数Kp=3.645(或)(MPa)﹣2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。【分析】(1)已知:①2CH3OH(g)+3O2(g)⇌2CO2(g)+4H2O(l)ΔH1,②2H2(g)+O2(g)⇌2H2O(l)ΔH2,③H2O(l)⇌H2O(g)ΔH3,盖斯定律计算②×﹣①×+③得到CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应热ΔH;(2)A.反应达到平衡时,甲醇的浓度将会保持不变;B.反应达到平衡状态时二氧化碳的质量分数不变;C.t1时刻后甲醇和二氧化碳的物质的量之比不再发生变化,说明甲醇和二氧化碳的物质的量均保持不变;D.t1时刻后甲醇的物质的量仍在增加,二氧化碳的物质的量在减少;(3)①决定反应速率的步骤是活化能最大的步骤;②a.催化剂不影响转化率;b.反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)为气体体积减小的反应;c.增大CO2和H2的初始投料比,无法提高转化率;(4)①反应Ⅰ的ΔH<0,温度升高,平衡逆向移动;②由图知,当温度为230℃,催化剂为CZ(Zr﹣1)T催化剂时,CH3OH的产率最大;(5)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),反应为气体体积减小的反应,增大压强,平衡正向进行;②在p3条件下255℃时,二氧化碳的转化率为60%,计算平衡分压计算得到该反应的压强平衡常数Kp。【解答】解:(1)已知:①2CH3OH(g)+3O2(g)⇌2CO2(g)+4H2O(l)ΔH1,②2H2(g)+O2(g)⇌2H2O(l)ΔH2,③H2O(l)⇌H2O(g)ΔH3,盖斯定律计算②×﹣①×+③得到CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的反应热ΔH=,故答案为:(2)A.反应达到平衡时,甲醇的浓度将会保持不变,图中t1时刻之后,甲醇的浓度仍在减小,则t1时刻反应未达到平衡状态,故A错误;B.二氧化碳的质量分数不变,说明反应达到平衡状态,故B正确;C.t1时刻后甲醇和二氧化碳的物质的量之比不再发生变化,说明甲醇和二氧化碳的物质的量均保持不变,反应达到平衡状态,故C正确;D.t1时刻后甲醇的物质的量仍在增加,二氧化碳的物质的量在减少,反应未达到平衡状态,故D错误;故答案为:BC;(3)①决定反应速率的步骤是活化能最大的步骤,由图可知,该步骤的化学方程式为*HCOO+*H=*CO+*H2O,最大能垒(活化能)E正=(1.56﹣0.2)eV=1.36eV,故答案为:1.36;②a.催化剂不影响转化率,故a错误;b.反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)为气体体积减小的反应,增大压强可提高转化率,故b正确;c.增大CO2和H2的初始投料比,无法提高转化率,故c错误;故答案为:b;(4)①温度高于230℃时,CH3OH的产率随温度升高而降低的原因可能是:反应Ⅰ的ΔH<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率降低,故答案为:反应Ⅰ的ΔH<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率降低;②由图可知,在催化剂为CZ(Zr﹣1)T、230℃条件下,甲醇的选择性和产率都较高,则合成甲醇的最佳条件为温度为230℃、催化剂为CZ(Zr﹣1)T催化剂,故答案为:BD;(5)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),反应为气体体积减小的反应,增大压强,平衡正向进行,二氧化碳转化率增大,得到p3>p2>p1,故答案为:p3>p2>p1;②在p3条件下255℃时,二氧化碳的转化率为60%,计划三段式列式计算,CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)起始量(mol)2400变化量(mol)1.23.61.21.2平衡量(mol)0.80.41.21.2平衡状态下气体总物质的量=0.8mol+0.4mol+1.2mol+1.2mol=3.6mol,平衡分压p(CO2)=p3×=,p(H2)=p3×=,p(CH3OH)=p(H2O)==,Kp====3.645,故答案为:3.645(或)。【点评】本题主要考查化学反应的能量变化、化学平衡的计算、平衡影响因素等知识,为高频考点,题目难度中等。19.(2024•江西)石油开采的天然气含有H2S。综合利用天然气制氢是实现“碳中和”的重要途径。CH4和H2S重整制氢的主要反应如下:反应Ⅰ:CH4(g)+2H2S(s)⇌CS2(g)+4H2(g)ㅤΔH1=+260kJ/mol反应Ⅱ:CH4(g)⇌C(s)+2H2(g)ㅤΔH2=+90kJ/mol反应Ⅲ:2H2S(g)⇌S2(g)+2H2(g)ㅤΔH3=+181kJ/mol回答下列问题:(1)H2S分子的电子式为。(2)反应Ⅳ:CS2(g)⇌S2(g)+C(s)ㅤΔH4=169kJ/mol。(3)保持反应器进料口总压为100kPa。分别以8kPaCH4、24kPaH2S(He作辅气)与25kPaCH4、75kPaH2S进料。CH4平衡转化率与温度的关系如图1,含有He的曲线为M,理由是总压一定,充入氦气,相当于减压,反应Ⅰ、Ⅱ均正向移动,CH4平衡转化率增大。(4)假设在10L的恒温刚性容器中,通入0.3molCH4和0.15molH2S发生反应Ⅰ、Ⅱ和Ⅲ,起始总压为P0。CH4和H2S的转化率与时间的关系如图2,0~5min内H2的化学反应速率为0.012mol/(L•min);5min时,容器内总压为1.067P0。(5)假设H2S和CH4的混合气体在某固体催化剂上的吸附服从Langmuir等温吸附(吸附分子彼此不发生相互作用,且气体分子为单分子层吸附)。吸附等温式为:其中a是气体的吸附系数,Vm是气体在固体表面的饱和吸附量(标态),P是气体的分压,V是气体分压为P时的平衡吸附量(标态)。在一定温度下,H2S的吸附系数是CH4的4倍,当H2S的分压为2MPa及4MPa,CH4和H2S的分压相同时,H2S平衡吸附量分别为0.6m3/kg和0.8m3/kg(已换算成标态),则H2S的吸附系数为0.4MPa﹣1。(6)与传统天然气制氢中需要脱硫将H2S转化为硫黄和水相比,上述方法优点是H2S得到了综合利用。【分析】(1)H2S分子中含有2个H—S键;(2)根据盖斯定律可知,反应Ⅱ+Ⅲ﹣Ⅰ=Ⅳ,根据ΔH4=ΔH2+ΔH3﹣ΔH1进行计算;(3)总压一定时,充入氦气,相当于减压,反应Ⅰ、Ⅱ均正向移动,CH4平衡转化率增大;(4)由图可知,0~5min内消耗的CH4为0.3mol×5%=0.015mol,消耗的H2S为0.15mol×20%=0.3mol,即两者按照1:2恰好发生反应Ⅰ,则生成H2的物质的量为4n(CH4)=4×0.015mol=0.06mol,0~5min内H2的化学反应速率为v(H2)=进行计算,此时容器内生成的CS2为0.015mol,容器内气体的总量为:(0.3﹣0.015)mol+(0.15﹣0.3)mol+0.015mol+0.06mol=0.48mol,起始总压为P0,气体总量为0.45mol,根据压强之比等于物质的量之比,计算5min时,容器内的总压;(5)根据题意可知方程:①=,②=,联立方程①与②,解出α1即可;(6)与传统天然气制氢中需要脱硫将H2S转化为硫黄和水相比,上述方法优点是H2S得到了综合利用,3步反应均生成了H2。【解答】解:(1)H2S分子的电子式为:,故答案为:;(2)根据盖斯定律可知,反应Ⅱ+Ⅲ﹣Ⅰ=Ⅳ,则CS2(g)⇌S2(g)+C(s)ㅤΔH4=ΔH2+ΔH3﹣ΔH1=(260+90﹣181)kJ/mol=169kJ/mol,故答案为:169;(3)保持反应器进料口总压为100kPa。分别以8kPaCH4、24kPaH2S(He作辅气)与25kPaCH4、75kPaH2S进料。CH4平衡转化率与温度的关系如图1,含有He的曲线为M,理由是总压一定,充入氦气,相当于减压,反应Ⅰ、Ⅱ均正向移动,CH4平衡转化率增大,故答案为:M;总压一定,充入氦气,相当于减压,反应Ⅰ、Ⅱ均正向移动,CH4平衡转化率增大;(4)由图可知,0~5min内消耗的CH4为0.3mol×5%=0.015mol,消耗的H2S为0.15mol×20%=0.3mol,即两者按照1:2恰好发生反应Ⅰ,则生成H2的物质的量为4n(CH4)=4×0.015mol=0.06mol,0~5min内H2的化学反应速率为v(H2)==0.012mol/(L•min),此时容器内生成的CS2为0.015mol,容器内气体的总量为:(0.3﹣0.015)mol+(0.15﹣0.3)mol+0.015mol+0.06mol=0.48mol,起始总压为P0,气体总量为0.45mol,根据压强之比等于物质的量之比,可得5min时,容器内总压为P0≈1.067P0,故答案为:0.012;1.067P0;(5)根据题意可知方程:①=,②=,联立方程①与②,解得:α1=0.4MPa﹣1,故答案为:0.4;(6)与传统天然气制氢中需要脱硫将H2S转化为硫黄和水相比,上述方法优点是H2S得到了综合利用,3步反应均生成了H2,故答案为:H2S得到了综合利用。【点评】本题主要考查盖斯定律的应用,化学反应速率的计算、化学平衡移动的影响因素,同时考查学生对信息的理解与应用的能力,要求较高,难度较大。20.(2024•阜阳模拟)甲醇(CH3OH)属于基础化工原料,在化学工业中占有重要地位。回答下列问题:(1)工业上制备甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH。已知CO2、H2、CH3OH、H2O的能量依次为akJ•mol﹣1、bkJ•mol﹣1、ckJ•mol﹣1、dkJ•mol﹣1,则ΔH=c+d﹣3b﹣akJ•mol﹣1。将物质的量之比1:3的CO2和H2以相同的流速分别通过两种催化剂(Cat﹣a或Cat﹣b),相同时间内测得CO2的转化率随温度
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025版无人机租赁与培训合同3篇
- 2025版环保产业用地租赁协议书3篇
- 燃气灶具维修指南
- 2024年装配式建筑土建工程承包合同范本3篇
- 大型农场桥梁施工合同
- 道路铺设工人合同
- 车站通风管道重建施工合同
- 环保企业行政专员聘用合同
- 2024年生物科技产品研发及购销合同范本3篇
- 2024年版权许可合同标的软件与许可权
- 山东省滨州市2023-2024学年高一上学期1月期末考试 政治 含答案
- 电力行业电力调度培训
- 【MOOC】气排球-东北大学 中国大学慕课MOOC答案
- 全力以赴备战期末-2024-2025学年上学期备战期末考试主题班会课件
- 《庆澳门回归盼祖国统一》主题班会教案
- 物流公司自然灾害、突发性事件应急预案(2篇)
- 《视频拍摄与制作:短视频 商品视频 直播视频(第2版)》-课程标准
- 公司战略与风险管理战略实施
- 2024年-2025年《农作物生产技术》综合知识考试题库及答案
- 24.教育规划纲要(2024-2024)
- 2023-2024学年苏州市八年级语文上学期期末考试卷附答案解析

评论
0/150
提交评论