



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
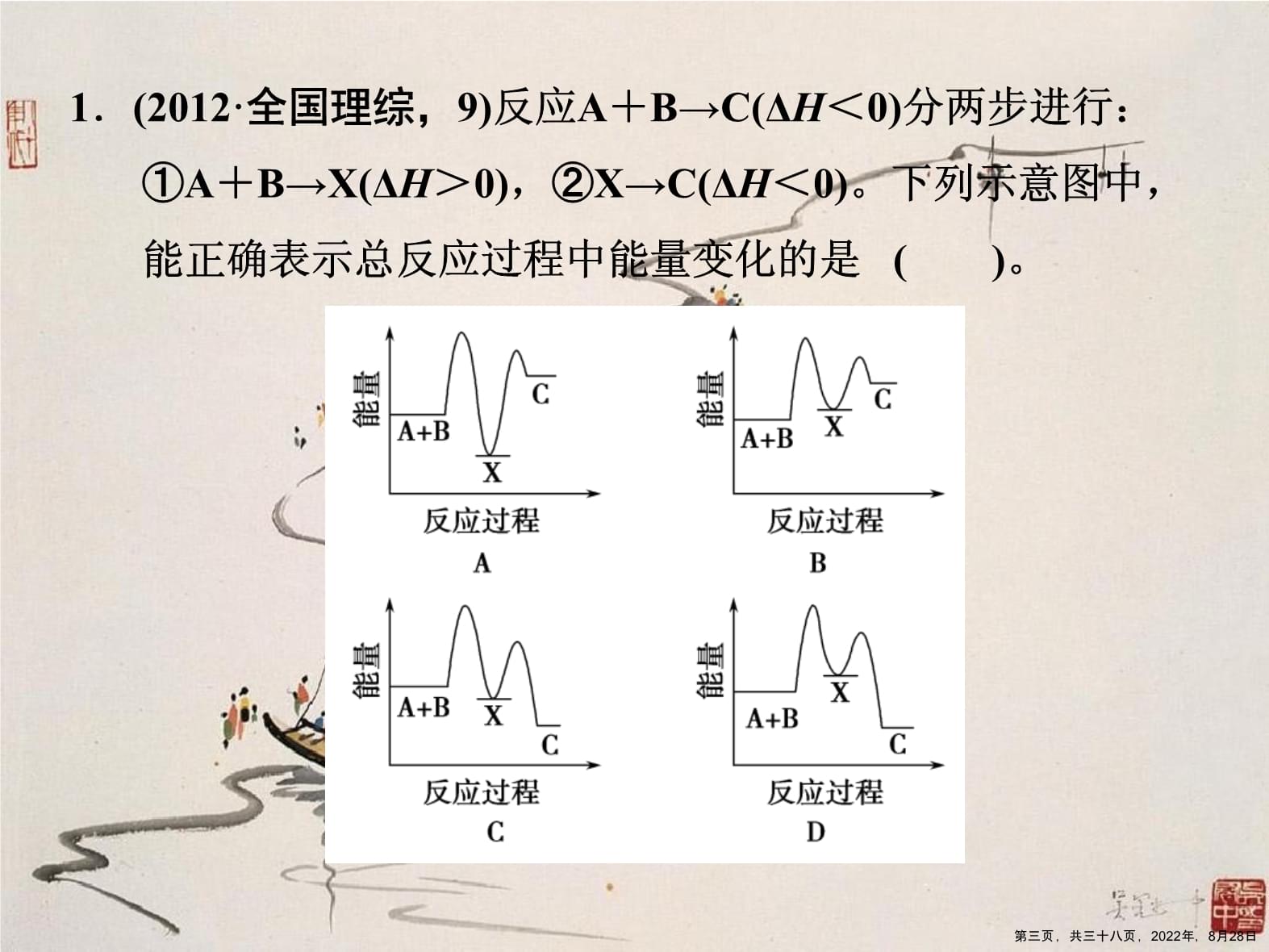
第六讲化学反应与能量变化中的常考问题第一页,共三十八页,2022年,8月28日细研考题定向第二页,共三十八页,2022年,8月28日1.(2012·全国理综,9)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是()。第三页,共三十八页,2022年,8月28日解析[①A+B→XΔH>0,X具有的能量大于A、B能量总和,A、C错误,②X→CΔH<0,A+B→CΔH<0,C具有的能量小于X具有的能量,也小于A、B能量总和,D正确,B错误。]答案D第四页,共三十八页,2022年,8月28日2.(2012·重庆理综,12)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1molN—H键所需的能量(kJ)是()。第五页,共三十八页,2022年,8月28日解析[由题中的图像可以看出断裂1molN2H4(g)和1molO2(g)中的化学键所要吸收的能量为:2752kJ-534kJ=2218kJ设断裂1molN—H键所需要的能量为x则:154kJ+4x+500kJ=(2752-534)kJ解得x=391kJ。]答案B第六页,共三十八页,2022年,8月28日第七页,共三十八页,2022年,8月28日(2)反应A的热化学方程式是________________________。(3)断开1molH—O键与断开1molH—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。解析(3)由题给条件可知,4molHCl被氧化,放出热量为115.6kJ,可知ΔH=-115.6kJ·mol-1;由ΔH=-(生成物键能之和-反应物键能之和)可得,E(H—O)-E(H—Cl)=[115.6+(498-2×243)]/4kJ·mol-1=31.9kJ·mol-1,键能越大,化学键越稳定、越强,所以水中的H—O键比氯化氢中H—Cl键强。第八页,共三十八页,2022年,8月28日第九页,共三十八页,2022年,8月28日第十页,共三十八页,2022年,8月28日解析[A项,忽视了可逆反应;B项中能量相差为35.96kJ;C项中产物的状态相同,稳定性相同;同一物质,固态时能量最低,所以D项正确。]答案D第十一页,共三十八页,2022年,8月28日考查形式 选择题、填空题考向曝光
从近几年高考试题分析来看,本讲所考查内容仍以传统考点为主。
①热化学方程式的书写及正误判断;②比较反应热的大小;③有关反应热的简单计算;④化学键键能与反应热、反应热与能源的综合等。第十二页,共三十八页,2022年,8月28日由于能源问题已成为社会热点,从能源问题切入,从不同的角度设问,结合新能源的开发,把反应热与能源结合起来进行考查,将是2013年的一个命题热点,在二轮复习时一定要引起注意。
第十三页,共三十八页,2022年,8月28日细研考纲定位第十四页,共三十八页,2022年,8月28日1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。2.了解化学能与热能的相互转化;了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。4.了解能源是人类生存和社会发展的重要基础;了解化学在解决能源危机中的重要作用。第十五页,共三十八页,2022年,8月28日知识必记1.从宏观上分析,形成反应热的本质原因是反应物具有的总能量与生成物具有的总能量的相对大小不同;从微观上分析,形成反应热的本质原因是断键时吸收的热量与成键时放出的热量的相对大小,注意从图示上去理解。第十六页,共三十八页,2022年,8月28日<
>
第十七页,共三十八页,2022年,8月28日2.盖斯定律及其应用 化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即不管化学反应是一步完成或分几步完成,其反应热是相同的。如:ΔH1+ΔH2第十八页,共三十八页,2022年,8月28日3.利用盖斯定律计算反应热的模式与要领 (1)计算模式 [方式一]若有(a)A(g)+M(g)===B(g)ΔH1 (b)A(l)+M(g)===B(g)ΔH2 (c)A(g)===A(l)ΔH3 则(c)=(a)-(b),即:ΔH3=ΔH1-ΔH2。 [方式二]若有(a)A(s)+M(g)===B(s)ΔH1 (b)C(s)+M(g)===D(s)ΔH2 (c)A(s)+D(s)===B(s)+C(s)ΔH3 则(c)=(a)-(b),即:ΔH3=ΔH1-ΔH2。第十九页,共三十八页,2022年,8月28日(2)计算要领①当反应方程式乘以或除以某数时,ΔH也应乘以或除以某数。②反应式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”、“-”,即把ΔH看作一个整体进行运算。③通过盖斯定律计算反应热和比较反应热的大小时,同样要把ΔH看作一个整体。④在设计反应过程时常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气时,会吸热;反之会放热。⑤当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。第二十页,共三十八页,2022年,8月28日技能必备热化学方程式的书写的“六大”要点(1)注意ΔH的符号和单位若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”。ΔH的单位为kJ·mol-1。(2)注意反应热的测定条件书写热化学方程式时应注明ΔH的测定条件(温度、压强),但绝大多数ΔH是在25℃、101325Pa下测定的,此时可不注明温度和压强。第二十一页,共三十八页,2022年,8月28日(3)注意热化学方程式中的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此化学计量数可以是整数,也可以是分数。(4)注意物质的聚集状态反应物和产物的聚集状态不同,反应热ΔH不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用↑和↓。第二十二页,共三十八页,2022年,8月28日(5)注意ΔH的数值与符号热化学方程式是表示反应已完成的数量。由于ΔH与反应完成的物质的量有关,所以热化学方程式中化学式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。逆反应的反应热数值相等,但符号相反。第二十三页,共三十八页,2022年,8月28日(6)注意燃烧热和中和热第二十四页,共三十八页,2022年,8月28日细研考点落实第二十五页,共三十八页,2022年,8月28日常考问题14反应热和焓变的分析与判断【题型1】
下列说法或表示方法中,正确的是()。 A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多 B.a℃、bkPa下,将0.5molO2和1.5molH2置于密闭容器中充分反应生成H2O(g),放热ckJ,其热化学方程式为2H2(g)+O2(g)===2H2O(g)ΔH=-2ckJ·mol-1第二十六页,共三十八页,2022年,8月28日C.常温常压下,2.8gCO气体完全燃烧放出的热量为28.26kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g)ΔH=-565.2kJ·mol-1D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.3kJ·mol-1第二十七页,共三十八页,2022年,8月28日破题关键本题考查了热化学方程式书写的技巧,同时也涉及燃烧热、中和热等容易出错的概念,考查内容多,覆盖范围大,是高考的常考题型。硫蒸气含有的能量比等质量的硫固体多,故硫蒸气完全燃烧放出的热量比等质量的硫固体放出的热量多,A正确;B项中的热化学方程式没有标明温度和压强,B错误;燃烧热是指1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物的化学计量数为1,C错误;醋酸电离需吸热,因此稀醋酸溶液与稀NaOH溶液反应的ΔH应大于-57.3kJ·mol-1,D错误。答案A第二十八页,共三十八页,2022年,8月28日(1)反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。(2)反应是否需要加热,只是引发反应的条件,与反应是放热还是吸热并无直接关系。许多放热反应也需要加热引发反应,也有部分吸热反应不需加热,在常温时就可以进行。第二十九页,共三十八页,2022年,8月28日(3)燃烧热:必须生成稳定的化合物,如C燃烧应生成CO2而不是CO,H2燃烧应生成液态水而不是气态水。(4)中和热:强酸和强碱在稀溶液中发生中和反应生成1molH2O,ΔH=-57.3kJ·mol-1。弱酸代替强酸(或弱碱代替强碱),因电离吸热,放出的热量减小,中和热减小。若用浓硫酸(或NaOH固体),放出的热量增多,中和热增大。第三十页,共三十八页,2022年,8月28日√
×
×
×
第三十一页,共三十八页,2022年,8月28日第三十二页,共三十八页,2022年,8月28日第三十三页,共三十八页,2022年,8月28日答案B第三十四页,共三十八页,2022年,8月28日第三十五页,共三十八页,2022年,8月28日【提升2】
已知: 2Zn(s)+O2(g)===2ZnO(s)ΔH=-701.0kJ·mol-1 2Hg(l)+O2(g)===2HgO(s)ΔH=-181.6kJ·mol-1
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 上市公司用章管理制度
- 业主活动之家管理制度
- 五一假期景点管理制度
- 大学生心理健康 培训
- 初三数学教师教学反思
- 大学生心理健康教育研究论文
- 临沂扬尘治理管理制度
- iatf讲师管理制度
- 优化设计制服管理制度
- 产品研发日常管理制度
- 违拗患者的护理
- 汽车的总体构造课件
- 眼科护理中的医疗事故与风险管理
- 煤矿岗位标准化作业流程
- 年产10万吨聚氯乙烯生产工艺设计毕业设计
- 数字美的智慧工业白皮书-2023.09
- 桥梁施工进度图
- 2023年-2024年电子物证专业考试复习题库(含答案)
- 某啤酒厂安全现状评价设计报告书模板
- 汽车电动助力转向系统发展综述外文文献翻译、中英文翻译、外文翻译
- Unit 2 Beethoven a remarkable life Extended Reading 公开课说课课件-2022-2023学年高中英语牛津译林版(2020)选择性必修第一册

评论
0/150
提交评论