



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
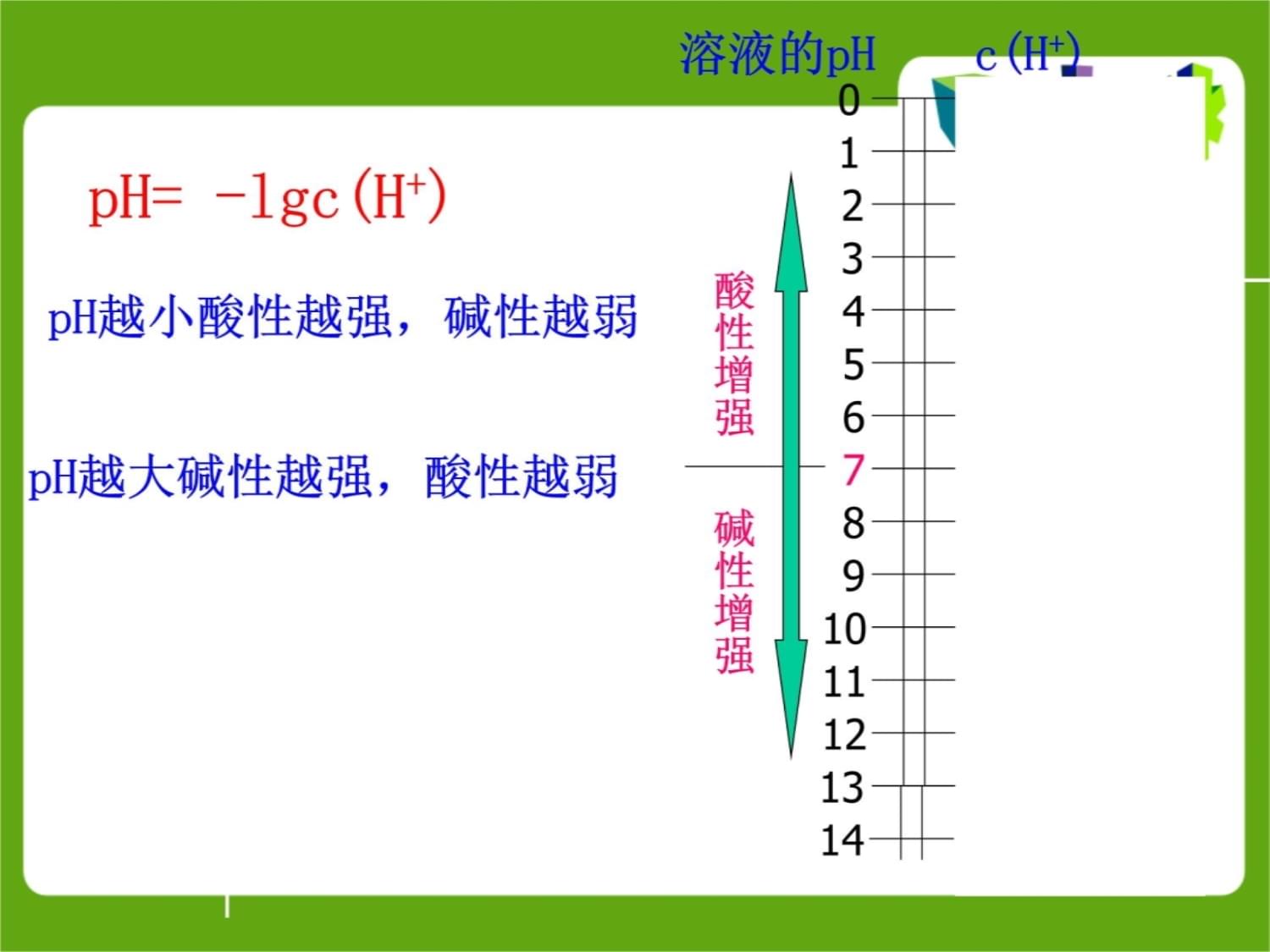
第二单元溶液的酸碱性(化学反应原理)二、溶液的酸碱性的表示方法1、根据H+和OH-浓度的相对大小来描述.c(H+)
=c(OH-)中性碱性酸性c(H+)<c(OH-)c(H+)>c(OH-)但c(OH-)、c(H+)很小时,如c(H+)=10-12mol/L,书写和表示都很不方便。可用pH表示:pH=-lgc(H+)2.溶液的酸碱性与pH的关系(1)溶液pH的定义:pH=
。如0.01mol·L-1的盐酸的pH=
;c(H+)=1.0×10-10mol·L-1的NaOH溶液的pH=
。(2)pH与溶液酸碱性的关系室温下,中性溶液:c(H+)
1.0×10-7mol·L-1,pH=7;酸性溶液:c(H+)
1.0×10-7mol·L-1,pH<7;碱性溶液:c(H+)<1.0×10-7mol·L-1,pH>7。-lgc(H+)=>210生活链接2006年农夫山泉的广告:“农夫山泉是天然的弱碱性水,pH值为7.3(±0.5)
,健康的生命需要喝着这样的水,能在不知不觉间将身体的酸碱平衡调节到完美”。
“农夫山泉门”1.定性测定:酸碱指示剂法.酸碱指示剂一般是弱的有机酸或弱的有机碱.如:(HIn代表石蕊分子)指示剂的变色范围HIn(红色)
H++In-
(蓝色)【问题】:如何知道溶液的酸碱性?一、测定溶液酸碱性的常用方法3.1—4.45.0—8.08.0—10.02.定量测定:pH试纸法、pH计法等.(1).pH试纸法:广范pH试纸、精密pH试纸能否直接把pH试纸伸到待测液中?是否要先湿润pH试纸后,再将待测液滴到pH试纸上?如用湿润的pH试纸检验待测液,对测定的pH值A.一定有影响B.偏大C.偏小D.不确定试纸的使用方法:
将pH试纸放在洁净干燥的玻璃片或表面皿上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比并读数.一、测定溶液酸碱性的常用方法交流与讨论pH试纸变色强酸性
弱酸性中性弱碱性
强碱性
若pH试纸湿润后,相当于将溶液稀释,因此会使溶液pH发生变化。若测酸性溶液,则会使pH变大,若测碱性溶液,则pH变小,而若测的是中性溶液,则溶液pH不发生变化。1、求下列溶液的pH0.1molL-1的盐酸
pH=-lgC(H+)KWC(OH-)=-lg三、溶液pH的计算10.1molL-1的醋酸(α=1.0%)3溶液pH的计算下列溶液肯定是酸性的是 ()A.含H+的溶液B.能使酚酞显无色的溶液C.pH<7的溶液D.c(OH-)<c(H+)的溶液例1D以纯水在100℃为例,KW=1×10-12,c(H+)=1×10-6mol·L-1,pH=6,但溶液为中性,故pH<7的溶液可能是酸性,也可能呈中性或碱性。2、pH=10的氢氧化钠溶液稀释到100倍体积,所得溶液的pH值为多少?结论pH=10c(H+)=1×10-10mol·L-1稀释后:c(H+)=1×10-12mol·L-1稀释后:pH=12解法1:c(OH-)=1×10-4mol·L-1解法2:pH=10c(H+)=1×10-10mol·L-1稀释后:c(OH-)=1×10-6mol·L-1稀释后:c(H+)=1×10-8mol·L-1稀释后:pH=8×√c(OH-)=1×10-4mol·L-1解:pH=10c(H+)=1×10-10mol·L-1稀释后:c(OH-)=1×10-9mol·L-1稀释后:c(H+)=1×10-5mol·L-1稀释后:pH=5若加水稀释105倍后呢?
酸或碱性溶液无限稀释时,pH均约为7×酸、碱溶液pH值的求算基本原则:酸——直接由c(H+)求;碱——先求c(OH-),后换算成c(H+)求;稀释的趋势——总是向中间靠拢,无限稀释约为7。②碱:计算稀释后的溶液中的c(OH-),换算成c(H+)再求出PH值。例3:在25℃时,pH值等于9的NaOH溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后,pH值等于多少?例2:在25℃时,pH值等于9的氨水稀释到原来的10倍,pH值等于多少?稀释到1000倍后,pH值等于多少?溶液的稀释总结⒈若为强酸,pH=a,稀释10n,,pH=a+n;2.若为弱酸,pH=a,稀释10n,pH<a+n;(*酸的溶液无限稀释,无论酸的强弱,pH一律接近于7)3.若为强碱,pH=a,稀释10n,pH=a-n.;4.若为弱碱,pH=a,稀释10n,pH>a-n;(*碱的溶液无限稀释,则无论碱的强弱,pH一律接近于7)。
5、25℃时将pH=1的盐酸溶液和pH=4的盐酸溶液等体积混合,求混合后的PH值?(lg2=0.3)≈10-1×1/2解:C(H+)混=10-1v+
10-4v
2vpH=-lgC(H+)=1+lg2≈1.3强酸与强酸等体积混合的计算△pH>2的两强酸等体积混合时:pH混=pH小+0.3强碱与强碱等体积混合的计算解:6、在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合pH等于多少?c(OH-)=(v×10-5+v×10-3)/(v+v)=5×10-4=10.7pH=11–lg2c(H+)=1×10-14
/(5×10-4)=2×10-11△pH>2的两强碱等体积混合时:pH混=pH大-0.3强酸与强碱混合的计算8、在25℃时,99mLO.1mol/L的硫酸与101mL0.1mol/L的氢氧化钡溶液混合后,溶液的pH等于多少?解:Ba(OH)2+H2SO4=BaSO4↓+2H2O0.00990.0101关键:抓住氢氧根离子过量进行计算!pH=12-lg5=11.3c(OH-)=(101×0.1×2-99×0.1×2)/(101+99)=2×10-3c(H+)=(1×10-14
/(2×10-3)=5×10-12溶液混合后pH的计算步骤:1)先判断混合后溶液的酸碱性2)若为酸性,先求c(H+),再求pH。若为碱性,先求c(OH-),依据c(H+)=KW/c(OH-),再求pH。第二单元第二课时
酸碱中和滴定
①污水如果含有OH-
该如何检验?1、定性检验-离子特征反应酚酞或PH试纸【思考】pH的变化本身有没有现象?
如:向NaOH溶液中滴加稀盐酸,由于NaOH中OH-被滴入的盐酸中的H+逐渐中和,c(OH-)逐渐减小,溶液pH就逐渐减小,当H+与OH-恰好完全反应时,H++OH-=H2O,溶液呈中性,pH=7。
酸碱中和反应中pH的变化因为pH的变化本身没有现象,因此需要用一种试剂来指示它的变化,这种试剂就是酸碱指示剂。1、酸碱中和滴定的原理在滴定达到终点(即酸碱恰好反应)时:n(H+)=n(OH-)
即:c(酸)V(酸)=c(碱)V(碱)知C(A)量取VB,读出VA,即可求出C(B)2、酸碱中和滴定的关键(1)准确测量两种溶液的体积(2)准确判断中和反应什么时候“恰好”完全(即滴定终点的判断)一、酸碱中和滴定的原理酸碱中和滴定
酸碱中和滴定是利用已知浓度的酸(或碱)去滴定一定体积未知浓度的碱(或酸),通过测定反应完全时消耗已知浓度的酸(或碱)的体积,从而推算出未知浓度的碱(或酸)的浓度的方法。【实验】向20mL0.1000mol/L的盐酸中滴加0.1000mol/L的NaOH溶液,观察指示剂的变化情况,绘出pH的变化曲线图。pH计、酸式滴定管、碱式滴定管,烧杯、锥形瓶、滴定管夹、铁架台
1.实验仪器碱式滴定管:不能盛放酸性溶液和强氧化性溶液。酸式滴定管:不能盛放碱液和水解显碱性的溶液。滴定管和滴定管的使用*三、滴定管的构造特点应读到小数点后几位?两位a.检验滴定管是否漏水。b.洗涤滴定管后要用反应液洗涤2--3次,并排出下端尖嘴处的气泡。c.注入反应液至“0”刻度上方2-3厘米处。d.将溶液调节到“0”刻度或“0”刻度以下某一刻度。e.记录刻度。滴定管的常规操作(检查漏水,润洗,装液,排除尖嘴处的气泡,读数等)。点击播放动画滴定管:酸式滴定管和碱式滴定管。操作:①检查②洗涤:先水洗,再用待装液润洗2-3次⑤放出反应液④排气泡、调液面、记读数③装液标准溶液:已知准确浓度的溶液用途:精确的测出一定体积的溶液【思考】如何判定酸碱反应的终点?
2.操作过程操作要点:用左手控制酸式滴定管活塞,右手不断按顺时针摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,先快后慢,当接近终点时,应一滴一摇。终点判定:最后一滴应刚好使指示剂颜色发生明显的改变,而且30秒内不恢复原色,即为反应终点。3.数
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 山西省长治市屯留县第一中学2026届数学高一下期末监测试题含解析
- 2025年江财辅导员笔试题及答案
- 2025年儿童培训机构老师笔试及答案
- 2025年万物云客服主管面试题库及答案
- 2025年玉溪市幼儿教资面试题库及答案
- 2025年吉安市初中英语面试题库及答案
- 2024年西安明德理工学院马克思主义基本原理概论期末考试题带答案解析(必刷)
- 2025年海南洛桑旅游大学马克思主义基本原理概论期末考试模拟题及答案解析(必刷)
- 2024年进贤县幼儿园教师招教考试备考题库附答案解析
- 2024年黄平县招教考试备考题库带答案解析
- 非标压力容器培训课件
- (2025年)教育博士(EdD)教育领导与管理方向考试真题附答案
- 山西十五五规划
- 咯血的急救及护理
- 2025初三历史中考一轮复习资料大全
- 粮库安全生产工作计划
- 涉诉涉法信访课件
- 砂石料购销简单版的合同
- 春运安全行车知识培训课件
- 2025年湖北十堰武当山机场招聘笔试备考题库(带答案详解)
- 中药香囊作用大课件

评论
0/150
提交评论