



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
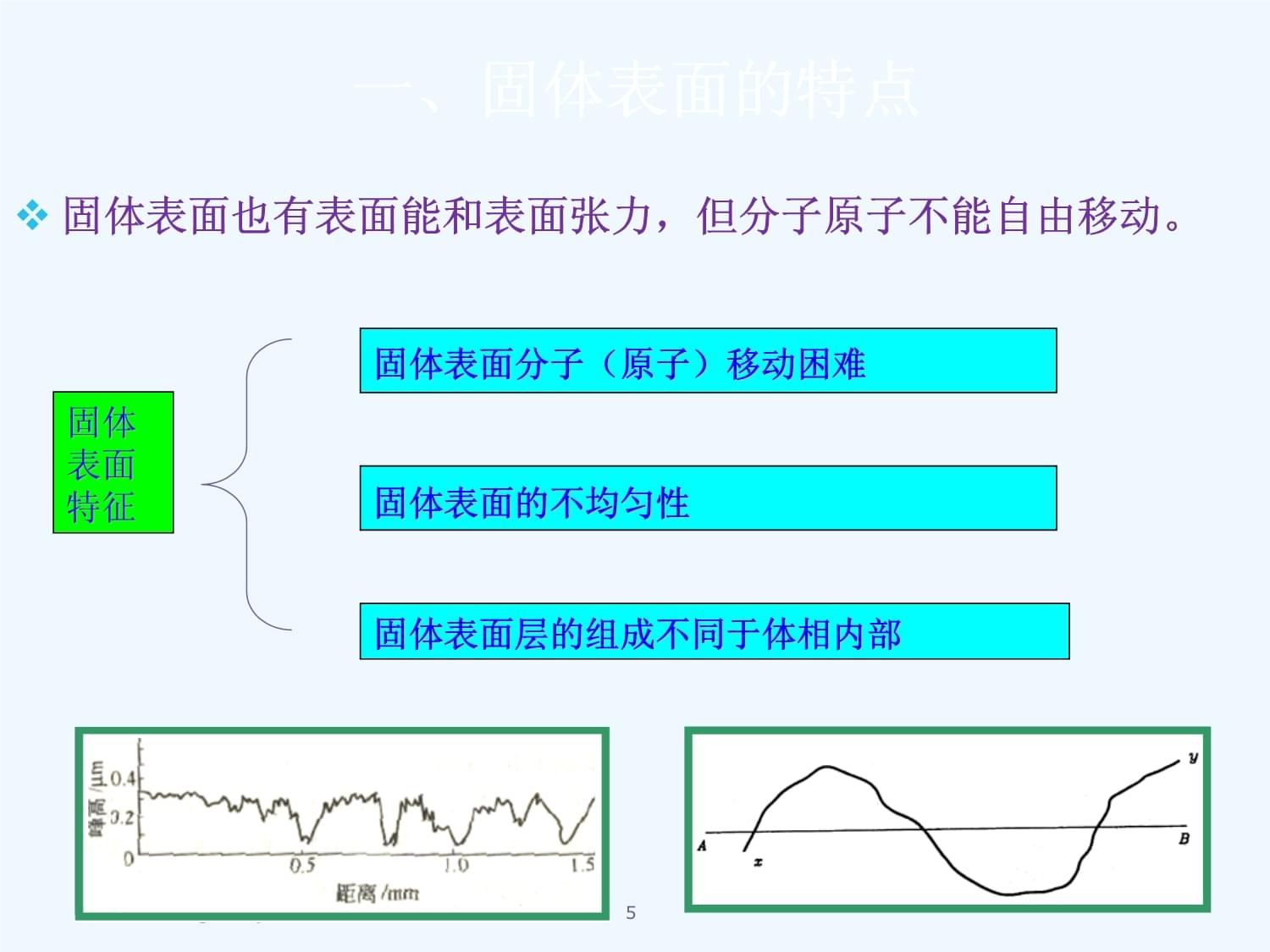
第七章吸附作用与吸附剂东北石油大学石油工程学院第七章吸附作用与吸附剂东北石油大学石油工程学院第七章吸附作用和吸附剂第五节第四节固体-溶液界面吸附第三节固-气界面吸附的影响因素第二节吸附等温方程式第一节固—气界面上的吸附作用第七章吸附作用和吸附剂第五节第四节固体-溶液界面吸附第2第一节固体表面的吸附作用东北石油大学石油工程学院第一节固体表面的吸附作用东北石油大学石油工程学院固体表面的吸附作用一、固体表面的特点二、吸附作用和吸附热三、吸附曲线四、吸附量测定的实验方法固体表面的吸附作用一、固体表面的特点4一、固体表面的特点固体表面也有表面能和表面张力,但分子原子不能自由移动。固体表面特征固体表面分子(原子)移动困难
固体表面的不均匀性固体表面层的组成不同于体相内部一、固体表面的特点固体表面也有表面能和表面张力,但分子原子不5二、吸附作用和吸附热1、基本概念:吸附作用:因为物体表面上的原子或分子力场的不饱和,有吸引其它分子的能力。是固体表面最重要的性质之一。吸附质:被吸附的物质。吸附质可以是气体或液体。为了测定固体的比表面,常用的吸附质有:氮气、水蒸气、苯或环己烷的蒸汽等。吸附剂:能吸附别的物质的物质,吸附剂为固体且常为多孔性固体。常用的吸附剂有:硅胶、分子筛、活性炭等。二、吸附作用和吸附热1、基本概念:62.物理吸附和化学吸附性质物理吸附化学吸附吸附力范德华力化学键力吸热学近于液化热,约几千卡/克分子近于反应热,大于10千卡/克分子选择性无有吸附层单或多分子层单分子层吸附速度快,不需要活化能慢,需活化能可冷子管性可逆不可逆发生吸附的温度低于吸附临界温度远高于吸附质沸点2.物理吸附和化学吸附性质物理吸附化学吸附吸附力范德华力化学7H2在金属镍表面发生物理吸附
这时氢没有解离,两原子核间距等于Ni和H的原子半径加上两者的范德华半径。
放出的能量ea等于物理吸附热Qp,这数值相当于氢气的液化热。
在相互作用的位能曲线上,随着H2分子向Ni表面靠近,相互作用位能下降。到达a点,位能最低,这是物理吸附的稳定状态。
如果氢分子通过a点要进一步靠近Ni表面,由于核间的排斥作用,使位能沿ac线升高。H2在金属镍表面发生物理吸附www.themegallery8H2在金属镍表面发生化学吸附
在相互作用的位能线上,H2分子获得解离能DH-H,解离成H原子,处于c'的位置。
随着H原子向Ni表面靠近,位能不断下降,达到b点,这是化学吸附的稳定状态。
Ni和H之间的距离等于两者的原子半径之和。
能量gb是放出的化学吸附热Qc,这相当于两者之间形成化学键的能。
随着H原子进一步向Ni表面靠近,由于核间斥力,位能沿bc线迅速上升。H2在金属镍表面发生化学吸附在相互作用的位能线上,H9Ni加氢脱氢催化剂原理
H2分子在Ni表面吸附是在物理吸附过程中提供一点活化能,就可以转变成化学吸附。
H2分子从P’到达a点是物理吸附,放出物理吸附热Qp,这时提供活化能Ea,使氢分子到达P点,就解离为氢原子,接下来发生化学吸附。
活化能Ea远小于H2分子的解离能,这就是Ni为什么是一个好的加氢脱氢催化剂的原因。Ni加氢脱氢催化剂原理H2分子在Ni表面吸附是在物理吸附10Ni加氢脱氢催化剂原理
脱氢作用沿化学吸附的逆过程进行,所提供的活化能等于Qc+Ea,使稳定吸附的氢原子越过这个能量达到P点,然后变成H2分子沿PaP’线离开表面。Ni加氢脱氢催化剂原理脱氢作用沿化学吸附的逆过程进行,所11二、吸附作用和吸附热3、吸附热
定义:在吸附过程中的热效应称为吸附热。物理吸附过程的热效应相当于气体凝聚热,很小;化学吸附过程的热效应相当于化学键能,比较大。
取号:吸附是放热过程,但习惯把吸附热都取成正值。固体在等温、等压下吸附气体是一个自发过程,ΔG<0,气体从三维运动变成吸附态的二维运动,熵减少,ΔS<0,ΔH=ΔG+TΔS,ΔH<0。二、吸附作用和吸附热3、吸附热12三、吸附曲线1、基本概念:吸附量通常有两种表示方法:(1)单位质量的吸附剂所吸附气体的体积。(2)单位质量的吸附剂所吸附气体物质的量。吸附曲线:固体吸附气体时,吸附量和温度、压力的关系曲线,即:。三、吸附曲线1、基本概念:132、几种吸附曲线固定一个变量,求出另外两个变量之间的关系,例如:(1)T=常数,Γ
=f(p),得吸附等温线。
2、几种吸附曲线固定一个变量,求出另外两个变量之间的关系,例142、几种吸附曲线(2)p=常数,Γ=f(T),得吸附等压线。2、几种吸附曲线(2)p=常数,Γ=f(T),得吸附152、几种吸附曲线(3)Γ=常数,p=f(T),得吸附等量线。2、几种吸附曲线(3)Γ=常数,p=f(T),得吸163、吸附等温线的类型psvm吸附量第Ⅰ类吸附等温线Langmuir称为单分子吸附类型,即Langmuir型。室温下,氨、氯乙烷等在炭上的吸附及低温下氮在细孔硅胶上的吸附常属于此类型。化学吸附通常为此类等温线。当吸附剂孔半径在1.0~1.5nm以下微孔吸附剂上的吸附等温线属于这种类型。此种等温线在远低于ps的情况下,固体表面已经吸附满了单分子层此时的吸附量为饱和吸附量。Vm—饱和吸附量3、吸附等温线的类型psvm吸附量第Ⅰ类吸附等温线Langm173、吸附等温线的类型第Ⅱ类吸附等温线,称为
S型等温线。是常见的物理吸附等温线。吸附量vmpsB特点是:在低压下首先形成单分子层吸附(相当于B点,此时为饱和吸附),随着压力的增加,逐渐产生多分子层吸附,当压力相当高时,吸附量又急剧上升,表明吸附的气体已经开始凝结为液相。这种吸附剂孔半径相当大(可以近似看成无孔),通常在10nm以上-78℃下,CO2在硅胶上及室温下水蒸气在特粗孔硅胶上的吸附常表现为此类型3、吸附等温线的类型183、吸附等温线的类型第Ⅲ类等温线。这种类型较少见。在低压下等温线为凹的,说明吸附质和吸附剂之间的相互作用很弱。但压力稍增加,吸附量级强烈增大。当压力近于ps时便和Ⅱ型等温线相似,曲线呈现出于纵轴平行的渐近线,表明吸附剂的表面上由多层吸附逐渐转变为吸附质的凝聚。低温下Br在硅胶上的吸附属于此类。ps3、吸附等温线的类型第Ⅲ类等温线。这种类型较少见。在低压下等193、吸附等温线的类型第Ⅳ类等温线。低压下为凸的,表明吸附质和吸附剂有相当强的亲和力,并且也易于确定像在Ⅱ型等温线B点的位置(相当于盖满了单分子层的饱和吸附量)。psB随着压力增加,又由多层吸附逐渐产生毛细管凝结,所以吸附量强烈增大。最后由于毛细孔中均装满吸附质液体,故吸附量不再增加,等温线又趋于平缓。室温下,苯蒸气在氧化铁凝胶上的吸附属于这种类型。3、吸附等温线的类型第Ⅳ类等温线。低压下为凸的,表明吸附质和203、吸附等温线的类型第Ⅴ类等温线。低压下为凹的(和第Ⅲ类等温线低压下相似)。ps随着压力的增加也产生多分子层和毛细管凝结,此种情况和第Ⅳ类等温线高压部分相似。发生多分子层吸附,有毛细凝聚现象。373K时,水蒸汽在活性炭上的吸附属于这种类型。3、吸附等温线的类型第Ⅴ类等温线。低压下为凹的(和第Ⅲ类等温21四、吸附量测定的实验方法
将气体与吸附剂放在一起。达到平衡后,用适当方法测定其吸附量。静态法通常分为重量法和容量法两种。
静态法是经典方法,所得到的数据具有较好的准确度和精密度。但是达到吸附平衡比较慢,仪器装置比较复杂,而且需要高真空系统。为了克服这些困难,可采用动态法来测定吸附量。动态法静态法四、吸附量测定的实验方法将气体与吸附剂放在一起22四、吸附量测定的实验方法重量法测定气体吸附
实验装置如图。将吸附剂放在样品盘3中,吸附质放在样品管4中。首先加热炉子6,并使体系与真空装置相接。到达预定温度和真空度后,保持2小时,脱附完毕,记下石英弹簧2下面某一端点的读数。
根据加样前后该端点读数的变化,可知道加样品后石英弹簧的伸长,从而算出脱附后净样品的质量。四、吸附量测定的实验方法重量法测定气体吸附23四、吸附量测定的实验方法容量法测定气体吸附预先将吸附质气体或蒸汽装在贮气瓶4中,将一定量的吸附剂装入样品管1中,加热、真空脱附,然后放在恒温缸中关上活塞。从贮气瓶4中放出一定量气体,用压力计读出压力;再打开样品管活塞,达吸附平衡后再读取压力。从压差的变化,用气体状态方程可计算吸附量。用量气管中水银液面的升降,调节系统中的压力和体积,可得到不同压力下的吸附量,从而可绘出吸附等温线。四、吸附量测定的实验方法容量法测定气体吸附24四、吸附量测定的实验方法动态法吸附实验用气相色谱动态法研究气体或蒸汽的吸附,既快速又准确。实验装置如示意图所示。将活化好的吸附剂装在吸附柱6中,将作为载气的惰性气体N2或He与适量的吸附质蒸汽混合通过吸附柱。分析吸附后出口气的成分或分析用惰性气体洗下的被吸附气体的成分,从自动记录仪或与之联结的微处理机处理的结果,就可以得到吸附量与压力的关系、吸附等温线、比表面、孔分布等有用信息。四、吸附量测定的实验方法动态法吸附实验25第二节吸附等温式东北石油大学石油工程学院第二节吸附等温式东北石油大学石油工程学院26吸附等温式一、Freundlich吸附等温式二、
Langmuir吸附等温式—单分子层吸附理论三、BET吸附等温式——多分子层吸附理论吸附等温式一、Freundlich吸附等温式27一、Freundlich吸附等温式Freundlich吸附等温式有两种表示形式:V:吸附体积,ml;
p:体系压力,Pa;K、n为常数
K~温度、吸附剂种类
n~吸附体系,决定了吸附等温线形状Freundlich吸附公式对θ的适用范围比Langmuir公式要宽。一、Freundlich吸附等温式Freundlich吸附等28二、
Langmuir吸附等温式—单分子层吸附理论固体表面设总共有Vm个位置,已经占据V个位置二、Langmuir吸附等温式—单分子层吸附理论固体表面设29二、
Langmuir吸附等温式—单分子层吸附理论θ称为覆盖度。
当μ代表单位时间内碰撞在单位表面上的分子数,a代表碰撞分子中被吸附的分数,则吸附速度为μa(1-θ)。则根据假设(1)、(2),单位时间、单位表面上解吸的分子数只与被覆盖的分数θ成正比。所以解吸为γθ。γ是解吸速度的比例常数,当θ=1,γ等于解吸速度,因此二、Langmuir吸附等温式—单分子层吸附理论θ称为覆盖30二、
Langmuir吸附等温式—单分子层吸附理论带入上式得式中Langmuir式也可写成由分子运动论得又由联立两式二、Langmuir吸附等温式—单分子层吸附理论带入上式得31二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附等温式的意义bpbpn
bpbp二、Langmuir吸附等温式—单分子层吸附理论www.t32二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附方程还可以写成如下形式
如果用p/v对p作图是一条直线,说明Langmuir吸附方程可以由直线的斜率和截矩求得Vm和b值,由Vm值可以进一步计算吸附剂比表面So,其计算方程式为
式中,NA是阿伏加德罗常数,按原假定Ao是固体表面一个吸附位置的面积,后来逐渐用吸附分子的截面积所代替。二、Langmuir吸附等温式—单分子层吸附理论www.t33二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附等温式的缺点:
1.假设吸附是单分子层的,与事实不符。
2.假设表面是均匀的,其实大部分表面是不均匀的。
3.在覆盖度θ
较大时,Langmuir吸附等温式不适用。
一般说,多数的物理的吸附是多分子层。所以在压力比较大时,就不遵循Langmuir吸附式。但绝大多数的化学吸附是单分子层的。如果覆盖度较小、吸附热变化不大时,实验结果能比较好地与Langmuir吸附式相符。二、Langmuir吸附等温式—单分子层吸附理论Langm34二、
Langmuir吸附等温式—单分子层吸附理论混合吸附
如果气相中含有A、B两种气体,它们都能在固体表面上形成单分子层吸附。这种混合吸附的情况在多相催化中是经常遇到的。在分压pA、pB下,固体表面上的覆盖度也不一样。分别以θA、θB表示。当吸附到达平衡时,A、B两种气体各自的吸附与解吸速度相等,所以或二、Langmuir吸附等温式—单分子层吸附理论混合吸附35二、
Langmuir吸附等温式—单分子层吸附理论联立解以上两式,可以得到A、B两种气体混合吸附的Langmuir等温方程式
从以上两式可以看到,两种气体混合时,将互相抑制。当一种气体吸附很强时,另一种气体的吸附基本上可略而不计,因为1+bApA>>bBpB。二、Langmuir吸附等温式—单分子层吸附理论联立解以上36二、
Langmuir吸附等温式—单分子层吸附理论解离吸附达到吸附平衡时:则Langmuir吸附等温式可以表示为:对于一个吸附质分子吸附时解离成两个粒子的吸附二、Langmuir吸附等温式—单分子层吸附理论解离吸附达37例题例题:在0℃时,CO在2.964g木炭上吸附的平衡压力p与吸附气体标准状态体积V如下:(1)试用图解法求朗格缪尔公式中常数Vm和b;(2)求CO压力为5.33×104Pa时,1g木炭吸附的CO标准状况体积。解:朗格缪尔等温式为将题给数据整理后列表如下:例题例题:在0℃时,CO在2.964g木炭上吸附的平衡38例题(1)以p/V对p作图(图略),得一直线,其斜率为:截距为:(2)由图上查出,当例题(1)以p/V对p作图(图略),得一直线,其斜39三、BET吸附等温式—多分子层吸附理论
由Brunauer-Emmett-Teller三人提出的多分子层吸附公式简称BET公式。
他们接受了Langmuir理论中关于固体表面是均匀的观点,但他们认为吸附是多分子层的。当然第一层吸附与第二层吸附不同,因为相互作用的对象不同,因而吸附热也不同。在这个基础上他们导出了BET吸附二常数公式。三、BET吸附等温式—多分子层吸附理论由Brunau40BET吸附等温式
式中两个常数为c和Vm,c是与吸附热有关的常数,Vm为铺满单分子层所需气体的体积。p和V分别为吸附时的压力和体积,p0是实验温度下吸附质的饱和蒸汽压。BET吸附等温式式中两个常数为c和Vm,c是与41BET吸附等温式为了使用方便,将二常数公式改写为:S0是吸附质分子的截面积,要换算到标准状态(STP)。式中用实验数据 对 作图,得一条直线。从直线的斜率和截距可计算两个常数值c和Vm,从Vm(单位ml/g)可以计算吸附剂的比表面:BET吸附等温式为了使用方便,将二常数公式改写为:S0是吸附42
如果吸附层不是无限的,而是有一定的限制,例如在吸附剂孔道内,至多只能吸附n层,则BET公式修正为三常数公式:若n=1,为单分子层吸附,上式可以简化为Langmuir公式。若n=∞,(p/p0)∞→0,上式可转化为二常数公式。三常数公式一般适用于比压在0.35~0.60之间的吸附。如果吸附层不是无限43例题例题:1.876g某催化剂在不同压力下吸附丁烷,所得吸附数据如下:
p/kPa:7.9111.9316.6920.8823.9024.99
V/ml:17.0920.6223.7426.0927.7728.03已知:0℃丁烷饱和蒸汽压为103.24kPa,正丁烷分子截面积为0.446nm2试计算催化剂的比表面积。解:由表可得以下数据:
0.0730.1160.1620.2020.2320.242
4.616.368.149.710.8811.28以对作图。得斜率:38.95截距:1.85例题例题:1.876g某催化剂在不同压力下吸附丁烷,所44例题即:
例题即:45第三节固-气界面吸附的影响因素东北石油大学石油工程学院第三节固-气界面吸附的影响因素东北石油大学石油工程学院46固-气界面吸附的影响因素一、温度二、压力三、吸附质和吸附剂的性质固-气界面吸附的影响因素一、温度47固-气界面吸附的影响因素
影响固-气界面的因素很多,当外界条件固定时,体系的性质,即吸附剂和吸附质分子的本性是根本因素。一、温度气体吸附是放热过程,因此,无论是物理吸附还是化学吸附,温度升高,吸附量减少。当然在实际工作中,要根据体系的性质和需要来确定具体的吸附温度。二、压力无论是物理吸附还是化学吸附,压力增加,吸附量增加。固-气界面吸附的影响因素影响固-气界面的因素很多,当外界48固-气界面吸附的影响因素三、吸附质和吸附剂的性质基本规律:①极性吸附剂易吸附极性吸附质;②非极性剂易吸附非极性吸附质;③无论是极性还是非极性吸附剂,一般吸附质分子越复杂,沸点越高,被吸附的能力越强。因为,分子结构越复杂,分子间作用力就越大;沸点越高,气体的凝结力越大,这些都有利于吸附;④酸性吸附剂易吸附碱性吸附质。⑤吸附剂的孔结构。固-气界面吸附的影响因素三、吸附质和吸附剂的性质49第四节固体-溶液界面吸附东北石油大学石油工程学院第四节固体-溶液界面吸附东北石油大学石油工程学院50固体-溶液界面吸附一、概述二、吸附剂、溶质和溶剂的性质对吸附量的影响三、对电解质的吸附四、对高分子的吸附固体-溶液界面吸附一、概述51一、概述特点:溶液中的吸附比气体吸附速率慢。
因为吸附质分子在溶液中的扩散速度比在气体中慢;固体表面有一层液膜,溶质分子必须通过这层膜才能被吸附。吸附量测定简单一、概述特点:52二、吸附剂、溶质和溶剂的性质对吸附量的影响1.同系物的吸附规则
吸附量随碳链增长而增加。活性炭对脂肪酸的吸附量大小关系如图:
丁酸>丙酸>乙酸>甲酸原因:活性碳为非极性物。二、吸附剂、溶质和溶剂的性质对吸附量的影响1.同系物的吸附规53二、吸附剂、溶质和溶剂的性质对吸附量的影响2、溶质的溶解度对吸附量的影响
溶解度越小,越容易被吸附。因为溶质溶解度越小,说明溶质与溶剂之间的相互作用力相对地越弱,则被吸附的倾向就越大。3、温度的影响溶液吸附一般也是放热反应,所以温度升高,吸附量减小。但对有些体系,溶液的吸附是吸热过程,吸附量随温度升高而增大。二、吸附剂、溶质和溶剂的性质对吸附量的影响2、溶质的溶解度对544、吸附剂孔径大小的影响
对孔吸附剂来说,孔径越小,向孔径内扩散速度越慢,吸附时间长,且只有尺寸小于孔径的溶质分子才能被吸附。5、盐对吸附的影响
盐的加入,影响溶质与溶剂之间的相互作用,也会对吸附量产生影响。如果加入的盐使溶质的溶解度减小,则吸附量会因盐的加入而增大。二、吸附剂、溶质和溶剂的性质对吸附量的影响4、吸附剂孔径大小的影响二、吸附剂、溶质和溶剂的性质对吸附量55三、对电解质的吸附1、离子交换吸附
指离子交换剂(固体)在电解质溶液中吸附某种离子时,必有等量的同电荷离子从固体上交换出来。2、选择性吸附三、对电解质的吸附1、离子交换吸附2、选择性吸附56四、对高分子的吸附1、高分子吸附的特点★高分子的分子体积大,形状可变,在良溶剂中可以舒展成带状,在不良溶剂中卷曲成团,吸附时成多点吸附,且脱附困难;★由于高分子总是多分散性的,所以吸附时与多组分吸附相似;★由于分子量大,移动慢,向固体孔内扩散时受到阻碍,所以吸附平衡极慢;★吸附量常随温度升高而增加。四、对高分子的吸附1、高分子吸附的特点★高分子的分子体积大,57四、对高分子的吸附2、高分子在固体表面的吸附形态单点多点多点-平躺无规线团不均匀链段多层吸附四、对高分子的吸附2、高分子在固体表面的吸附形态58ThankYou!ThankYou!第七章吸附作用与吸附剂东北石油大学石油工程学院第七章吸附作用与吸附剂东北石油大学石油工程学院第七章吸附作用和吸附剂第五节第四节固体-溶液界面吸附第三节固-气界面吸附的影响因素第二节吸附等温方程式第一节固—气界面上的吸附作用第七章吸附作用和吸附剂第五节第四节固体-溶液界面吸附第61第一节固体表面的吸附作用东北石油大学石油工程学院第一节固体表面的吸附作用东北石油大学石油工程学院固体表面的吸附作用一、固体表面的特点二、吸附作用和吸附热三、吸附曲线四、吸附量测定的实验方法固体表面的吸附作用一、固体表面的特点63一、固体表面的特点固体表面也有表面能和表面张力,但分子原子不能自由移动。固体表面特征固体表面分子(原子)移动困难
固体表面的不均匀性固体表面层的组成不同于体相内部一、固体表面的特点固体表面也有表面能和表面张力,但分子原子不64二、吸附作用和吸附热1、基本概念:吸附作用:因为物体表面上的原子或分子力场的不饱和,有吸引其它分子的能力。是固体表面最重要的性质之一。吸附质:被吸附的物质。吸附质可以是气体或液体。为了测定固体的比表面,常用的吸附质有:氮气、水蒸气、苯或环己烷的蒸汽等。吸附剂:能吸附别的物质的物质,吸附剂为固体且常为多孔性固体。常用的吸附剂有:硅胶、分子筛、活性炭等。二、吸附作用和吸附热1、基本概念:652.物理吸附和化学吸附性质物理吸附化学吸附吸附力范德华力化学键力吸热学近于液化热,约几千卡/克分子近于反应热,大于10千卡/克分子选择性无有吸附层单或多分子层单分子层吸附速度快,不需要活化能慢,需活化能可冷子管性可逆不可逆发生吸附的温度低于吸附临界温度远高于吸附质沸点2.物理吸附和化学吸附性质物理吸附化学吸附吸附力范德华力化学66H2在金属镍表面发生物理吸附
这时氢没有解离,两原子核间距等于Ni和H的原子半径加上两者的范德华半径。
放出的能量ea等于物理吸附热Qp,这数值相当于氢气的液化热。
在相互作用的位能曲线上,随着H2分子向Ni表面靠近,相互作用位能下降。到达a点,位能最低,这是物理吸附的稳定状态。
如果氢分子通过a点要进一步靠近Ni表面,由于核间的排斥作用,使位能沿ac线升高。H2在金属镍表面发生物理吸附www.themegallery67H2在金属镍表面发生化学吸附
在相互作用的位能线上,H2分子获得解离能DH-H,解离成H原子,处于c'的位置。
随着H原子向Ni表面靠近,位能不断下降,达到b点,这是化学吸附的稳定状态。
Ni和H之间的距离等于两者的原子半径之和。
能量gb是放出的化学吸附热Qc,这相当于两者之间形成化学键的能。
随着H原子进一步向Ni表面靠近,由于核间斥力,位能沿bc线迅速上升。H2在金属镍表面发生化学吸附在相互作用的位能线上,H68Ni加氢脱氢催化剂原理
H2分子在Ni表面吸附是在物理吸附过程中提供一点活化能,就可以转变成化学吸附。
H2分子从P’到达a点是物理吸附,放出物理吸附热Qp,这时提供活化能Ea,使氢分子到达P点,就解离为氢原子,接下来发生化学吸附。
活化能Ea远小于H2分子的解离能,这就是Ni为什么是一个好的加氢脱氢催化剂的原因。Ni加氢脱氢催化剂原理H2分子在Ni表面吸附是在物理吸附69Ni加氢脱氢催化剂原理
脱氢作用沿化学吸附的逆过程进行,所提供的活化能等于Qc+Ea,使稳定吸附的氢原子越过这个能量达到P点,然后变成H2分子沿PaP’线离开表面。Ni加氢脱氢催化剂原理脱氢作用沿化学吸附的逆过程进行,所70二、吸附作用和吸附热3、吸附热
定义:在吸附过程中的热效应称为吸附热。物理吸附过程的热效应相当于气体凝聚热,很小;化学吸附过程的热效应相当于化学键能,比较大。
取号:吸附是放热过程,但习惯把吸附热都取成正值。固体在等温、等压下吸附气体是一个自发过程,ΔG<0,气体从三维运动变成吸附态的二维运动,熵减少,ΔS<0,ΔH=ΔG+TΔS,ΔH<0。二、吸附作用和吸附热3、吸附热71三、吸附曲线1、基本概念:吸附量通常有两种表示方法:(1)单位质量的吸附剂所吸附气体的体积。(2)单位质量的吸附剂所吸附气体物质的量。吸附曲线:固体吸附气体时,吸附量和温度、压力的关系曲线,即:。三、吸附曲线1、基本概念:722、几种吸附曲线固定一个变量,求出另外两个变量之间的关系,例如:(1)T=常数,Γ
=f(p),得吸附等温线。
2、几种吸附曲线固定一个变量,求出另外两个变量之间的关系,例732、几种吸附曲线(2)p=常数,Γ=f(T),得吸附等压线。2、几种吸附曲线(2)p=常数,Γ=f(T),得吸附742、几种吸附曲线(3)Γ=常数,p=f(T),得吸附等量线。2、几种吸附曲线(3)Γ=常数,p=f(T),得吸753、吸附等温线的类型psvm吸附量第Ⅰ类吸附等温线Langmuir称为单分子吸附类型,即Langmuir型。室温下,氨、氯乙烷等在炭上的吸附及低温下氮在细孔硅胶上的吸附常属于此类型。化学吸附通常为此类等温线。当吸附剂孔半径在1.0~1.5nm以下微孔吸附剂上的吸附等温线属于这种类型。此种等温线在远低于ps的情况下,固体表面已经吸附满了单分子层此时的吸附量为饱和吸附量。Vm—饱和吸附量3、吸附等温线的类型psvm吸附量第Ⅰ类吸附等温线Langm763、吸附等温线的类型第Ⅱ类吸附等温线,称为
S型等温线。是常见的物理吸附等温线。吸附量vmpsB特点是:在低压下首先形成单分子层吸附(相当于B点,此时为饱和吸附),随着压力的增加,逐渐产生多分子层吸附,当压力相当高时,吸附量又急剧上升,表明吸附的气体已经开始凝结为液相。这种吸附剂孔半径相当大(可以近似看成无孔),通常在10nm以上-78℃下,CO2在硅胶上及室温下水蒸气在特粗孔硅胶上的吸附常表现为此类型3、吸附等温线的类型773、吸附等温线的类型第Ⅲ类等温线。这种类型较少见。在低压下等温线为凹的,说明吸附质和吸附剂之间的相互作用很弱。但压力稍增加,吸附量级强烈增大。当压力近于ps时便和Ⅱ型等温线相似,曲线呈现出于纵轴平行的渐近线,表明吸附剂的表面上由多层吸附逐渐转变为吸附质的凝聚。低温下Br在硅胶上的吸附属于此类。ps3、吸附等温线的类型第Ⅲ类等温线。这种类型较少见。在低压下等783、吸附等温线的类型第Ⅳ类等温线。低压下为凸的,表明吸附质和吸附剂有相当强的亲和力,并且也易于确定像在Ⅱ型等温线B点的位置(相当于盖满了单分子层的饱和吸附量)。psB随着压力增加,又由多层吸附逐渐产生毛细管凝结,所以吸附量强烈增大。最后由于毛细孔中均装满吸附质液体,故吸附量不再增加,等温线又趋于平缓。室温下,苯蒸气在氧化铁凝胶上的吸附属于这种类型。3、吸附等温线的类型第Ⅳ类等温线。低压下为凸的,表明吸附质和793、吸附等温线的类型第Ⅴ类等温线。低压下为凹的(和第Ⅲ类等温线低压下相似)。ps随着压力的增加也产生多分子层和毛细管凝结,此种情况和第Ⅳ类等温线高压部分相似。发生多分子层吸附,有毛细凝聚现象。373K时,水蒸汽在活性炭上的吸附属于这种类型。3、吸附等温线的类型第Ⅴ类等温线。低压下为凹的(和第Ⅲ类等温80四、吸附量测定的实验方法
将气体与吸附剂放在一起。达到平衡后,用适当方法测定其吸附量。静态法通常分为重量法和容量法两种。
静态法是经典方法,所得到的数据具有较好的准确度和精密度。但是达到吸附平衡比较慢,仪器装置比较复杂,而且需要高真空系统。为了克服这些困难,可采用动态法来测定吸附量。动态法静态法四、吸附量测定的实验方法将气体与吸附剂放在一起81四、吸附量测定的实验方法重量法测定气体吸附
实验装置如图。将吸附剂放在样品盘3中,吸附质放在样品管4中。首先加热炉子6,并使体系与真空装置相接。到达预定温度和真空度后,保持2小时,脱附完毕,记下石英弹簧2下面某一端点的读数。
根据加样前后该端点读数的变化,可知道加样品后石英弹簧的伸长,从而算出脱附后净样品的质量。四、吸附量测定的实验方法重量法测定气体吸附82四、吸附量测定的实验方法容量法测定气体吸附预先将吸附质气体或蒸汽装在贮气瓶4中,将一定量的吸附剂装入样品管1中,加热、真空脱附,然后放在恒温缸中关上活塞。从贮气瓶4中放出一定量气体,用压力计读出压力;再打开样品管活塞,达吸附平衡后再读取压力。从压差的变化,用气体状态方程可计算吸附量。用量气管中水银液面的升降,调节系统中的压力和体积,可得到不同压力下的吸附量,从而可绘出吸附等温线。四、吸附量测定的实验方法容量法测定气体吸附83四、吸附量测定的实验方法动态法吸附实验用气相色谱动态法研究气体或蒸汽的吸附,既快速又准确。实验装置如示意图所示。将活化好的吸附剂装在吸附柱6中,将作为载气的惰性气体N2或He与适量的吸附质蒸汽混合通过吸附柱。分析吸附后出口气的成分或分析用惰性气体洗下的被吸附气体的成分,从自动记录仪或与之联结的微处理机处理的结果,就可以得到吸附量与压力的关系、吸附等温线、比表面、孔分布等有用信息。四、吸附量测定的实验方法动态法吸附实验84第二节吸附等温式东北石油大学石油工程学院第二节吸附等温式东北石油大学石油工程学院85吸附等温式一、Freundlich吸附等温式二、
Langmuir吸附等温式—单分子层吸附理论三、BET吸附等温式——多分子层吸附理论吸附等温式一、Freundlich吸附等温式86一、Freundlich吸附等温式Freundlich吸附等温式有两种表示形式:V:吸附体积,ml;
p:体系压力,Pa;K、n为常数
K~温度、吸附剂种类
n~吸附体系,决定了吸附等温线形状Freundlich吸附公式对θ的适用范围比Langmuir公式要宽。一、Freundlich吸附等温式Freundlich吸附等87二、
Langmuir吸附等温式—单分子层吸附理论固体表面设总共有Vm个位置,已经占据V个位置二、Langmuir吸附等温式—单分子层吸附理论固体表面设88二、
Langmuir吸附等温式—单分子层吸附理论θ称为覆盖度。
当μ代表单位时间内碰撞在单位表面上的分子数,a代表碰撞分子中被吸附的分数,则吸附速度为μa(1-θ)。则根据假设(1)、(2),单位时间、单位表面上解吸的分子数只与被覆盖的分数θ成正比。所以解吸为γθ。γ是解吸速度的比例常数,当θ=1,γ等于解吸速度,因此二、Langmuir吸附等温式—单分子层吸附理论θ称为覆盖89二、
Langmuir吸附等温式—单分子层吸附理论带入上式得式中Langmuir式也可写成由分子运动论得又由联立两式二、Langmuir吸附等温式—单分子层吸附理论带入上式得90二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附等温式的意义bpbpn
bpbp二、Langmuir吸附等温式—单分子层吸附理论www.t91二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附方程还可以写成如下形式
如果用p/v对p作图是一条直线,说明Langmuir吸附方程可以由直线的斜率和截矩求得Vm和b值,由Vm值可以进一步计算吸附剂比表面So,其计算方程式为
式中,NA是阿伏加德罗常数,按原假定Ao是固体表面一个吸附位置的面积,后来逐渐用吸附分子的截面积所代替。二、Langmuir吸附等温式—单分子层吸附理论www.t92二、
Langmuir吸附等温式—单分子层吸附理论Langmuir吸附等温式的缺点:
1.假设吸附是单分子层的,与事实不符。
2.假设表面是均匀的,其实大部分表面是不均匀的。
3.在覆盖度θ
较大时,Langmuir吸附等温式不适用。
一般说,多数的物理的吸附是多分子层。所以在压力比较大时,就不遵循Langmuir吸附式。但绝大多数的化学吸附是单分子层的。如果覆盖度较小、吸附热变化不大时,实验结果能比较好地与Langmuir吸附式相符。二、Langmuir吸附等温式—单分子层吸附理论Langm93二、
Langmuir吸附等温式—单分子层吸附理论混合吸附
如果气相中含有A、B两种气体,它们都能在固体表面上形成单分子层吸附。这种混合吸附的情况在多相催化中是经常遇到的。在分压pA、pB下,固体表面上的覆盖度也不一样。分别以θA、θB表示。当吸附到达平衡时,A、B两种气体各自的吸附与解吸速度相等,所以或二、Langmuir吸附等温式—单分子层吸附理论混合吸附94二、
Langmuir吸附等温式—单分子层吸附理论联立解以上两式,可以得到A、B两种气体混合吸附的Langmuir等温方程式
从以上两式可以看到,两种气体混合时,将互相抑制。当一种气体吸附很强时,另一种气体的吸附基本上可略而不计,因为1+bApA>>bBpB。二、Langmuir吸附等温式—单分子层吸附理论联立解以上95二、
Langmuir吸附等温式—单分子层吸附理论解离吸附达到吸附平衡时:则Langmuir吸附等温式可以表示为:对于一个吸附质分子吸附时解离成两个粒子的吸附二、Langmuir吸附等温式—单分子层吸附理论解离吸附达96例题例题:在0℃时,CO在2.964g木炭上吸附的平衡压力p与吸附气体标准状态体积V如下:(1)试用图解法求朗格缪尔公式中常数Vm和b;(2)求CO压力为5.33×104Pa时,1g木炭吸附的CO标准状况体积。解:朗格缪尔等温式为将题给数据整理后列表如下:例题例题:在0℃时,CO在2.964g木炭上吸附的平衡97例题(1)以p/V对p作图(图略),得一直线,其斜率为:截距为:(2)由图上查出,当例题(1)以p/V对p作图(图略),得一直线,其斜98三、BET吸附等温式—多分子层吸附理论
由Brunauer-Emmett-Teller三人提出的多分子层吸附公式简称BET公式。
他们接受了Langmuir理论中关于固体表面是均匀的观点,但他们认为吸附是多分子层的。当然第一层吸附与第二层吸附不同,因为相互作用的对象不同,因而吸附热也不同。在这个基础上他们导出了BET吸附二常数公式。三、BET吸附等温式—多分子层吸附理论由Brunau99BET吸附等温式
式中两个常数为c和Vm,c是与吸附热有关的常数,Vm为铺满单分子层所需气体的体积。p和V分别为吸附时的压力和体积,p0是实验温度下吸附质的饱和蒸汽压。BET吸附等温式式中两个常数为c和Vm,c是与100BET吸附等温式为了使用方便,将二常数公式改写为:S0是吸附质分子的截面积,要换算到标准状态(STP)。式中用实验数据 对 作图,得一条直线。从直线的斜率和截距可计算两个常数值c和Vm,从Vm(单位ml/g)可以计算吸附剂的比表面:BET吸附等温式为了使用方便,将二常数公式改写为:S0是吸附101
如果吸附层不是无限的,而是有一定的限制,例如在吸附剂孔道内,至多只能吸附n层,则BET公式修正为三常数公式:若n=1,为单分子层吸附,上式可以简化为Langmuir公式。若n=∞,(p/p0)∞→0,上式可转化为二常数公式。三常数公式一般适用于比压在0.35~0.60之间的吸附。如果吸附层不是无限102例题例题:1.876g某催化剂在不同压力下吸附丁烷,所得吸附数据如下:
p/kPa:7.9111.9316.6920.8823.9024.99
V/ml:17.0920.6223.7426.0927.7728.03已知:0℃丁烷饱和蒸汽压为103.24kPa,正丁烷分子截面积为0.446nm2试计算催化剂的比表面积。解:由表可得以下数据:
0.0730.1160.1620.2020.2320.242
4.616.368.149.710.88
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 古代文学史的后期发展试题及答案
- 宠物营养的创新研究与应用试题及答案
- 二手车评估中遇到的问题试题及答案
- 宠物营养师考试膳食处方设计试题及答案
- 财务管理实务操作模拟试题及答案
- 让图画五彩缤纷(教学设计)2024-2025学年三年级下册信息技术川教版
- 宠物饮食行为调查问卷试题及答案
- 六年级语文个性化辅导试题及答案
- 六年级上册心理健康教育教案-9 宽容胜似金|辽大版
- 2024年计算机基础考试难点分析与试题及答案
- 企业劳动关系课件
- 固定资产管理制度实施细则
- 2025年辽宁省沈阳市和平区中考零模地理试题(含答案)
- 体育教育与学生的心理健康
- T-SDFA 048-2024 混合型饲料添加剂中二硝托胺的测定 液相色谱-串联质谱法
- 2024-2025学年上海市八年级语文下学期3月练习试卷附答案解析
- 2024年大模型+RAG最佳实践报告
- 2025年互联网信息审核员考试题库及答案
- 沪教版(五四学制)(2024)六年级数学下册 第五章 比和比列 单元测试题(含解析)
- DB14-T 3227-2025 暂不开发利用污染地块风险管控指南
- 2025年山东天成水利建设有限公司招聘笔试参考题库含答案解析

评论
0/150
提交评论