



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第二章 燃气燃烧反应动力学Kinetics of Combustion第一节 化学反应速度第二节 链反应第三节 燃气的着火第四节 燃气的点火第一节 化学反应速度(Reaction RateRR)燃气燃烧化学反应;遵守化学动力学的基本规律。化学反应速度:单位时间内反应物(或产物)的浓度变化率。scmmolddCW3质量作用定律:对基元反应(Elementary Reaction) aA+bBgG+hH其反应速度为bBaACkCW a/b对组分A/B的反应级数;n=a+b总反应级数反应速度常数RTETkknexp0k0Pre-exponential factor;EActivation Energ
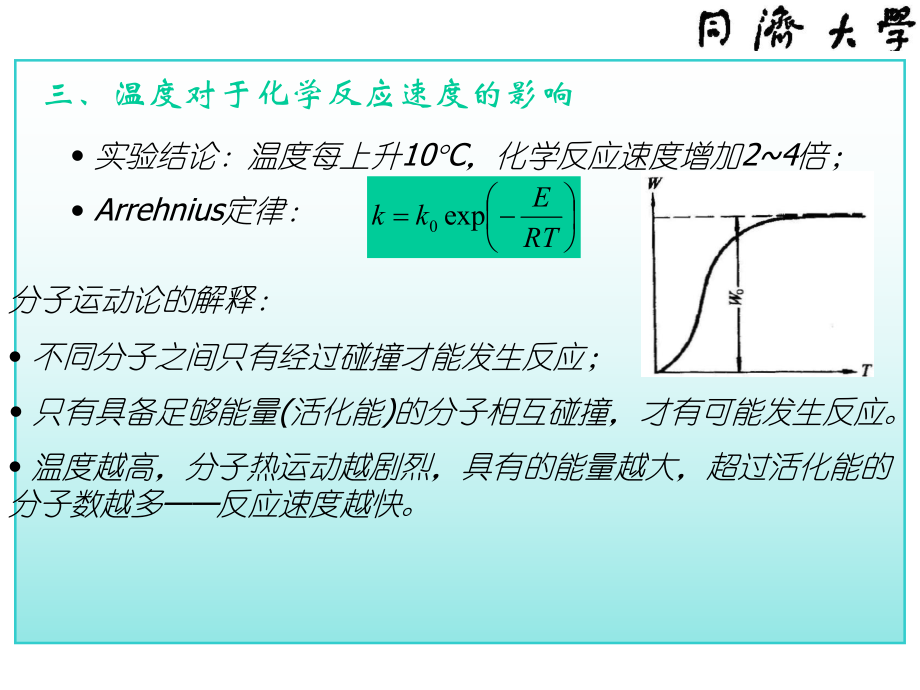
2、y;一、浓度对化学反应速度的影响二、压力对化学反应速度的影响 对不同级数的化学反应,压力的影响是不同的。 对一级反应,化学反应速度与压力成正比; 对二级反应,化学反应速度与压力的平方成正比; 在专业涉及的范围内,一般不考虑压力对反应速度的影响。nppWW2121在燃气轮机燃烧、内燃机燃烧等领域内,必须考虑压力对化学反应速度的作用。三、温度对于化学反应速度的影响 实验结论:温度每上升10C,化学反应速度增加24倍; Arrehnius定律:分子运动论的解释: 不同分子之间只有经过碰撞才能发生反应; 只有具备足够能量(活化能)的分子相互碰撞,才有可能发生反应。 温度越高,分子热运动越剧烈,具有的能
3、量越大,超过活化能的分子数越多反应速度越快。RTEkkexp0活化能的测算在温度T1下,测量化学反应速度W1在温度T2下,测量化学反应速度W2101expRTEWW202expRTEWW二者相除,有212111expTTREWW212121lnWWTTTRTE得到一般化学发应的活化能为(440)104J/mol; 有自由原子参与的反应,活化能很小;第二节 链反应 Chain Reaction化学反应计量方程式反应前后的物质平衡关系;许多反应无法用古典化学反应动力学理论解释 某些燃烧反应在反应物浓度下降时,反应速度却不断增大; 某些反应在低温下速度很快;这些反应不是由反应物一步获得产物,而是通过
4、链反应进行的。反应过程包含了活化中心的生成和销毁;一旦引发,就会相继发生一系列基元反应自动发展,直到消耗完毕。链反应:Chain Reaction一个基本概念活化中心具有较高能量的不稳定分子,在碰撞过程中形成自由原子,O/H/OH;这些自由原子只需很小的活化能就能进行反应,它们称做“活化中心”。H2的链反应H2+O22OHH2+M H+H+MO2+O2 O3+O1 链引发、链起始Chain Initialization产生活化中心;所需的活化能是最大的;H+O2 O+OH E=58000kJ/kmolO+H2 H+OH E=20000kJ/kmolOH+H2 H2O+H E=33000kJ/k
5、mol2 链传递一个活化中心消失,生成一个或多个活化中心。H+O2O+H2OH+H2HOH+H2HH2OHH2O看其中的一个链环看其中的一个链环综合起来,H+O2+3H2 3H+2H2O一个H原子在链环结束时,生成了三个H直链反应:一个活化中心的销毁只产生一个活化中心。支链反应:一个活化中心的销毁产生两个或更多的活化中心2H+MH2+MH+OH+M H2O+M3 链终止:活化中心在气相或在器壁上销毁;(活化中心互相碰撞,能量被带走)链反应的三步链引发、链传递、链终止过程时同时存在的。在相同中不断产生新的活化中心,同时又不断的销毁。CO的链反应干燥的CO与O2/空气的混合物,加热到700oC,不
6、反应;但极少量的水,会快速催化其氧化过程。存在O/OH/H等活化中心。1. H2O+CO CO2+H22. H2+O2 H2O23. H2O2+M 2OH+M4. H2O2+CO CO2+H2O5. OH+CO CO2+H6. H+O2 OH+O7. H+O2+M HO2+M8. O+H2 OH+H9. O+O2+M O3+M10.HO2+CO CO2+OH11.HO2 销毁包含所有H2/O2的链反应;反应5、10对CO2生成作用最大。CH4的链反应机理 目前尚处于研究阶段;过程本身非常复杂;在低温下CH4+O2CH3+HO2CH3+O2 CH2O+OHOH+CH4 H2O+CH3OH+CH2
7、O H2O+HCOCH2O+O2 HO2+HCOHCO+O2 CO+HO2HO2+CH4 H2O2+CH3HO2+CH2O H2O2+HCO链终止:OH 器壁CH2O 器壁Serry-Bowmann的理论CH4+M CH3+H+MCH4+O CH3+OHCH4+H CH3+H2CH4+OH CH3+H2OCH3+O HCHO+OHCH3+O2 HCHO+OHHCO+OH CO+H2OHCHO+OH H+CO+H2OCO+OH CO2+HH+O2 OH+OO+H2 H+OHO+H2O 2OHH+H2O H2+OHH+OH+M H2O+MCH3+O2 HCO+H2OHCO+M H+CO+MCH4C
8、H3 HCHO HCO CO CO2第三节 燃气的着火(Ignition)任何可燃气体与O2接触,都会发生氧化反应;可以是稳定的氧化反应,或者是不稳定的氧化反应。由稳定的氧化反应转变为不稳定的氧化反应,从而导致燃烧的瞬间着火。着火是由于活化中心产生的速度大于其销毁的速度迅速增加、反应加速支链着火。 着火是由于系统中热量的聚集、温度急剧升高、反应加速,反应由稳定的氧化反应转变为不稳定的氧化反应热力着火。磷在大气中闪光;醚/酒精等在常压、低温下会发出微弱火光;H2+O2混合物在低压、低温下着火。一、支链着火支链着火与温度、压力的关系很复杂;在一定的条件下,能够自动加速、导致自燃;H2+O2的爆炸极
9、限图压力高反应物浓度增大 活化分子与其他分子碰撞几率增大气相销毁导致链反应中断压力低反应物浓度低活化中心数量本身不多器壁销毁导致链反应中断下限:与混合物组成和容器形状有关;与温度关系不大。上限:与温度有关,温度高,压力高;与容器形状无关;对惰性杂质敏感;将不同温度下得到的爆炸压力下限/上限绘制成图,得到“着火半岛”分析支链着火条件何种情况下活化中心的产生速度销毁速度?假设:反应过程中热量被不断地引出,以保证反映在等温下进行。影响活化中心浓度变化的因素有:(1) 活化分子产生活化中心的速度W0(2) 支链反应使活化中心增加的速度fCa(3) 活化中心销毁的速度gCaaaaaaCWCgfWgCfC
10、WddC000起始条件为:=0,Ca=010eWCa链反应的速度=产物形成的速度10eWfCfWa每一活化中心所能形成的产物的分子数。三种可能性(1)fg, 010eWfWW与呈指数关系自动加速到不稳定状态支链着火(2) f=g, =00fWWW与呈线性关系;反应处于极限状态。(3)fg, g活化中心增加的速度大于其销毁的速度。二、热力着火How? 系统中反应产生的热量散热,温度升高反应速度 产生热量 温度 热力着火不仅与燃气的物理化学性质(化学反应速度、热效应)有关,也与系统的热力条件(散热情况)有关。1 热力着火过程分析假设:(1)反应再密闭容器内进行,其中的温度T/压力p/浓度都是均匀的
11、;(2)容器壁面温度为T0;(3)反应物浓度为CA/CB假设在着火前浓度未明显减少。单位时间内化学反应所产生的热量为VHWQ1sRTECCkWbBaA.mkmol exp30化学反应速度W为H反应的热效应(kJ/kmol);RTEAHVRTECCkQbBaAexpexp01单位时间内系统所散失的热量为002TTBTTFQL产热曲线;M散热曲线;固定L,改变M二者的相对位置有三种可能的情况第一种情况二者相割,两个交点交点1,温度较低;若系统温度升高,散热大于产热,回到1点;若系统温度降低,产热大于散热,温度重又升高到1点。点1是稳定的平衡状态缓慢氧化,熄火状态。交点2,温度较高;若系统温度升高,
12、产热会进一步大于产热,离开2点,温度进一步升高;若系统温度降低,散热会小于产热,温度进一步下降,离开2点。点2是不稳定的平衡状态第二种情况二者相切,一个交点T0=T0i; Q1=Q2;点i是稳定状态的极限;系统温度稍有增高,反应会加速进行,温度进一步升高由缓慢的稳定反应转变为不稳定的剧烈燃烧。Ti着火温度;第三种情况二者永无交点Q1Q2;产热永远大于散热,不可能出现稳定状态;加热、改变T0的方法;升高压力的方法;保持散热条件不变;同样会产生三种情况压力升高2、着火温度的影响因素热力着火的条件是Q1Q2;着火温度是系统稳定状态的极限位置;着火温度与系统的散热条件有关;(1)热力条件 散热条件散热
13、系数散热系数增大着火温度升高(2)燃气性质燃气性质不同时,Ti不同;Ea小的燃气、活性大,着火温度低;(3)燃气组分H2Ti随浓度增大而提高;COTi在20浓度处最低;CmHn各有不同变化;CH4C2H6C3H8C4H103 求着火温度求L/M曲线的切点dTdQdTdQQQ2121BRTRTEAETTBRTEA20expexp20002411TERTERERTTTi得到20TERT 一般地,若T0=700K,E=(12.525)104kJ/kmol331620TERT 着火温度与T0很接近;着火现象只有在容器表面温度在一定范围内才可能发生!第四节 燃气的点火(Forced Ignition)燃
14、烧反应在系统中同时进行;均相加热、自发点火、自燃; Homogeneous Ignition; Spontaneous Ignition在研究化学反应动力学范畴内很有用,与内燃机爆燃现象有关;燃气工程中一般不用这种方法引燃。利用外部热源火花、电热丝、小火焰来点火;在可燃混合物种首先确立一个小火焰,提高热传导和活性组分的扩散,向冷的未燃组分传播。强制点火; Forced Ignition;点火成功与否取决于火焰的传播条件和可燃混合物的性质。着火点火一、原理概述a在不可燃介质中;b在可燃介质中;点火成功时,小部分热流流向颗粒;大部分热流流向未燃气体,着火、燃烧。点火过程分析:当颗粒温度高于一定值,
15、发生化学反应、温度Tf升高到大于颗粒温度的水平;TfTw; 且Tf逐步离开颗粒,形成火焰进行传播;这个过程中还伴随着气体浓度的变化近着火点处的可燃物浓度下降、产物浓度升高导致相互扩散;点火成功时,在颗粒表面形成一薄的火焰层。火焰层的厚度燃烧放热量火焰层向外传导的热量AWHQf2ffTTAQ01HWTTff021QQ 火焰厚度与导热系数、火焰温度、热值、反应速度等因素有关。二、热球或热棒点火将石英球/铂球投入可燃混合物,当温度高于某一临界温度,就发生点火现象;临界温度球体尺寸、催化特性、射入速度、可燃混合物特性等因素。球体半径r; 球体温度Tw;绕流附面层厚度;发生化学反应区域的体积:散热面积为
16、:24 r24 r产热散热(主要为导热)02244TTrHWrwHWTTw0Tw=Tis时,满足HWTTis0由流体力学:绕流的Re/Pr越大,附面层越薄,温度梯度越大,越难点燃。由传热学000TTdrdTTTwrwNusselt准则数为rdNu2消掉0224TTHWrNuisi或者2204NuHWrTTiis热球或热棒的直径越小、相对气流速度越高,临界点火温度越高!1Tis=f(d)2/3Tis=f(w)三、小火焰点火点燃的可能性取决于:可燃混合物组成;点火火焰与混合物的接触时间;火焰的尺寸和温度;混合强烈程度;扁平火焰温度场随时间的变化第一种情况:温度场不断衰减;火焰熄灭;第二种情况:燃烧
17、放热可以扭转温度场的衰减;火焰传播;实验表明:扁平点火火焰的临界厚度是火焰可以稳定传播时焰面厚度的两倍。HWTTff0分析:点燃导热系数大的可燃混合物,必须用厚度大的火焰;温度要高。压力上升时,临界厚度下降。平均析热率高,厚度要小。四、电火花点火(Spark Ignition)概述高压电极放电,产生电火花;局部气体温度急剧上升;气体分子发生离子化,改变了火花区内的化学反应进程;电火花加热局部着火初始火焰中心向未燃混合物传播实际上有几个相互作用的过程。初始火焰中心形成点火成功。电容放电:快速释放电容器内储存的能量感应放电:断开变压器/点火线圈的电路时所产生的。2122212121CUUUCE1
18、最小点火能与熄火距离待点燃的可燃混合物的浓度/温度/压力一定时,只有当放电能量大于某最小值,才能形成初始火焰中心这个最小的必要的放电能量叫“最小点火能”Emin初始火焰中心形成后,温度升高,向未燃气体传导热量;火球太小,则反应析热不足,热损失超过热传导量,反应逐渐中断。最小点火能Emin是建立临界最小尺寸火焰的能量。Emin与电极间距有关;与可燃混合物的组成有关;点火能与电极间距的关系电极从初始火焰中心吸收过多热量,维持火焰传播的能量要求提高。熄火距离影响最小点火能Emin的因素(1) 可燃混合物组成、种类;Emin大,范围窄Emin小,范围宽不同种燃气取决于自身的性质;同种燃气在化学计量比处最小;(2)与熄火距离dq有关最小点火能与熄火距离的关系2min0017. 0qdE2min1pE(3) Emin与压力有关压力增加,最小点火能和熄火距离都降低!2 静止混合气中的最小点火能如何得到Emin?假设: 加热区域为球形;电极间距足够大忽略电极对球形气团的熄火作用;点燃过程完全是由于热的作用;燃烧反应为二级反应;点火成功时,火焰厚度内形成从TmT0的稳定分
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 安全教育课件
- 安全教育培训课件前言
- DB21T 4202-2025行政事业单位国有资产确认与初始计量规范
- DB65T 5001-2025复播大豆免耕精播滴灌种植技术规程(兵团)
- 2026年企业数据挖掘部工作计划
- 2026“才聚齐鲁成就未来”山东泰山财产保险股份有限公司社会招聘3人备考题库附答案详解(巩固)
- 2026上半年贵州事业单位联考贵州传媒职业学院招聘12人备考题库附答案详解(能力提升)
- 新版《生产安全法》考试题库及答案
- 2026广东佛山市季华实验室X研究部博士后招聘1人备考题库含答案详解(基础题)
- 2026云南昆明官渡区上海师范大学附属官渡实验学校(中学)招聘1人备考题库附参考答案详解(预热题)
- 2026 年离婚协议书 2026 版民政局专用模板
- 施工计划方案的设计要点及注意事项
- 2026年烟台工程职业技术学院单招综合素质考试参考题库附答案详解
- 全球牙膏行业现状分析报告
- IT项目管理-项目管理计划
- GB/T 7714-2025信息与文献参考文献著录规则
- 2025年标准建筑混凝土浇筑合同范本
- GB/T 4498.1-2025橡胶灰分的测定第1部分:马弗炉法
- 《智能建造数字技术基础》课件全套 第1-12章 绪论-演示性试验
- 危险废物管理台账(样表)
- 应急管理科普知识宣传活动方案

评论
0/150
提交评论