



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
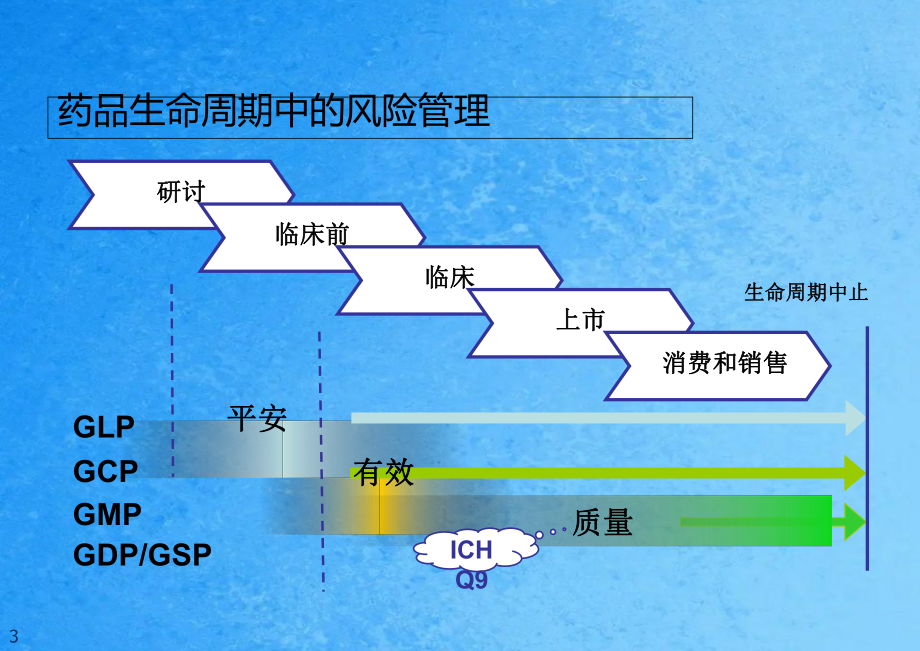
1、质量风险管理 (QRM)定义:在整个产品生命周期中就药品的质量风险进展评价、控制、沟通和审核的系统过程。与质量体系相结合,是一项指点科学性和实际性决策用以维护产质量量的过程。 药品GMP2019年修订第二章 质量管理 第四节 质量风险管理第十三条 质量风险管理是在整个产品生命周期中采用前瞻或回想的方式,对质量风险进展评价、控制、沟通、审核的系统过程。 第十四条 该当根据科学知识及阅历对质量风险进展评价,以保证产质量量。 第十五条 质量风险管理过程所采用的方法、措施、方式及构成的文件该当与存在风险的级别相顺应。质量风险管理 (QRM)3药品生命周期中的风险管理研讨研讨临床前临床前 临床临床 上市
2、上市质量质量ICH Q9平安平安有效有效 消费和销售消费和销售GLPGCPGMPGDP/GSP生命周期中止生命周期中止危害定义: 对安康呵斥的损害,包括由产质量量平安性、有效性、质量损失或可用性问题所导致的危害。风险定义:风险是危害发生的能够性及危害的严重性的集合体。能够性:危害的能够性/频率。 严重性:危害的后果的严重程度。能够性能够性高高中中低低风险风险严重性严重性风险风险=能够性能够性 x 严重性严重性阶段阶段 1: 风险要素风险要素阶段 2: 风险及可测性的相关性High riskLow detectabilityLow riskHigh detectability风险风险= 能够性能
3、够性 X 严重性严重性R=P X S低可测性低可测性高风险高风险高可测性高可测性低风险低风险能够性、严重性、可测性 (PSD) 质量风险管理程序质量风险管理程序启动质量风险管理程序启动质量风险管理程序风险评价风险评价风险控制风险控制质量风险管理程序的输出质量风险管理程序的输出/结果结果风险回想风险回想风险管理工具风险管理工具风险确认风险确认风险分析风险分析风险评价风险评价风险降低风险降低风险接受风险接受风险事件风险事件不可接受不可接受风险沟通风险沟通风险评价-定义进展质量风险管理过程中,对用于支持风险决策的信息进展组织的过程:包含危害确实认、以及这些危害相关风险的分析和评价。风险评价风险评价风
4、险确认风险确认风险分析风险分析风险评价风险评价 预估已确认危害的预估已确认危害的风险风险 系统的利用信系统的利用信息确认潜在的息确认潜在的危害来源危害来源 用定量或定性的方法,比较用定量或定性的方法,比较估计的风险与知的风险规范估计的风险与知的风险规范,以确定风险的级别。,以确定风险的级别。风险评价风险评价风险控制风险控制风险降低风险降低风险接受风险接受 为降低危害发生的能够性为降低危害发生的能够性和严重性所采取的措施和严重性所采取的措施接受风险的决议接受风险的决议风险控制:执行风险风险控制:执行风险管理决议的措施管理决议的措施风险控制风险控制风险沟通风险沟通质量风险管理程序质量风险管理程序
5、决策者与其他相关方在风险和风险管理决策者与其他相关方在风险和风险管理方面信息的共享。相关各方可在风险管方面信息的共享。相关各方可在风险管理程序的恣意阶段进展交流。理程序的恣意阶段进展交流。风险沟通风险沟通风险回想风险回想风险事件风险事件 回想并监控风险管理程序的输回想并监控风险管理程序的输出出/结果。总结关于风险的新的结果。总结关于风险的新的认知及阅历。认知及阅历。风险回想风险回想l 根本的风险管理促进方法流程图、根本的风险管理促进方法流程图、 检查表、检查表、 过程映过程映射、因果图、射、因果图、 鱼骨图鱼骨图l 缺点方式与影响分析缺点方式与影响分析 (FMEA)l 缺点方式、影响及严重性分
6、析缺点方式、影响及严重性分析(FMECA)l 缺点树分析缺点树分析 (FTA)l 危害分析及关键控制点危害分析及关键控制点 (HACCP)l 危害可操作性分析危害可操作性分析 (HAZOP)l 初步危害分析初步危害分析 (PHA)l 风险分级和过滤风险分级和过滤l 其他统计支持工具其他统计支持工具风险管理工具风险管理工具风险管理工具风险管理工具16质量风险管理工具:过程图配料配料终混终混 沸螣沸螣 床枯燥器床枯燥器包衣包衣压片压片包装包装 整粒整粒混合混合 过筛过筛 过筛过筛Air空气空气Scale17 片剂硬度因果关片剂硬度因果关系图系图片子片子 硬度硬度枯燥枯燥磨粉磨粉制粒制粒起始起始物料
7、物料压片压片包衣包衣设备设备要素要素操作者r温度/湿度重新压片 主压片进料速度压片速度 冲填深度n喷雾速度锅速度喷枪间隔温度 雾化压力重新枯燥温度磨粉时间温度相对湿度气流振荡周期过筛速度筛规格口径原料P.S.工艺条件LODHPMCMethoxylHydroxylP.S.枯燥失重其它Syloid乳糖包衣水黏合温度喷雾速度雾化方式压力出料切断速度混合速度终点动力时间效期工具操作者培训分析分析方法 取样其它料斗e质量风险管理工具:因果关系图鱼骨图质量风险管理工具:因果关系图鱼骨图定性风险优先等级定量分级RPN风险优先数量等级断定危害 :无法确保无菌操作用数值范围表示高,中,低等级的风险RPN范围范围
8、危害性: 最高10分 = 事件导致无法确保无菌操作因此其结果有能够有对病人呵斥直接严重的影响 发生的能够性: 在A级环境中给胶塞填料桶中添加胶塞 频繁 = 每小时大于1次 8 -10 较小的频率= 每小时少于1次 4 -7 不频繁= 每班少于一次 1 -3可发现性: 对于微粒物质进展频繁检测将有利于提高可测性并降低风险 对关键区域进展歇的人工检测 8 -10 对关键区域间歇的运用探头自动检测 4 -7 对关键区域运用延续不断的专门探头自动检测 1 -3RPN:风险优先数量等级断定RPN:风险优先数量等级断定 RPN :计算这条分装线的每个操作危害: 能够无法确保无菌操作RPN范围范围风险评价
9、确定问题: 预备一个简单的工艺描画和工艺流程图,时常更新任何时候进展评价时所得的数据 风险鉴定: 对于每个操作单元各组确定有能够呵斥非无菌操作或环境的潜在缘由,操作失败的严重等级一直为高。风险分析: 严重性, 发生的能够性和可测性分配不同的值,对于事件缘由和工艺程序失败的事件进展风险评价 (SEV, OCC, DEV 每栏分别用绿色,黄色和红色表示这样从视觉上可以协助一目了然)l 三个风险等级用于评价断定总体三个风险等级用于评价断定总体RPR, 并输入并输入 RPR 一栏中,一栏中, 并决议能否接受风险并决议能否接受风险 (不包含降不包含降低风险低风险) 填写在填写在 risk accepte
10、d 一栏中一栏中风险评价模型基于. l 危害性危害性l 发生的能够性发生的能够性l 可发现性可发现性l 风险优先等级风险优先等级 目的 : 由于预期到监管要求将有更改 (EU GMP 修订版附件1 2019,在A级环境中进展西林瓶扎盖,2019年3月强迫执行。EU GMP revised Annex 1 2019, capping vials in Grade A, in force March 2019) 对在非A级环境中对冻干后的西林瓶进展扎盖的操作的潜在风险进展评价。l按照工艺步骤进展风险评价工艺流程图无菌灌装无菌灌装 & 胶塞压半塞胶塞压半塞 (A级级)西林瓶装载到托盘中西林瓶
11、装载到托盘中 (A级级)冻干冻干胶塞清洗硅化,灭菌胶塞清洗硅化,灭菌西林瓶清洗,灭菌西林瓶清洗,灭菌胶塞,西林瓶和铝盖的接纳胶塞,西林瓶和铝盖的接纳来料质量单元来料质量单元铝盖存放和处置铝盖存放和处置 (非非 A级级)翻开冻干机翻开冻干机托盘转运托盘转运轧盖轧盖100% 目检目检终了终了工艺描画(1) 冻干机走漏率经过验证;在冻干开场前和终了时都充入无菌过滤空气;进展最终压塞时还能坚持细微的真空; 手工把压塞后的西林瓶托盘卸下并在非A级的环境下转移到扎盖区; 在轧盖的进口没有探测胶塞位置的安装; 轧盖机能够存在损坏瓶子的问题,假设胶塞上涂抹的硅油过多那么在轧盖的过程中会出现胶塞挤出和重新安装的
12、情况。工艺描画(2)轧盖或未轧盖的压过塞的瓶子,可以证明容器密封的完好性是令人称心的 对于容器密封完好性有铝盖或没有铝盖中的西林瓶和胶塞的尺寸规范范围是经过验证的并在物料接纳时进展过确认 培育基灌装验证,包括了压塞与轧盖间继续的过程 西林瓶加塞和轧盖后要100% 进展物理外观检查确定高风险和会对风险呵斥影响的系统 运用PSD (能够性,危害性,可发现性概念确定在检查中须关注的高风险方面 确定将会对高风险过程产生影响的一切系统 确定需求被检查的关键系统 确定关键系统内的高风险步骤主要目的主要目的次要目的次要目的次要目的次要目的以主要目的和次要目的为根底进展检查主要目的和次要目的 主要目的检查着重
13、关注于在制定检查方案阶段中所确定的高风险区域 如:无菌检测及围绕它的相关系统 次要目的检查着重关注于首要关注目的外的非关键区 如:记录没有同步填写 设备仪器的灭菌信息没有填写进检测记录中等高风险高风险严重缺陷严重缺陷主要缺陷主要缺陷 中低风险中低风险主要缺陷主要缺陷普通缺陷普通缺陷主要目的主要目的次要目的次要目的基于质量风险管理的检查基于质量风险管理的检查例例: 主要缺陷主要缺陷 注射用水微生物监测结注射用水微生物监测结果反复不合格果反复不合格例例: 严重缺陷严重缺陷未进展有效调查对以此未进展有效调查对以此注射用水为原资料的产注射用水为原资料的产品进展了放行品进展了放行例例: 普通缺陷普通缺陷
14、注射用水微生物监测一次结果不注射用水微生物监测一次结果不合格且未进展有效调查,但其后合格且未进展有效调查,但其后的监测结果不断合格的监测结果不断合格例例: 主要缺陷主要缺陷趋势分析显示注射用水微生物监趋势分析显示注射用水微生物监测结果反复不合格,经检查员调测结果反复不合格,经检查员调查显示存在管道死角问题查显示存在管道死角问题主要目的主要目的次要目的次要目的基于质量风险管理的检查基于质量风险管理的检查关键缺陷关键缺陷伪造批记录伪造批记录伪造注射用水监测结果,如:伪造注射用水监测结果,如:注射用水的趋势分析注射用水的趋势分析 普通缺陷普通缺陷例例:在注射用水微生物监测取样记在注射用水微生物监测取
15、样记录中有一次涂改或誊写、誊写的情录中有一次涂改或誊写、誊写的情况况主要缺陷主要缺陷企业经常出现类似的誊写、誊写情企业经常出现类似的誊写、誊写情况,无相关的况,无相关的SOP,内审未指出该,内审未指出该类问题,且最终类问题,且最终QA接受此类行为接受此类行为主要目的主要目的次要目的次要目的基于质量风险管理的检查基于质量风险管理的检查系统的定义:一组功能相关的元素相互影响,相互关联,相互依赖所构成的一个复杂整体。功能例:无菌分装的一些相关系统和风险分级例:无菌分装的一些相关系统和风险分级无菌分装无菌分装干净室消毒干净室消毒QC 培训培训 HVAC 趋势分析趋势分析EMPWFI验证验证HHHHHH
16、HLX例:确定无菌分装的子系统例:确定无菌分装的子系统子系统子系统系统系统 消毒剂验证X无菌分装QC 培训培训 HVAC 趋势分析趋势分析EMPWFIHHHHHHHL干净室消毒干净室消毒验证验证确定子系统 系统举例: 干净室的消毒 消毒剂的验证和挑战实验 消毒剂的相容性 轮换运用消毒剂 消毒剂配制的SOPs 消毒剂高压灭菌 消毒剂运用频率 消毒剂的记录 消毒程序的培训 消毒剂供应商的评价 监测环境监测举例:干净级别房间的消毒子系统风险等级评定子系统风险等级评定运用质量风险管理的理念进展检查预备风险风险PS-DHVAC分装工艺分装工艺WFIQCQA系统系统子系统子系统元素元素l高高 中中 低低l
17、高高 中中 低低l高高 中中 低低l高高 中中 低低l高高 中中 低低 无菌分装系统无菌分装系统对子系统的元素进展分级检查时应关注质量体系的有效性从以下方面入手开展检查趋势分析变卦控制偏向调查验证和确认对工艺参数、对工艺参数、分析结果等分析结果等的汇总分析的汇总分析 产质量量方面的总结产质量量方面的总结年度产品年度产品回想分析回想分析趋势分析的定义环境、水环境、水监测结果监测结果原辅料的原辅料的质量趋势质量趋势关键工艺关键工艺参数汇总参数汇总应运趋势分析的概念趋势分析趋势分析趋势分析图表 平均值平均值纠偏限纠偏限纠偏限纠偏限 警戒限警戒限警戒限警戒限+ 2- 2+ 3- 3数值范围数值范围规范
18、规范规范规范不用采取行动不用采取行动调查并确定出根本缘由调查并确定出根本缘由带有问题嫌疑的产品带有问题嫌疑的产品 不合格产品不合格产品趋势分析中的限制 内控限制内控限制纠偏限纠偏限趋势分析与GMP观念的成熟度及其合规程度病态型公司:我们从未被逮到,因此我们做的相当不错。病态型公司:我们从未被逮到,因此我们做的相当不错。反响型公司:符合规定很重要,所以每次出现问题的时反响型公司:符合规定很重要,所以每次出现问题的时候我们都做大量的任务。候我们都做大量的任务。前瞻型公司:我们积极应对本人存在的问题并积极采取前瞻型公司:我们积极应对本人存在的问题并积极采取措施。措施。自觉型公司:符合药品自觉型公司:
19、符合药品GMP对于我们来讲是我们日常的对于我们来讲是我们日常的生活方式。生活方式。趋势分析和GMP观念与一致性的成熟度自觉型公司自觉型公司前瞻型公司前瞻型公司反响型公司反响型公司病态型的公司病态型的公司平均值平均值纠偏限纠偏限纠偏限纠偏限 警戒限警戒限警戒限警戒限+ 2- 2+ 3- 3数值范围数值范围规范规范规范规范讨论:对于注射用水总微生物计数的趋势分析接受规范接受规范纠偏限纠偏限警戒限警戒限讨论情况:有两个用水点的结果到达了警戒限、其他的用水点结果都在限制以内。请问?假设他在检查中发现该问题,他将从哪些方面继续开展调查已确定能否存在问题?企业的相关规程OOS、OOT、偏向等此问题的企业的
20、分析、解释必要时深化查看取样的规程、检验的规程例如:企业调查能够呵斥该情况的缘由是:衔接用水点的硅胶软管被污染了取样出现问题取样容器本身有污染没有及时检验剩余的微生物生长 讨论药品消费企业验证验证产品实现产品实现(消费消费)技术转移技术转移产品开发产品开发建立并维护一种受控形状建立并维护一种受控形状产品药品的质量维护贯穿整个生命周期与药质量量相关的属性一直与临床实验所用样品相一致建立并维护一种受控形状以保证产质量量产品药品质量如何坚持?受控形状受控形状一致性一致性纠正措施和预防措施纠正措施和预防措施 (CAPA)系统系统变卦管理系统变卦管理系统监控产质量量监控产质量量 (年度产品回想年度产品回
21、想APR)监控工艺性能监控工艺性能 (趋势分析趋势分析)为什么要留意变卦? 变卦能够会影响期望的受控形状。 能够影响产品有效性和平安性。 变卦能够为制品带来风险/对制品的风险也能够会给生命平安呵斥隐患。变卦的缘由变卦变卦改良改良内部引起的内部引起的法律规定法律规定目的目的本钱本钱有效性可利用性有效性可利用性陈旧过时陈旧过时CAPA(纠正纠正与预防与预防措施措施变卦控制的质量风险管理 质量风险管理的方法可以作为变卦控制的辅助手段。 提出的变卦通常包括大量的资本开支和大型工程团队,而有时由变卦引入的重要风险并未被识别出来。 应确认变卦能够产生的影响并基于风险对其进展管理。 在变卦控制提议被同意前,
22、应明确该变卦的潜在风险并确定管理这些风险的战略。变卦的最终同意。变卦答应。执行方案的活动事项确定执行提议的变卦所应采取的措施。评价活动事项能否实践执行,执行后的结果及其风险能否可接受。同意开场进展变卦定期回想一切变卦 正式系统正式系统/ 书面规程书面规程 (SOP)描画预审系统、变卦提案、为何变卦组建跨职能团队对变卦的潜在效果进展审核。问问题:能够发生哪些潜在的能够影响患者平安或监管注册的问题? 同意变卦恳求 确认每个潜在问题的严重性、能够性和可测性,并确认总体风险。在检查变卦处置时应关注的方面 影响评价 (验证、稳定性) 评价变卦能够产生的风险 降低风险所采取的措施, 担任审批 (QA) 变
23、卦执行日期以及变卦同意日期 变卦对不断以来的工艺性能呵斥何影响年度产品回想分析、OOS、偏向、调查、CAPA 向药监部门递交的补充恳求偏向管理 偏向: 未能到达某一关键限制或已同意的程序的要求,认定为方案外变卦。 任何背叛既定程序的偏向都应进展记录并作出解释。 应有正式的偏向报告、调查和同意程序。 偏向与变卦一样能够给制品带来风险。同理应对其严重性进展评价,确定能够对制品/患者呵斥的风险。怎样调查关键偏向 关键偏向该当被调查并且调查的过程和结论应以文件的方式记录下来 关键偏向该当被调查和处理 关键偏向该当被调查并且结论应被记录; 关键偏向或非一致性事件和相关的调查;怎样调查关键偏向 方法: 先
24、看企业的程序规定 要求提供偏向的清单然后从中抽取关键偏向来进展深化检查 关注偏向调查的有效性和合理性 关键偏向该当被调查并且该当扩展调查批次的范围对那些能够曾经与特定的失败或偏向有关批次的进展调查怎样调查关键偏向请大家思索:如何面对一个没有偏向的企业?验证和确认 关注验证和确认系统VMP 方法:以检查设备确以为例 从中VMP选取设备来进展详细的检查 从现场检查过程中找出较关键的设备来调取验证和确认 重点检查消费工艺验证 举例 重点检查清洁验证 种类信息:规格、批量 共线情况:接触产品的设备和接触面积 接受规范:限制 最坏情况:消费的条件、清洗时间等 分析方法:限制、灵敏度质疑 “完美 结果 取
25、样位置: 尘埃粒子计数,取样管长度 布点以及设置沉降菌、浮游菌取样点的原理最终灭菌的无菌产品配料配料配料配料配料配料D级级相应的干净级别相应的干净级别配料配料干净灌装干净灌装过滤过滤目检、检验目检、检验包装包装灭菌灭菌配料配料注注射射用用水水辅辅料料烘干烘干/灭菌灭菌清洗容器安瓿、玻清洗容器安瓿、玻璃瓶等璃瓶等原原料料灌装控制灌装控制清洁效果确认清洁效果确认颗粒等异物检查颗粒等异物检查无菌检查无菌检查灭菌的验证和监灭菌的验证和监控控微生物负荷微生物负荷情况情况烘干烘干/灭菌必要灭菌必要时的验证和控制时的验证和控制灭菌前进展微生灭菌前进展微生物负荷检测物负荷检测非最终灭菌的无菌产品干净区:干净区
26、:D级级干净区:干净区:C级级无菌灌装房间:无菌灌装房间:B级级 关键灌装区域:关键灌装区域:A级级目检、检验目检、检验包装包装去除微生物的去除微生物的除菌过滤除菌过滤无菌灌装无菌灌装配料配料注注射射用用水水辅辅料料原原料料一切和产品直接一切和产品直接接触物品的灭菌接触物品的灭菌灭菌灭菌清洗清洗灭菌验证控制灭菌验证控制颗粒等异物检颗粒等异物检查无菌检查查无菌检查运用前后过滤运用前后过滤器完好性测试器完好性测试无菌工艺验证无菌工艺验证环境监控环境监控微生物负荷微生物负荷情况情况生物负荷的过生物负荷的过程控制程控制PSD1PSD5PSD3PSD2PSD4检查最终结果检查最终结果PSD3lQCl消费
27、消费l包装包装l库房库房lQAl环境监测环境监测检查结果检查结果参考资料PDA技术报告#44,无菌工艺质量风险管理PDA Technical Report # 44, Quality Risk Mangement for Aseptic ProcessPDA技术报告# 28,药品化学品无菌半废品工艺模拟测试PDA Technical Report # 28, process simulation Testing for sterile Bulk Pharmaceutical ChemicalsISPE,制药工业干净车间设计及建立优良工程规范ISPE, Good Engineering Prac
28、tices for clean room design and construction for Pharmaceutical IndustryICH Guideline Pharmaceutical Quality System Q10. June 2019A Risk Management Solution Designed To Facilitate Risk-Based Qualification, Validation and Change Control Activities Within GMP And Pharmaceutical Regulatory Compliance E
29、nvironments In The EU. Journal of GXP Compliance, July 2019, Volume 10, Number 4Failure Modes: Simple Strategies for Improving Qualitative Quality Risk Management Exercises during Qualification, Validation, and Change Control Activities - Journal of Validation Technology, February 2019, Volume 13, Number 2Risk Management for Pharmaceutical Change Control. William Harclerode and Christophe Noualhac. American Pharmaceutical Review. 2019, 10 (6), 1-4.FDA Guidance for Industry - Cha
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025-2030中国生物琥珀酸市场运行战略规划及发展行情监测报告
- 2025-2030中国生物基聚丙烯行业市场发展趋势与前景展望战略分析研究报告
- 2025-2030中国生物农药行业发展分析及投资风险预测研究报告
- 2025-2030中国玻璃纤维蜂窝板行业市场现状供需分析及投资评估规划分析研究报告
- 2025-2030中国玻璃标本瓶行业风险评估及发展潜力研究报告
- 2025-2030中国环氧固化剂行业市场发展趋势与前景展望战略研究报告
- 2025-2030中国环境卫生管理行业市场发展前瞻及投资战略研究报告
- 2025-2030中国玛咖粉行业市场发展趋势与前景展望战略研究报告
- 2025-2030中国猫用洁齿产品市场销售渠道及投资前景风险预警研究报告
- 2025-2030中国特级初榨橄榄油市场供应渠道与未来销售策略分析研究报告
- 肉牛营养需要
- 广西壮族自治区桂林市各县区乡镇行政村村庄村名明细居民村民委员会
- 腹部CT检查技术ppt课件(PPT 18页)
- 《医药代表拜访技巧及区域管理》PPT课件
- 附表1哈尔滨市尚志市水库工程划界成果表
- 事件研究法PPT课件
- 《刘姥姥进大观园》课本剧剧本3篇
- 监理规划细则审批表
- 国家开放大学《水利水电工程造价管理》形考任务1-4参考答案
- 矿泉水资源采矿许可证
- 焊接检验培训课件(PPT 61页)

评论
0/150
提交评论