



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、IMpower150研究最新OS和亚组分析结果出炉2020年美国癌症研究协会(AACR大会在密切关注新冠肺炎疫情发展的同时,采取线上年会方式,汇集并分享了肿瘤领域最前沿的研究成果。当地时间2020年4月27日,AACR 线上年会报道了 IMpower150研究,阿替利珠单抗+贝伐珠单抗+卡钳+紫杉醇(ABCP组)和 阿替利珠单抗+卡钳+紫杉醇(ACP组)分别对贝伐珠单抗 +卡钳+紫杉醇(BCP组),一线治 疗晚期非鳞非小细胞肺癌(NSCLC的最终总生存时间(OS)结果,并对 EGFR敏感突变、 肝转移以及PD-L1表达状态进行了亚组分析。IMpower150研究是一项多中心、开放标签的随机对照
2、出期临床试验,评估阿替利珠单抗+卡钳+紫杉醇联合或不联合贝伐珠单抗在未接受过化疗的W期非鳞非小细胞肺癌(NSCLC中的疗效及安全性。1202例患者按1 : 1 : 1的比例随机分为阿替利珠单抗 +卡钳+ 紫杉醇组(A组)、阿替利珠单抗+贝伐珠单抗+卡钳+紫杉醇组(B组)和贝伐珠单抗+卡钳 +紫杉醇(C组,对照组)。各组患者分别接受4-6个周期的研究方案治疗,后续分别采用阿替利珠单抗(A组),阿替利珠单抗+贝伐珠单抗(B组)和贝伐珠单抗(C组)进行维持 治疗。主要研究终点为研究者评估的ITT-WT型患者的无进展生存(PFS ,研究者评估的Teff-high WT型患者的PFS以及ITT-WT型患
3、者的总生存(OS)。ABCP有望成为晚期非鳞 NSCLC台疗主流方案根据AACR在线公布的ITT-WT人群OS更新结果,B组OS较C组显著提高:19.5个月vs14.7个月(HR=0.80, 95%CI: 0.670.95)。A组与C组OS有4.3个月的获益,但未达到统计学 意义:19.0 个月 vs 14.7 个 月(HR=0.84, 95%CI: 0.711.00)。ABCP vs BCPITT-WTsfl/ Alls -oJaAO台1与Median, 14,7 mo旧5蟹 QMedian, 19.5 mo(95% Cl:仃 0,及 2)T T F 1口。K 10 TOSO 50 4030
4、 -10-1« 21 M 2T 和 31 36 39Time Irronth"HR,C 0.80(95% Cl: 0,67, 0.95)P=0.01Nd at RiU ABCP 369 325 2e8 m 21CBCP 309 259 工34 1打 160B组vs C组,ITT-WT人群OS显著获益036»Nd at Risk ACP 350 321 286 245 222BCP 338 309 269 234 197= « 一一EJWAO151921MZ?3DTim* (month?)19fiITS157M31201H1601391223S4BQA组v
5、s C组的ITT-WT人群OS结果对于ITT人群A组vs C组的OS结果,需要慎重解读,从OS的绝对数值来看,A组和B 组都达到了 19个月以上,而2组都包含了免疫治疗,再次确认了阿替利珠单抗作为免疫药 物在方案中带来的价值。并且我们还要注意后续治疗带来的影响,C组中有约46%的患者接受了至少一次免疫治疗,对于延长OS也有一定影响。B组(包含贝伐珠单抗) vs C组OS的阳性结果,提示了抗血管生成药物贝伐珠单抗联 合免疫治疗的重要意义。总白来说,对于晚期非鳞NSCLC患者,ABCP四药联合的方案可以作为主流方案,其获益是可以肯定的。IMpower150为EGFR+肝转移患者带来新希望IMpow
6、er150研究在设计之初,有一个很大的亮点就是预设了EGFR/AL也因突变和肝转移的2个亚组分析。为什么要预设亚组?这是因为在亚裔非鳞NSCLC思者中,EGFR突变率人群占比很大,有 50%左右1。虽然目前EGFR突变患者一线标准治疗方案是EGFR TKI但患者几乎都会耐药,耐药后的患者治疗方式有限。EGFRW人群由于生物学特性不同,驱动性癌基因导致免疫抑制激活的通路较多、免疫 微环境中存在较多抑制信号,因此往往被认为是“免疫豁免”的人群。并且已经证实免疫单药治疗效果不佳,多个临床试验和Meta分析都显示免疫单药用于经治EGFR突变人群的获益有限2,3。同样的,肺癌患者常见肝脏转移,这些患者的
7、预后较其他部位转移的患者更差,侵袭性更强,肿瘤负担更大4。此外,基线肝转移患者从PD-1或PD-L1抗体治疗中获益也很小。因此,IMpower150为了探索不同免疫联合的方案在EGFR利肝转移两个特殊人群中的有效性,设计了这两个关键亚组,其最终结果在临床中一直备受关注。IMpower150研究人组了 124例经靶向治疗失败的非鳞 NSCLC思者。EGF就感突变亚组 的OS结果是赢得非常漂亮的:B组较C组延长EGFR亚组的OS高达11.3个月(29.4 vs 18.1个月,HR=0.60 ;95%CI:0.31-1.14),甚至比整体人群的结果还要好。另外,肝转移亚组的分 析结果显示,ITT人群
8、中基线肝转移患者B组vs C组的OS分别为13.2个月vs 9.1个月(HR=0.67, 95%CI:0.45-1.02)。ABCPvs BCPSeflsitizmq EGffl*ACPvs BCPSensitizing EGFR+firng in jrsTfMlMHHM不4 新 13.1 IM帆叩刷 (MCU3L1U)HRJ.N (K* Ct 闸 IM-IE -I JIi alb出啊叫*她陋?呼毕一.J4 17 K » fl C 4 4 3- UTim UmB组vs C组(左)和 A组vs C组(右)EGFR亚组的OS结果kMm. B.l n 型口谶陶耶珈WtaL m EABCP
9、vs BCPITT IMth Liver M酣与妣嘱HUM?3 4 1 惇 4 喟*力电署31MM 刊如ACPvsBCPXITT Wkth Liver MetaBtisesHRJOIV1J1)iMui T.l .M e1_-一 二冲良,. 3 I | I 331|4* 二胃鼻41H MTw («M*|W 伸W件It fl巾T才& 1 11I I19 H M 3t tt I t I f T 1 1 | I19 P £ H 34 31 11 1| I t » 7 F I ) I IB组vs C组(左)和A组vs C组(右)肝转移亚组的 OS结果在EGFR亚组中
10、,相较于 A组vs C组的结果,B组vs C组的KM曲线分离明显;同样 的,在肝转移亚组也观察到了一致的获益趋势,相较于 A组vs C组,B组vs C组的KM曲 线分离明显,无论是在 EGFR敏感突变亚组还是肝转移亚组,ABCP四药方案都能带来 OS的获益。同时,也提示我们是否包含贝伐珠单抗,对于免疫治疗在这些特殊人群中获益的影响非常大,强烈提示了贝伐珠单抗对改善免疫微环境,促进免疫治疗起效中具有重要价值。 由于亚组的样本量有限,未来,期待有更大样本量的研究针对肝转移和EGFR突变人群,去进一步验证IMpower150研究的亚组结果,这也是亚组分析的意义所在。值得注意的是, IMpower15
11、0也是目前唯个免疫联合治疗在EGFR亚组人群中有OS获益的III期临床研究。总的来说,IMpower150的四药联合对于 EGFR突变患者的后线治疗提供了新的选择。 同时,对于伴肝转移的患者来说,通常疾病负荷较大,具有侵袭性,肿瘤体积较大,临床亟 需缓解的这部分患者,可以优先考虑阿替利珠单抗+贝伐珠单抗+化疗的联合方案。从IMpower150研究结果来看,PD-L1高表达的人群是否依然是免疫联合获益的优势人 群?四联疗法是否增加了不良事件的发生率?此次更新的OS结果显示,与对照组相比,ABCP四药联合方案在 2个不同PD-L1表达亚 组中均有不同程度的 OS改善:1) TC12/3或ICT2/
12、3 (PD-L1>1%)组为:22.5个月 vs 16.0 个月(HR 0.73) ; 2) TC0 和 IC0 ( PD-L1<1%)组为:16.9 个月 vs 14.1 个月(HR 0.90)。 基于IMpower150中ABCP四药联合对于整体人群以及不同亚组带来的临床获益,阿替利珠 单抗+贝伐珠单抗+紫杉醇/卡钳方案已被美国国家综合癌症网络(NCCN)指南作为非鳞NSCLC一线治疗推荐,并且在十余个国家获批。总的来说,四药联合方案为临床治疗不同NSCLC的人群均提供了有效的治疗选择。此外,A组vs C组,在TCT2/3或ICT2/3 ( PD-L1> 1%)亚组中也有
13、 OS获益:24.4个月 vs 16.0个月(HR 0.71),这说明阿替利珠单抗 + 卡钳+紫杉醇的三药联合方案为 PD-L1阳性的 非鳞NSCLCB者提供了新的一线治疗方案。然而,在 PD-L1阴性的人群中,A组vs C组的 OS结果未表现出明显差异。这也提示我们,临床上对于非鳞NSCLC的一线?B疗,BCP仍是标准的治疗方案。OS in PD-L1 Subgroups in the ITT-WT PopulationACP vs BCPTCi '2i'3cfHR, 0.71 Cl. 0.55.0511e* h . Mkrhf ryrN1 *re htP" >
14、;1>i r 1£, lbw,制忸划/ ew1C, timv Mlt33 J IC1 扪 * TC*l*if皿 劭鹏< 1, ihl 雷* 1结(二wfiTUHdL 11*必中 SwtRirCm 11 R' Lm. a. 71-SMteCIt也生MABCP vs BGPTC1/2/3 or lC1i2O-WTABCPvs BCPTCOaind ICQ-WTAGP vs BCPTCfl jnd ICO.WTM. A M|fl9%Ci: MM .加J不同PD-L1表达亚组的OS结果安全性方面,此前的结果提示,患者在维持期的不良事件发生率要低于诱导期,维持期的去化疗模式
15、或许值得我们进一步探索其在NSCLC领域的应用。总体来说, ABCP四联方案的毒性事件在预期范围之内,安全性事件可管可控。从既往的临床经验来看,多药联合并不 会导致不良事件的叠加放大,并不用过多担心。而且目前看到联合抗血管药物或化疗还可能起到一定“减毒”作用。免疫联合抗血管生成未来可期通过对IMpower150研究中免疫+抗血管生成+化疗的用药模式分析, 三者是可以协同起 效的。一方面,化疗可以降低肿瘤负荷,导致肿瘤的凋亡,大量肿瘤抗原的释放;化疗也可以去除部分免疫抑制活性细胞,如髓样来源的抑制性细胞和调节性T细胞,从而来调节免疫微环境。此外,免疫和抗血管生成都是作用于肿瘤微环境,理论上两者互
16、相影响,具有协同效应。两者的联合对于具有非炎症型免疫微环境的肿瘤治疗尤其重要。另一方面,VEGF/VEGFR!路参与肿瘤微环境免疫状态的调节,通过阻断VEGF通路,不仅可以阻断其免疫抑制效应,还能使血管系统正常化,促进肿瘤特异性 T细胞和其他免疫效应分子的输送。有研究证实,VEGF通过抑制了 NF-kB的磷酸化,从而阻碍了树突细胞( DC细胞)的成 熟;白细胞(T细胞)向肿瘤间质浸润,要先在血管内部细胞发生附着。但是VEGF会降低VACM (血管内皮黏附分子),从而降低T细胞的黏附;同时 VEGF会上调血管内皮细胞的死亡配体(FASL ,从而和T细胞接触时,引起 T细胞的凋亡5,6; VEGF
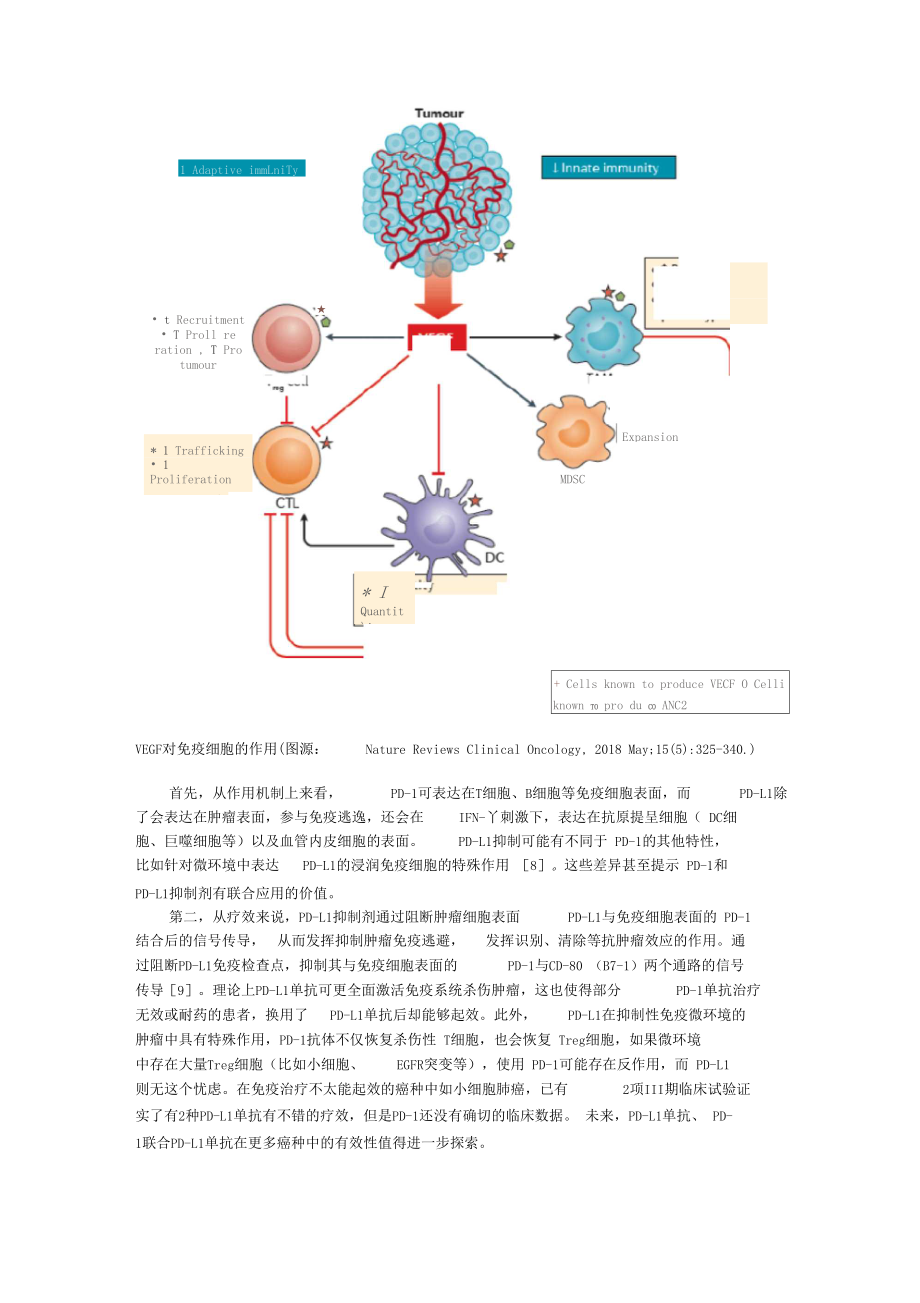
17、还可以通过产生 或诱导了 MDSCs TAMs和Treg等免疫抑制相关细胞,打破免疫动态平衡,向免疫抑制发展 口。MDSC1 Adaptive immLniTy* I Quantiti 1 MaTurarion I ntiturriourfunctionExpansion t Recruitment T Proll re ration , T Pro tumour rytokinb;* 1 Trafficking 1 Proliferation* 1 Effector functionT cellVEQFTAM T Recruitmenl 1 Phagocytosis T Piu-iuniuu
18、i M2 pheno+ Cells known to produce VECF O Celli known to pro du co ANC2VEGF对免疫细胞的作用(图源:Nature Reviews Clinical Oncology, 2018 May;15(5):325-340.)首先,从作用机制上来看, PD-1可表达在T细胞、B细胞等免疫细胞表面,而 PD-L1除 了会表达在肿瘤表面,参与免疫逃逸,还会在IFN-丫刺激下,表达在抗原提呈细胞( DC细胞、巨噬细胞等)以及血管内皮细胞的表面。PD-L1抑制可能有不同于 PD-1的其他特性,比如针对微环境中表达PD-L1的浸润免疫细胞的
19、特殊作用 8。这些差异甚至提示 PD-1和PD-L1抑制剂有联合应用的价值。第二,从疗效来说,PD-L1抑制剂通过阻断肿瘤细胞表面PD-L1与免疫细胞表面的 PD-1结合后的信号传导,从而发挥抑制肿瘤免疫逃避,发挥识别、清除等抗肿瘤效应的作用。通过阻断PD-L1免疫检查点,抑制其与免疫细胞表面的PD-1与CD-80 (B7-1)两个通路的信号传导9。理论上PD-L1单抗可更全面激活免疫系统杀伤肿瘤,这也使得部分PD-1单抗治疗无效或耐药的患者,换用了PD-L1单抗后却能够起效。此外,PD-L1在抑制性免疫微环境的肿瘤中具有特殊作用,PD-1抗体不仅恢复杀伤性 T细胞,也会恢复 Treg细胞,如
20、果微环境 中存在大量Treg细胞(比如小细胞、EGFR突变等),使用 PD-1可能存在反作用,而 PD-L1则无这个忧虑。在免疫治疗不太能起效的癌种中如小细胞肺癌,已有2项III期临床试验证实了有2种PD-L1单抗有不错的疗效,但是PD-1还没有确切的临床数据。 未来,PD-L1单抗、 PD-1联合PD-L1单抗在更多癌种中的有效性值得进一步探索。第三,从安全性上来讲,与PD-1抑制剂相比,PD-L1抑制剂对PD-L2、以及癌灶外T细胞的PD-1的抑制有限,因而降低了由于免疫细胞过度激活引起的肺基质细胞损伤导致的肺 炎的发生10,11。在临床使用中,确实也证实了PD-L1更低毒的说法一一多项基
21、于临床研究的荟萃分析结果提示PD-L1抑制剂在免疫相关不良反应与肺炎的发生上均显著少于PD-1抑制剂12-14。总结来说,IMpower150达到了两个共同的主要终点,这是目前首个也是唯一一个免疫 联合抗血管生成一线治疗用于转移性非鳞状NSCLC彳导PFS OS统计学意义和临床意义改善的III期临床研究:在ITT- WT和ITT人群中,阿替利珠单抗联合贝伐珠单抗枇疗对PFS和OS均有显著获益; 所有患者均观察到了有临床意义的PFS和OS获益,包括主要研究亚组,EGFR+/ALK亚组和肝转移亚组是阿替利珠单抗联合贝伐珠单抗和化疗方案的优选人群,临床上针对侵袭性强, 疾病负荷较重,肿瘤体积较大,临
22、床亟需缓解的这部分患者也可优先考虑阿替利珠单抗联合 贝伐珠单抗化疗方案;无论患者PD-L1表达情况如何,ABCP四药方案均能取得 OS的获益;对于PD-L1阳性的 非鳞NSCLC思者,ACP三药联合方案也给临床带来了一种新的治疗选择;而对于PD-L1表达阴性的患者,BCP方案仍是目前一线非鳞 NSCLC台疗的基石。IMpower150研究的结果肯定了免疫 +抗血管生成+化疗以及免疫+化疗的临床应用价值,未来 我们或许可以进一步探究“去化疗”的模式是否可行,以及研究不同的化疗药物的选择对免疫疗效的影响,这是 IMpower150没有告诉我们的答案。从E4599研究到BEYONDW究再到IMpow
23、er150研究,抗血管生成联合化疗的模式、免 疫联合抗血管生成和化疗的模式在NSCLC43不断刷新 OS记录。IMpower150研究中C组OS和在欧美开展的ECOG 4599研究中的12.3个月OS相当,而 BEYOND研究OS达到了 24.3个月。这可能是由于研究的人种差异导致的,具体原因有待探索。未来,我们可以期待正在进行中的中国人群免疫联合抗血管生成及化疗的IMpower151数据带来更多启示。参考文献1 Shi Y1, Au JS, Thongprasert S, Srinivasan S, Tsai CM, Khoa MT, Heeroma K, Itoh Y, Cornelio
24、G, Yang PC.A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER).J Thorac Oncol. 2014 Feb;9(2):154-62.2 Chee Khoon Lee,et al. Checkpoint Inhibitors in Metastatic EGFR-Mutated Non-Small Cell Lung
25、Cancer-A Meta-AnalysisJ Thorac Oncol. 2017 Feb;12(2):403-407.3 Fernando Concha-Benavente, Robert L Ferris. Reversing EGFR Mediated Immunoescape by Targeted Monoclonal Antibody Therapy.Front pharmacol. 2017 May 30;8:332.4吴炳群,等.不同转移部位的非小细胞肺癌患者的生存时间比较J.中国肺癌杂志,2019,22(02):55-60.5非小细胞肺癌中血管内皮生长因子与树突细胞的关系.
26、J国际肿瘤学杂志. 2010;2;37(2):138-141.6李玉灵,赵华,任秀宝.VEGF及其受体与免疫抑制细胞关系的研究进展J.山东医药,2016(17 期):105-107.7 Dai F, Kloepper J, Amoozgar Z, et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challengesJ. Nature Reviews Clinical Oncology, 2018 May;15(5):325-340.8 Mayoux M, et al. Dendritic cells dictate responses to PD-L1 blockade cancer immunotherapy.Sci Transl Med 2020;12(534). pii: eaav7431.9 Manish J Butte,et al. Programmed death-1 Ligand 1 Interacts Specifically With the B7-1 Costimulatory Molecule to Inhibit T Cell Responses Immunity. 2007 Jul;27(1):111-22.10 Chen DS, et al.
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 光伏电池生产线参观保密协议书
- 慢性肿瘤用药指导
- 综合货物运输基础
- 2024年高考语文备考:非连续性文本+提出对策措施
- 2024年高考语文冲刺小题增分练03含答案
- Zika学前教育体系构建路径
- 为谁工作总结汇报
- 猪胸膜肺炎放线杆菌研究概述
- 足浴行业服务培训
- 知“帕”不怕:科学防治帕金森病健康宣教
- HG∕T 5229-2017 热空气老化箱
- 09SMS202-1埋地矩形雨水管道及附属构筑物(混凝土模块砌体)
- 医生签约MCN机构合同模版
- 重庆市沙坪坝区南开中学校2023-2024学年八年级下学期期末英语试题(无答案)
- 广东省深圳市南山区2023-2024学年七年级下学期期末英语试题
- 2022-2023学年江苏省苏州市高二下学期学业质量阳光指标调研卷英语试卷
- 苏教版小学四年级下册科学期末测试卷及参考答案1套
- 体育场馆物业管理操作规范
- 24春国开电大《旅游学概论》形考任务1-4试题及答案
- 人工智能导论智慧树知到期末考试答案章节答案2024年哈尔滨工程大学
- 生命伦理学:生命医学科技与伦理智慧树知到期末考试答案章节答案2024年山东大学

评论
0/150
提交评论