



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、想想 一一 想想列举你所熟悉的铝和铝合金制品,并思考它们分别利用了列举你所熟悉的铝和铝合金制品,并思考它们分别利用了铝的哪些性质?铝的哪些性质?五、铝的物理性质和用途五、铝的物理性质和用途物理性质物理性质用途用途用途不一的各种铝合金用途不一的各种铝合金易加工成各种形状,易加工成各种形状,包装、装饰工艺,包装、装饰工艺,铝箔、铝丝、银粉涂料铝箔、铝丝、银粉涂料铝锅、铝壶等加热器具铝锅、铝壶等加热器具铝芯电线、电缆铝芯电线、电缆银白色,有金属光泽银白色,有金属光泽质地较软,延展性好质地较软,延展性好密度小、熔沸点低密度小、熔沸点低导热性能好导热性能好导电性能较好导电性能较好熔点熔点低低、硬度、硬度
2、大大铝合金具有密度小、强度高、可塑性好、制造工艺简铝合金具有密度小、强度高、可塑性好、制造工艺简单、成本低、抗腐蚀能力强等特点,大量用于建筑业、单、成本低、抗腐蚀能力强等特点,大量用于建筑业、交通运输业和电子行业。交通运输业和电子行业。 在在1919世纪中期,法兰西第二共和国总统拿破世纪中期,法兰西第二共和国总统拿破仑三世,珍藏着一套铝制的餐具,平时舍不得用,仑三世,珍藏着一套铝制的餐具,平时舍不得用,直到国宴时才拿出来炫耀一番。直到国宴时才拿出来炫耀一番。 元素周期表的创始人门捷列夫在受到英国皇元素周期表的创始人门捷列夫在受到英国皇家学会的表彰时,得到的却是一只铝杯。家学会的表彰时,得到的却
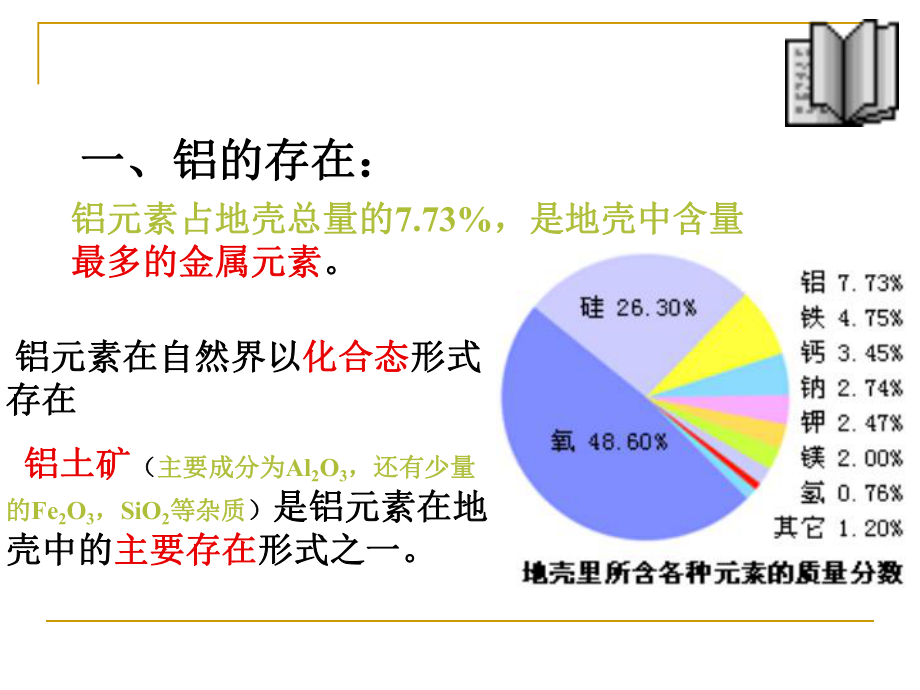
3、是一只铝杯。 为什么拿破仑没有珍藏金制的餐具为什么拿破仑没有珍藏金制的餐具, ,而门捷列而门捷列夫也没有给奖励一只金杯呢?夫也没有给奖励一只金杯呢?历史的疑问历史的疑问 其实在当时铝的产量非常少其实在当时铝的产量非常少,从而导致了铝的价格相当从而导致了铝的价格相当的昂贵,甚至都超过了黄金的昂贵,甚至都超过了黄金 是是因为铝在地球上的含量比黄金还少吗因为铝在地球上的含量比黄金还少吗? ?一、铝的存在:一、铝的存在: 铝元素在自然界以铝元素在自然界以化合态化合态形式形式存在存在 铝土矿铝土矿(主要成分为主要成分为Al2O3,还有少量还有少量的的Fe2O3,SiO2等杂质等杂质)是铝元素在地是铝元素
4、在地壳中的壳中的主要存在主要存在形式之一。形式之一。铝元素占地壳总量的铝元素占地壳总量的7.73%,是地壳中含量,是地壳中含量最多的金属元素最多的金属元素。如果让我们回到如果让我们回到19世纪世纪,我们我们可以用哪些方法从氧化铝制得可以用哪些方法从氧化铝制得金属铝金属铝?交流与讨论交流与讨论回忆回忆: 1.工业上如何制取金属钠、金属镁?工业上如何制取金属钠、金属镁? 2.工业上如何制取金属钛?工业上如何制取金属钛?铝的铝的冶炼历史冶炼历史1825年,丹麦科学家厄斯泰德用年,丹麦科学家厄斯泰德用钾钾制得了不制得了不纯的铝。纯的铝。1827年,德国化学家沃勒改进了厄斯泰德的年,德国化学家沃勒改进了
5、厄斯泰德的方法,但制得的铝纯度和产量依然不高。方法,但制得的铝纯度和产量依然不高。1854年,法国化学家德维尔用年,法国化学家德维尔用钠钠代替钾,制代替钾,制得比较纯的铝,并且大量生产。他对沃勒极得比较纯的铝,并且大量生产。他对沃勒极其尊敬,铸了个其尊敬,铸了个铝质奖章铝质奖章送给沃勒。送给沃勒。n 18841884年,还在美国奥伯林学院化学系上大年,还在美国奥伯林学院化学系上大学的学的豪尔豪尔开始探索廉价的炼铝方法。通过不断开始探索廉价的炼铝方法。通过不断摸索摸索, ,豪尔把豪尔把氧化铝氧化铝熔化在熔融的熔化在熔融的冰晶石冰晶石(Na3AlF6)中进行电解。中进行电解。18861886年年2
6、 2月,他终于看到月,他终于看到小球状的铝聚集在阴极上。后来,这些铝球竟小球状的铝聚集在阴极上。后来,这些铝球竟成为成为“王冠宝石王冠宝石”,至今仍珍存在美国制铝公,至今仍珍存在美国制铝公司的陈列厅中。而豪尔,当时还司的陈列厅中。而豪尔,当时还不满不满2323岁岁。电解铝方法的发明电解铝方法的发明二、电解法制铝二、电解法制铝冰晶石(冰晶石(Na3AlF6)做助)做助熔剂,熔剂,大大降低了大大降低了Al2O3 的熔点的熔点232342OAlOAl通电铝土矿:铝土矿:主要成分为主要成分为Al2O3,还还有少量的有少量的Fe2O3 、SiO2等杂质等杂质讨论讨论: :如何从铝土矿中得到纯净如何从铝土
7、矿中得到纯净的氧化铝?的氧化铝?工业冶炼铝的流程工业冶炼铝的流程溶解溶解铝土矿铝土矿NaOH溶液溶液过滤过滤残渣残渣二氧化碳二氧化碳酸化酸化过滤过滤滤液滤液灼烧灼烧H2O电解电解铝铝制取纯净的制取纯净的Al2O3电解电解Al2O3 铝土矿:主要成分为铝土矿:主要成分为Al2O3还有少量的还有少量的Fe2O3 、SiO2等杂质等杂质写出从铝土矿制备氧化铝写出从铝土矿制备氧化铝过程中发生的化学方程式过程中发生的化学方程式P63 问题解决:问题解决: Al2O3+2NaOH=2NaAlO2+H2O NaAlO2+CO2+2H2O=Al(OH)3+NaHCO3 2Al(OH)3=Al2O3+3H2O
8、2Al2O3 = 4Al+3O2通电通电AlO2 +CO2+2H2O=Al(OH)3+HCO3 Al2O3+2OH =2AlO2 +H2O 工业冶炼铝的主要反应工业冶炼铝的主要反应偏铝酸钠偏铝酸钠(NaAlONaAlO2 2 )属于哪类物质?属于哪类物质?Al2O3+2NaOH=2NaAlO2+H2OAl2O3能与能与NaOH反应制得反应制得NaAlO2和和H2O,说明说明Al2O3有什么性质?有什么性质?有酸性氧化物的性质有酸性氧化物的性质 Al2O3能与酸反应吗?能与酸反应吗?既能与酸反应也能与碱反应生成既能与酸反应也能与碱反应生成盐和水的氧化物是盐和水的氧化物是两性氧化物两性氧化物Al2
9、O3+6HCl=2AlCl3+3H2OAl2O3 + 3H2SO4 = Al2(SO4)3 +3H2O氧化铝是典型的两性氧化物氧化铝是典型的两性氧化物有碱性氧化物的性质有碱性氧化物的性质天然氧化铝天然氧化铝刚玉刚玉红宝石(红宝石(Al2O3)蓝宝石蓝宝石(Al2O3)氧化铝的天然氧化铝的天然存在存在铝土矿铝土矿由氧化铝的水合物和少量的氧化由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成铁和二氧化硅杂质组成刚刚 玉玉氧化铝的天然晶体,硬度大仅次氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(于金刚石、金刚砂(SiCSiC)( (蓝宝蓝宝石、红宝石是刚玉的一种)石、红宝石是刚玉的一种)1电解法炼铝时
10、,冰晶石的作用是电解法炼铝时,冰晶石的作用是 A. 助熔剂助熔剂 B. 催化剂催化剂 C. 还原剂还原剂 D. 氧化剂氧化剂 【练习练习】2、MgO中混有少量中混有少量AI2O3杂质,欲将杂质除去杂质,欲将杂质除去可选用的试剂是可选用的试剂是 A 稀硫酸稀硫酸 B 浓氨水浓氨水 C 稀盐酸稀盐酸 D NaOH溶液溶液铝的趣话n物以稀为贵,在100多年前,铝曾是一种稀有的贵重金属,被称为“银色的金子”,比黄金还珍贵。法国皇帝拿破仑三世,为显示自己的富有和尊贵,命令官员给自己制造一顶比黄金更名贵的王冠铝王冠。他戴上铝王冠,神气十足地接受百官的朝拜,这曾是轰动一时的新闻。拿破仑三世在举行盛大宴会时,
11、只有他使用一套铝质餐具,而他人只能用金制、银制餐具。即使在化学界,铝也被看成最贵重的。英国皇家学会为了表彰门捷列夫对化学的杰出贡献,不惜重金制作了一只铝杯,赠送给门捷列夫。(1)你在日常生活中见到过哪些铝制品?这些铝制品是纯净物吗?哪些铝制品中的成分是铝单质?你能分析归纳出铝单质的物理性质和用途吗? 复习回忆 铝的用途n铝的价值贵贱,完全取决于炼铝工业的水平。随着铝产量的增加,铝价也就下降。1854年,1公斤铝需1200卢布,而到了十九世纪末就降到1卢布。显然,珠宝商人已经对铝完全失去了兴趣,但是,铝却立即吸引了整个工业界。n1919年,用铝合金造出了第一架飞机,从此以后,铝的命运就牢固地与飞
12、机制造业联系在一起了。铝被誉为“带翼的金属”。铝的物理性质与用途n铝是一种具有银白色金属光泽的轻金属,具有良好的延展性、导电性和导热性,可以用铝来制造电线和电缆,可作汽车、飞机、火箭材料,也能做各种铝质器皿(2)地壳中含量最多的金属元素是 ;地壳中的铝以 (填单质或化合物)形式存在。l为什么?l练一练l想一想铝化合物l 根据金属活动性顺序表,铝比铁活泼,但铝为什么却不像铁那样容易被空气腐蚀?家中的铝锅能否经常用金属清洁球或煤渣擦亮,为什么? 交流与讨论l1、将细铝丝打磨绕成螺旋状后,下面连接一火柴梗,点燃后插入氧气的集气瓶中,铝丝燃烧,产生耀眼的白光,少量白烟,白色固体。写出该反应的化学方程式
13、: l 。阅读与思考 铝在金属活动性顺序中位于镁后,比镁的活动性弱。镁可以与热水反应,产生H2 ,而Al与冷水不反应,但可以在沸水中发生缓慢反应,写出该反应的化学方程式 。阅读与练习铝锅为什么还能烧水而不损坏?思考2Al+6H2O=2Al(OH)3+3H2写出工业上利用铝热反应焊接铁轨的化学方程式 。 阅读P66并归纳、什么叫铝热反应?练一练 铝和金属氧化物生成其它金属和氧化铝的反应属于铝热反应2、铝热剂? 铝和金属氧化物的混合物1、铝桶能否盛放稀盐酸、稀硫酸?2、铝桶能否盛放浓盐酸、浓硫酸?为什么?讨论 Al片打磨后分别浸入浓硝酸、浓硫酸、6mol/L的稀盐酸、6mol/L的稀硫酸中,观察现
14、象。小 结与铝反应与铝反应的物质的物质实验现象实验现象结论或离子方程式结论或离子方程式浓硝酸浓硝酸浓硫酸浓硫酸稀硫酸稀硫酸稀盐酸稀盐酸l无气泡产生无气泡产生l表面钝化表面钝化l无气泡产生无气泡产生l表面钝化表面钝化l有气泡产生有气泡产生 l有气泡产生有气泡产生 2Al+6H+=2Al3+3H2 2Al+6H+=2Al3+3H2 猜想观察与思考写出该反应的化学方程式:l铝桶能否盛放氢氧化钠等碱性溶液?l如何通过实验验证?练一练lAl片打磨后浸入4mol/L的NaOH 溶液中一段时间,观察到的现象是:lAl片表面有气泡冒出l2Al+2NaOH+2H2O=2NaAlO2+ 3H2 讨论总结与交流铝桶
15、能否用于配制波尔多液?为什么?今天你学到了什么?今天你学到了什么? l铝的物理性质与用途l铝的化学性质:l1、与氧气反应(O2中可燃;空气中钝化)l2、与沸水反应 3、与酸反应 l4、与碱溶液反应 5、与盐溶液反应 。l1写出下列反应的化学方程式:练一练金属铝在空气中钝化 。金属铝在硫蒸气中反应产生硫化铝: 。铝片与沸水反应: 。铝粉与四氧化三铁发生铝热反应: 8Al+3Fe3O4=4Al2O3+9Fe 。铝丝插入盐酸中 。铝片与氢氧化钠溶液反应:4Al+3O2=2Al2O3 2Al+3S=Al2S3 。2Al+6HCl=2AlCl3+3H22Al+2NaOH+2H2O=2NaAlO2+3H2
16、 2Al+6H2O=2Al(OH)3+3H2练一练2写出下列离子反应的离子方程式:铝丝与稀硫酸反应: 2Al+6H+=2Al3+3H2 铝片与氢氧化钠溶液反应: 。氧化铝与足量盐酸反应: 。氧化铝与氢氧化钠溶液反应: 。 。2Al+2OH+2H2O=2AlO2+ 3H2Al2O3+6H+=2Al3+ +3H2OAl2O3+2OH=2AlO2+H2Oll1用于飞机制造业的重要材料的是( )lAMg-Al合金 BCu-Sn合金lCAl-Si合金 D不锈钢l2. 下列物质中属于纯净物的是( )lA、铝热剂 B、铝土矿lC、明矾 D、含铝38%的Al2O33铝合金因坚硬、轻巧、美观、洁净、易于加工而成
17、为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )A不易生锈 B导电性好 C密度小 D强度高A CB当堂练习l4铝热剂中铝的作用是( )lA催化剂 B氧化剂lC还原剂 D填充剂l5将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )lA稀硝酸 B稀盐酸lC硝酸铜 D氢氧化钠l6. 新买的铝锅、铝壶用来烧开水时,凡是水浸到的地方都会变成黑色,这与水中含有下列可溶盐有关的是( )lA钠盐 B钾盐lC钙盐 D铁盐lClClD当堂练习l7由Na、Mg、Al、Zn四种金属单质中的两种组成的混合物共12克,跟足量盐酸反应,产生5.6L H2 (标况),由此可
18、判断混合物中必定含有( )lA.Na B.Mg C.Al D.Zn当堂练习l解析解析: 5.6L H2 标态下的氢气是标态下的氢气是0.25mol,则混合物的平均摩尔质量是则混合物的平均摩尔质量是12g/0.25mol=48g/mol,则各组份金属的则各组份金属的摩尔质量既要有比摩尔质量既要有比48g/mol大的大的,又要有又要有比比48g/mol小的小的.lD课后练习l1 、标出练习1中的电子转移方向和数目: l2、完成B组题练习 和酸反应:和酸反应: Al2O3 +6HCl = 2AlCl3 + 3H2O Al2O3 + 6H+ =2Al3+ + 3H2O (Al2O3表现了表现了碱性氧化
19、物碱性氧化物的性质)的性质)AlAl2 2O O3 3 + 2NaOH = 2NaAlO + 2NaOH = 2NaAlO2 2 + H + H2 2O OAlAl2 2O O3 3 + 2OH + 2OH- - = 2AlO = 2AlO2 2- - + H + H2 2O O(AlAl2 2O O3 3表现了酸性氧化物的性质)表现了酸性氧化物的性质)(3)主要用途:)主要用途:作耐火材料:制耐火管、耐火坩作耐火材料:制耐火管、耐火坩埚、耐高温的实验仪器等埚、耐高温的实验仪器等冶炼铝的原料冶炼铝的原料.K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag电解法电解法热热还原法还原法热热分解法分解法不同金属冶炼方法的选择不同金属冶炼方法的选择K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag写出电解法制铝的化学方程式写出电解法制铝的化学方程式 铝铝 的的 氢氢 氧氧 化化 物物 【阅读阅读】 你从氢氧化铝用途的阅读材料中你从氢氧化铝用途的阅读材料中了解到哪些氢氧化铝的有关性质?了解到哪些氢氧化铝的有关性质?实验实验1结论:铝盐溶液能与碱溶液反应,结论:铝盐溶液能与碱溶液反应,生成氢氧化铝白色胶状沉淀。生成氢氧化铝白色胶状沉淀。实验实验2结论:氢氧化铝能与强碱反应结论:氢氧化铝能与
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 旅游行业虚拟现实与增强现实旅游体验方案
- 超市财务工作总结
- 乡村绿化与景观设计方案
- 产品设计与开发手册
- 防火防溺水安全知识进农村
- 隔离病房终末消毒流程
- 游戏行业防沉迷系统设计预案
- 浙江省杭州市滨江区杭二统考2024-2025学年高一上学期期末考语文试卷(原卷版+解析版)
- 静脉治疗在临床中的应用
- 初中地理模拟考试2025年:地理环境与可持续发展教育理念解读试题集
- 动脉穿刺置管术课件讲解
- 高校教师面试问题及答案
- 小学家长讲堂《脊柱健康小知识》
- 土的含水率试验烘干法(JTG34302020)
- 聚酰亚胺液晶高分子及液晶取向膜
- 2023年广东高职高考语文真题试卷及答案
- GB/T 6702-2022萘酸洗比色试验方法
- SC/T 3503-2000多烯鱼油制品
- GB/T 18109-2011冻鱼
- 医院各科室工作制度
- GA/T 1582-2019法庭科学视觉功能障碍鉴定技术规范

评论
0/150
提交评论