



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第二章第二章 稀薄溶液的依数性稀薄溶液的依数性基础化学基础化学Colligative Properties of Diluted Solution1221 溶液的蒸气压下降溶液的蒸气压下降一一. 蒸气压蒸气压 在一定温度下,在密闭容器中,一种液体在一定温度下,在密闭容器中,一种液体蒸发蒸发(evaporation) 与与凝结凝结(condensation)速率速率相等,气相和液相达到平衡相等,气相和液相达到平衡, 气相气相(gas phase)所具有的所具有的压力压力称为该温度下的称为该温度下的饱和蒸气压饱和蒸气压,简,简称称蒸气压蒸气压(vapor pressure) 。符号符号 p,单位,
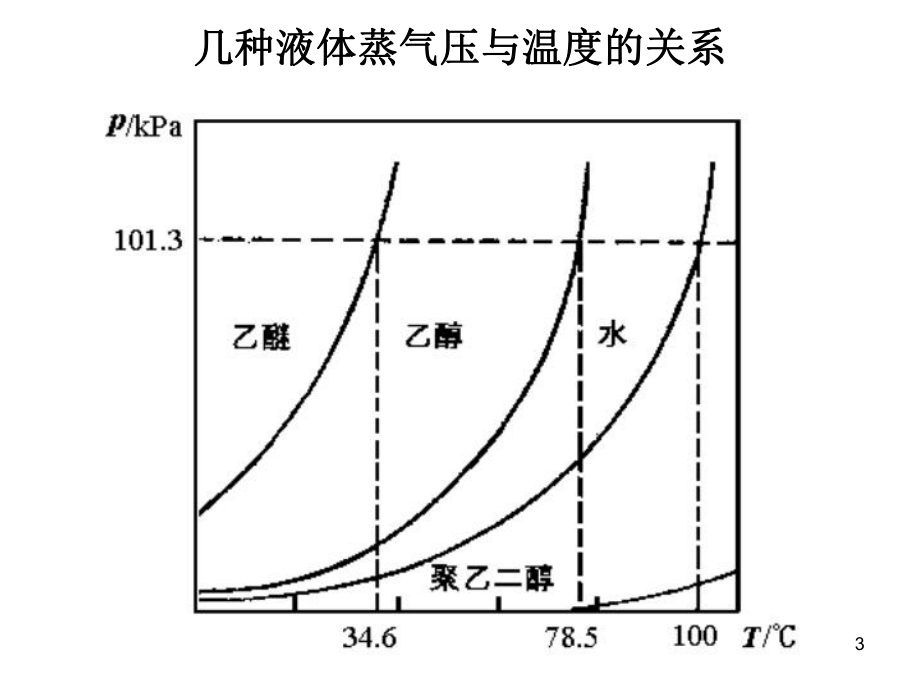
2、单位 Pa(帕帕), 或或 kPa (千帕千帕)。 温度的关系温度的关系 Vapor Pressure Lowering 3几种液体蒸气压与温度的关系几种液体蒸气压与温度的关系4二二. 溶液的蒸气压下降溶液的蒸气压下降5二二. 溶液的蒸气压下降溶液的蒸气压下降溶剂中加入难挥发性溶质后,液相中溶剂的溶剂中加入难挥发性溶质后,液相中溶剂的摩尔分数下降,液相与气相间的平衡向液相摩尔分数下降,液相与气相间的平衡向液相一边移动,导致溶剂的一边移动,导致溶剂的蒸气压下降蒸气压下降。溶液中难挥发性溶质浓度愈大,溶剂的摩尔溶液中难挥发性溶质浓度愈大,溶剂的摩尔分数愈小,蒸气压下降愈多。分数愈小,蒸气压下降愈多
3、。三、三、Raoult定律:定律:对于对于难挥发性难挥发性的的非电解质非电解质 稀稀 溶液,有如下规律:溶液,有如下规律: p = po xA Po 纯溶剂的蒸气压,纯溶剂的蒸气压, p 稀溶液溶剂的蒸气压,稀溶液溶剂的蒸气压, xA 溶液中溶剂的摩尔分数。溶液中溶剂的摩尔分数。6蒸气压下降公式的推导蒸气压下降公式的推导 溶液的蒸气压溶液的蒸气压:p = poxA = po ( 1- xB )稀溶液,稀溶液,nA远远大于远远大于nB , nA + nB nABAAABABBABBMMbmnnnnnnx 蒸气压下降蒸气压下降 p = po - p = poxB poMAbBp = K bB故故7
4、结论:结论:p = K bB 温度一定时,难挥发性非电解质稀溶温度一定时,难挥发性非电解质稀溶液的蒸气压下降与溶质的质量摩尔浓度液的蒸气压下降与溶质的质量摩尔浓度bB成正比,而与溶质的本性无关。成正比,而与溶质的本性无关。 8稀溶液的沸点升高和凝固点下降稀溶液的沸点升高和凝固点下降92 22 2 溶液的沸点升高和凝固点降低溶液的沸点升高和凝固点降低 一一. 溶液的沸点升高溶液的沸点升高 Boiling Point Elevation (一)一) 液体的液体的沸点沸点(boiling point) 液体的蒸气压等于外压时的温度液体的蒸气压等于外压时的温度。符号。符号b.p. 或或bp。液体的。液
5、体的正常沸点正常沸点是指外压为是指外压为101.3kPa时的沸点。时的沸点。 1. 不同物质,沸点不同。不同物质,沸点不同。 - 蒸馏(蒸馏(distillation) 2. 同一物质,不同外压时,沸点不同。同一物质,不同外压时,沸点不同。 - 减压蒸馏,加压消毒减压蒸馏,加压消毒 10(二)溶液的沸点升高溶剂中加入难挥发性溶质后,溶液的蒸气压下溶剂中加入难挥发性溶质后,溶液的蒸气压下降降, 要使溶液蒸气压等于外压,必须提高温度要使溶液蒸气压等于外压,必须提高温度。 沸点升高值沸点升高值Tb Tb = Tb - Tb0 = Kb bB Kb为溶剂沸点升高常数,它只与溶剂的本为溶剂沸点升高常数,
6、它只与溶剂的本性有关。不同溶剂,性有关。不同溶剂,Kb不同。不同。 结论:结论:难挥发性的非电解质稀溶液的沸点升难挥发性的非电解质稀溶液的沸点升高只与溶质的质量摩尔浓度有关,而与溶质高只与溶质的质量摩尔浓度有关,而与溶质的本性无关。的本性无关。 11二二. 溶液的凝固点降低溶液的凝固点降低 凝固点凝固点与与熔点熔点(melting point): 固相与液相平衡固相与液相平衡共存时的温度共存时的温度, 该温度下固相与液相蒸气压相等。该温度下固相与液相蒸气压相等。 凝固点与熔点两者的差异?凝固点与熔点两者的差异? 三相点:气、液、固三相平衡共存时的三相点:气、液、固三相平衡共存时的 温度。温度。
7、该温度下三相蒸气压相等该温度下三相蒸气压相等 冰点冰点:水的凝固点水的凝固点 凝固点降低的原因:溶液的蒸气压下降凝固点降低的原因:溶液的蒸气压下降 凝固点下降值:凝固点下降值: Tf = Tf0 Tf = Kf b B Freezing Point Depression12应用:应用:Kf :溶剂的凝固点降低常数。:溶剂的凝固点降低常数。Kf 只与只与 溶剂本性有关。溶剂本性有关。 1 . 测定溶质的相对分子质量测定溶质的相对分子质量 Tf = Kf b B = Kf(mB/MB)/mA MB = Kf mB /mATf 2. 抗凝剂抗凝剂: 汽车冷却水中加入甘油。汽车冷却水中加入甘油。 3.
8、 纯度检验纯度检验 存在杂质时,凝固点下降,存在杂质时,凝固点下降,Tf , 杂质杂质 ,纯度,纯度 。 Tf = Kf b B 132 23 3 溶液的渗透压力溶液的渗透压力渗透现象示意图渗透现象示意图142 23 3 溶液的渗透压力溶液的渗透压力一一. 渗透现象和渗透压力渗透现象和渗透压力半透膜半透膜 (semi-permeable membrane) 只允许溶剂分子透过而不允许溶质分子透只允许溶剂分子透过而不允许溶质分子透过的膜称过的膜称 半透膜半透膜。渗透压力渗透压力(osmotic pressure) 为了使渗透现象不发生,必须在溶液面上为了使渗透现象不发生,必须在溶液面上施加一超额
9、的压力称为施加一超额的压力称为渗透压力。渗透压力。152 23 3 溶液的渗透压力溶液的渗透压力产生渗透现象的两个必要条件:产生渗透现象的两个必要条件: 存在半透膜存在半透膜 半透膜两边存在渗透浓度差半透膜两边存在渗透浓度差渗透方向:渗透方向: 溶剂溶剂总是从浓度低的溶液总是从浓度低的溶液 ( 低渗液低渗液)向浓度向浓度高的溶液高的溶液 ( 高渗液高渗液)渗透渗透。注意注意:是是(而不是溶质)通过半透膜进行(而不是溶质)通过半透膜进行渗透。渗透。16二二. vant Hoff 公式公式 = cBRT cB 为物质的量浓度,为物质的量浓度, T为绝对温度。为绝对温度。R 为气体常数,为气体常数,
10、R= 8.314 JK-1mol-1。 表明稀溶液渗透压力的大小仅与单位体积表明稀溶液渗透压力的大小仅与单位体积溶液中溶质质点数的多少有关,而与溶质的本溶液中溶质质点数的多少有关,而与溶质的本性无关。性无关。 对稀溶液,对稀溶液,cBbB, 因此因此 bB RT 17二二. vant Hoff 公式公式 = cBRT 单位单位: cB R T (标准)(标准) molm-3 8.314 K Pa (常用)(常用) molL-1 8.314 K kPa (过去)(过去) molL-1 0.082 K atm 思考思考:(:(1)没有半透膜,没有半透膜,? (2)半透膜两边为不同浓度的溶液时?)半
11、透膜两边为不同浓度的溶液时? 18例例2-3 将将2.00g蔗糖蔗糖(C12H22O11)溶于水,配成溶于水,配成50.0 ml溶液,求溶液在溶液,求溶液在37时的渗透压力。时的渗透压力。11 -112212Lmol117. 0L0500. 0molg342g00. 2)OHC(Vnc = cB RT = 0.117 molL-18.314 JK -1 mol-1310 K =302 kPa (相当于相当于30.8米的水柱高的压力米的水柱高的压力) 解解C12H22O11的摩尔质量为的摩尔质量为342 gmol-1,则,则19Hypotonic watering of trees:The di
12、ssolved substances in tree sap create a more concentrated solution than the surrounding ground water. Water enters membranes in the roots and rises into the tree, creating an osmotic pressure that can exceed 2000 kPa in the tallest trees!20三三. 渗透压力在医学上的意义渗透压力在医学上的意义 电解质溶液的依数性的实验值比按非电解质电解质溶液的依数性的实验值比
13、按非电解质公式计算所得结果大。其原因,电解质溶液存公式计算所得结果大。其原因,电解质溶液存在解离,产生多质点。在解离,产生多质点。 实验结果表明,强电解质稀溶液的依数性,实验结果表明,强电解质稀溶液的依数性,沸点升高、凝固点降低和渗透压力的公式为沸点升高、凝固点降低和渗透压力的公式为 p = i Kb B Tb = i Kb b B Tf = i Kf b B = i cBRT i b B RT i 为为校正因子校正因子。( (一一) ) 电解质溶液的依数性电解质溶液的依数性21(二二)渗透浓度渗透浓度(osmolarity) 强电解质强电解质1:1型型(KCl、CaSO4、NaHCO3)和和
14、1:2型(如型(如MgCl2、Na2SO4等等)的校正因子的校正因子i分别分别约为约为2和和3。 溶液中产生渗透效应的溶质粒子溶液中产生渗透效应的溶质粒子(分子、离分子、离子子)统称为统称为渗透活性物质渗透活性物质。它们的总浓度称为。它们的总浓度称为渗透浓度渗透浓度。 医学上常用渗透浓度来比较溶液渗透压医学上常用渗透浓度来比较溶液渗透压力的大小,定义为力的大小,定义为渗透活性物质的物质的量渗透活性物质的物质的量除以溶液的体积除以溶液的体积,符号为,符号为cos,单位为,单位为molL-1或或mmolL-1。 22( (三三) )等渗、高渗和低渗溶液等渗、高渗和低渗溶液 正常人血浆的渗透浓度为正
15、常人血浆的渗透浓度为303.7 mmolL-1。 临床上规定:临床上规定: 280 320 mmolL-1 为为等渗溶液 (isotonic solution) cos320 mmolL-1 为为高渗溶液 (hypertonic solution) cos280 mmolL-1 为为低渗溶液 (hypotonic solution) 在临床治疗中,当为病人大剂量补液时,在临床治疗中,当为病人大剂量补液时,要特别注意补液的渗透浓度要特别注意补液的渗透浓度。23正常红细胞正常红细胞24 皱缩皱缩320 mmol/L 溶血溶血 320 mmol/L 溶血溶血 280 mmol/L 正常正常 280320 mmol/L2627( (五五) )晶体渗透压力和胶体渗透压力晶体渗透压力和胶体渗透压力晶体渗透压力晶体渗透压力(crystalloid osmotic pressure) 电解质、小分子物质产生的渗透压力电解质、小分子物质产生的渗透压力 (NaCl、KCl、葡萄糖、尿素、氨基酸等)、葡萄糖、尿素、氨基酸等
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- Ambari基础知识培训课件
- 安徽省滁州市九校联考2025届高三下学期第一次半月考数学试题含解析
- 南宁市兴宁区2024-2025学年六年级下学期模拟数学试题含解析
- 廊坊卫生职业学院《国际金融管理》2023-2024学年第二学期期末试卷
- 遵义医科大学医学与科技学院《药厂设备及车间工艺设计》2023-2024学年第二学期期末试卷
- 吉林省普通高中友好学校联合体2025年八校联考高考模拟数学试卷含解析
- 河北大学《商务英语写作(2)》2023-2024学年第二学期期末试卷
- 无锡南洋职业技术学院《建筑制图及CAD》2023-2024学年第二学期期末试卷
- 台州职业技术学院《田间统计与试验设计》2023-2024学年第二学期期末试卷
- 贵州省兴仁市凤凰中学2024-2025学年高三英语试题查缺补漏试题(文理)含解析
- 水资源的保护与管理
- 带状疱疹课件
- 高三数学二轮复习-解三角形课件
- 2024年人力资源社会保障部所属事业单位招聘考试真题
- 2024年山师附小招生简章
- 食堂7s管理标准
- 2024年河北衡水冀州区招聘社区工作者考试真题
- 2025年山西电力职业技术学院单招职业技能考试题库含答案
- 2024-2025学年人教版七下地理第一单元测验卷
- 稻田画种植合同5篇
- 共价键+周测卷 高二下学期化学选择性必修2

评论
0/150
提交评论