



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
…………○…………内…………○…………装…………○…………内…………○…………装…………○…………订…………○…………线…………○…………※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※…………○…………外…………○…………装…………○…………订…………○…………线…………○…………第=page22页,总=sectionpages22页第=page11页,总=sectionpages11页2025年人教版(2024)选择性必修2化学下册阶段测试试卷含答案考试试卷考试范围:全部知识点;考试时间:120分钟学校:______姓名:______班级:______考号:______总分栏题号一二三四五六总分得分评卷人得分一、选择题(共8题,共16分)1、键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是A.B.C.D.2、下列说法正确的是A.键的强度均大于键B.金属元素的电负性均小于1.8C.预测第八周期有32种元素D.第一电离能:3、科研人员研究发现SO3、HNO2、H2O等粒子参与雾霾粒中硫酸盐的生成过程。下列说法正确的是A.基态硫原子核外电子有9种不同运动状态B.SO3的空间构型是平面三角形C.反应过程中既有非极性键的断裂也有非极性键的形成D.HNO2中O-N-O键角为120°4、在CH3COCH3分子中,羰基(-CO-)碳原子与甲基(-CH3)碳原于成键时所采取的杂化方式分别为A.sp2杂化;sp3杂化B.sp3杂化;sp3杂化C.sp3杂化;sp2杂化D.sp2杂化;sp2杂化5、“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”,已知:Cu2++4NH3•H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂)。
下列有关分析错误的是A.该实验成功的重要条件是整套装置气密性良好B.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率C.[Cu(NH3)4]2+中存在极性共价键和配位键,N和H2O中O原子均采用sp3杂化D.H中出现浅黄色浑浊,证明O非金属性强于S6、我国科学家分别攻克了两大催化技术,使合成“液态阳光”的两个生产环节效率大幅提高。“液态阳光”的合成示意图如下。下列说法不正确的是。
A.甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键B.催化剂通过降低相应反应的活化能使化学反应速率增大C.理论上生成时,光催化过程至少转移电子D.作燃料时,充分燃烧消耗7、下列有关说法正确的是A.CS2为含极性键的极性分子B.MgO的熔点高于Na2O的熔点C.基态Cl原子核外有17种能量不同的电子D.N、O、P四种元素电负性最大的是N8、下列叙述正确的是()A.是基态原子的电子排布式B.铬原子的电子排布式是C.铜原子的价电子排布式是D.氮原子的电子排布图是评卷人得分二、填空题(共9题,共18分)9、(1)现有①金刚石②干冰③Na2SO4④NH4Cl⑤Ar五种物质;按下列要求回答:
晶体熔化时需要破坏范德华力的是__(填序号,下同);熔点最低的是___;晶体中只存在一种微粒作用力是__;属于离子晶体的是___。
(2)X2Cl2•2CO•2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“标出相应的配位键___。CO与N2分子的结构相似,则1molX2Cl2•2CO•2H2O含有σ键的数目为___。
10、I.美国科学家曾宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上述“结合力”的实质是_______(填标号)。
A.范德华力B.氢键C.非极性共价键D.极性共价键。
II.科学家发现;在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场;常温常压下水结成冰,俗称“热冰”,其模拟图如图所示:
采用弱电场使水结成“热冰”,说明水分子是_______(填“极性”或“非极性”)分子。请你展开想象,给“热冰”设计一个应用实例_______。
(2)用高能射线照射液态水时;一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是_______。
②水分子释放出电子时产生的阳离子具有较强的氧化性,试写出该阳离子与反应的离子方程式__________;该阳离子还能与水分子作用生成羟基,经测定反应后的水具有酸性,写出该过程的离子方程式____。11、填空。
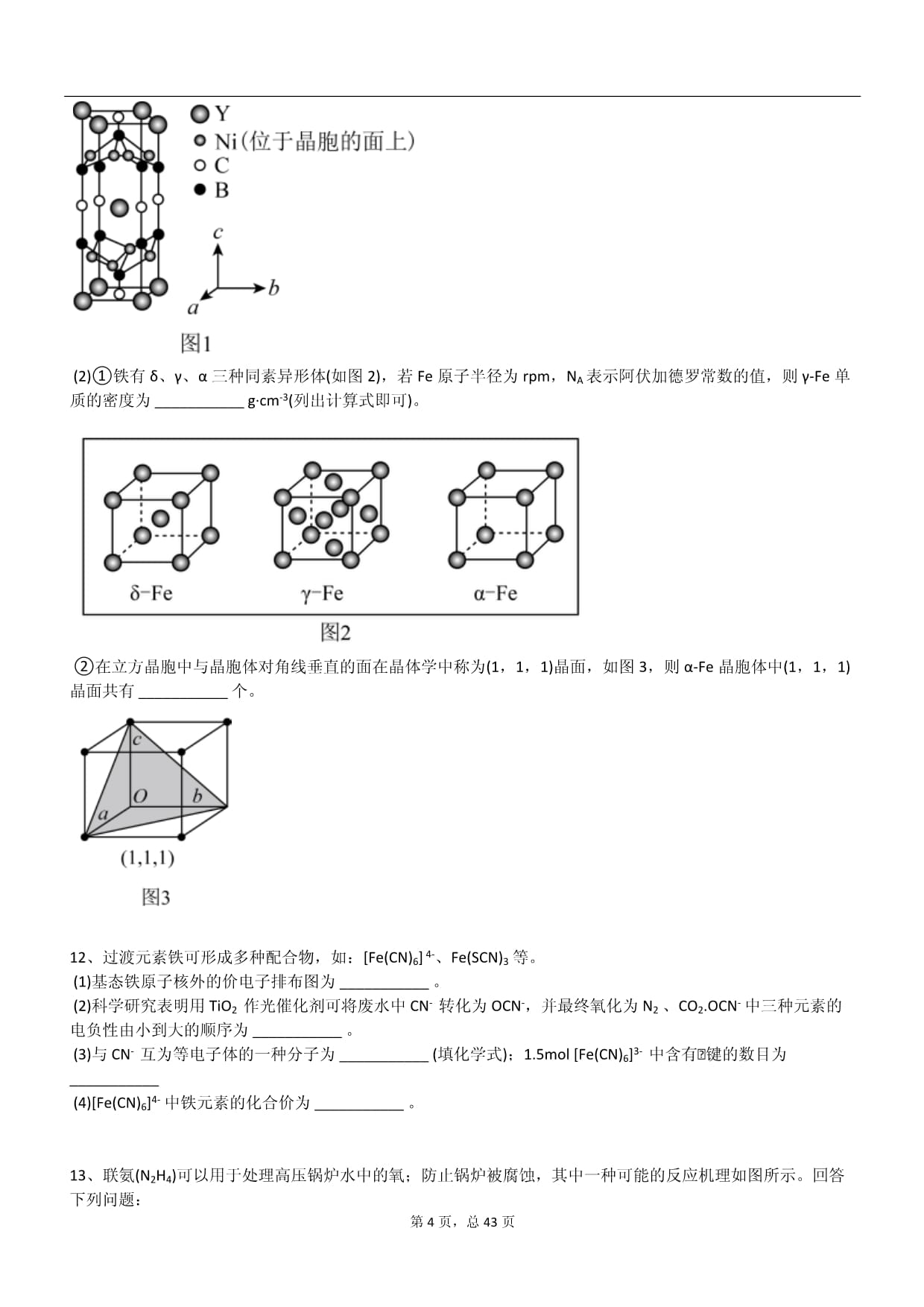
(1)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图1所示,则其化学式为___________。
(2)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则γFe单质的密度为___________g·cm-3(列出计算式即可)。
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,如图3,则αFe晶胞体中(1,1,1)晶面共有___________个。
12、过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)基态铁原子核外的价电子排布图为___________。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-,并最终氧化为N2、CO2.OCN-中三种元素的电负性由小到大的顺序为___________。
(3)与CN-互为等电子体的一种分子为___________(填化学式);1.5mol[Fe(CN)6]3-中含有键的数目为___________
(4)[Fe(CN)6]4-中铁元素的化合价为___________。13、联氨(N2H4)可以用于处理高压锅炉水中的氧;防止锅炉被腐蚀,其中一种可能的反应机理如图所示。回答下列问题:
(1)1molN2H4·H2O含σ键的数目为______。
(2)Cu2O与NH3·H2O反应能形成较稳定的的原因是____。
(3)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),原因是____。
(4)NaClO发生水解可生成HClO,HClO的空间构型是___,中心原子的杂化类型是___。14、回答下列问题:
(1)Cd与Zn同族且相邻,写出基态Cd原子的价层电子排布式:___________。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为___________。
(3)O和S处于同一主族,第一电离能较大的是___________。和分子中的键角较大的是___________,键长较短的是___________。单质硫与热的浓溶液反应的产物之一为的空间构型为___________。
(4)已知多个相邻且平行的p轨道重叠则形成大键,分子中的大键可用符号表示,其中代表参与形成大键的原子数,代表参与形成大键的电子数(如苯分子的大键可表示为)。吡咯()中所有原子共平面。则吡咯分子中的大键应表示为___________。吡咯分子中N原子的杂化类型为___________,1mol吡咯分子中含有___________键,噻吩的沸点为84℃,吡咯()的沸点在129-131℃之间,吡洛沸点较高,其原因是___________。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:则下列物质酸性由强到弱的顺序是___________(填序号)。A.B.C.D.(6)是离子晶体;其形成过程中的能量变化如图(a)所示。
可知,Li原子的第一电离能为_______键键能为_______15、萤石是一种具有良好透光性和较低折光率的材料,可用作紫外和红外的光学元件。下图为其晶胞,●代表Ca2+,○代表F-。请根据图示填空。
(1)该晶体类型为___,每个晶胞实际上有个_____Ca2+和_____个F-,晶体的化学式可表示为______。
(2)该晶体中每个F-周围同时吸引着_____个Ca2+
(3)设阿伏加德罗常数的值为NA,晶胞边长为anm,其晶体体积的为___________cm3,密度的计算表达式为___________g·cm-3(用上述字母的代数式)16、SiO2为何是原子晶体,原因是___________。17、如图为几种晶体或晶胞的结构示意图。
请回答下列问题:
(1)金刚石属于___________晶体,其中每个碳原子与___________个碳原子距离最近且相等;碘晶体属于___________晶体,每个碘晶胞中实际占有___________个碘分子,碘晶体熔化过程中克服的作用力为___________。
(2)这些晶体中,微粒之间以共价键结合而形成的是___________。
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为________________________。
(4)NaCl晶胞与MgO晶胞结构相同,NaCl晶体的熔点___________(填“大于”或“小于”)MgO晶体的熔点,原因是____________________________________________。
(5)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为则碘晶体的密度为___________评卷人得分三、判断题(共6题,共12分)18、判断正误。
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对____________
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构____________
(3)NH3分子为三角锥形,N原子发生sp2杂化___________
(4)只要分子构型为平面三角形,中心原子均为sp2杂化___________
(5)中心原子是sp1杂化的,其分子构型不一定为直线形___________
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数___________
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果___________
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道___________
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体___________
(10)AB3型的分子空间构型必为平面三角形___________
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构___________
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对___________
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键___________
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾___________
(15)配位键也是一种静电作用___________
(16)形成配位键的电子对由成键双方原子提供___________A.正确B.错误19、第ⅠA族金属元素的金属性一定比同周期的第ⅡA族的强。(_______)A.正确B.错误20、CH3CH2OH在水中的溶解度大于在水中的溶解度。(___________)A.正确B.错误21、判断正误。
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对____________
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构____________
(3)NH3分子为三角锥形,N原子发生sp2杂化___________
(4)只要分子构型为平面三角形,中心原子均为sp2杂化___________
(5)中心原子是sp1杂化的,其分子构型不一定为直线形___________
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数___________
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果___________
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道___________
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体___________
(10)AB3型的分子空间构型必为平面三角形___________
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构___________
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对___________
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键___________
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾___________
(15)配位键也是一种静电作用___________
(16)形成配位键的电子对由成键双方原子提供___________A.正确B.错误22、将丙三醇加入新制中溶液呈绛蓝色,则将葡萄糖溶液加入新制中溶液也呈绛蓝色。(____)A.正确B.错误23、用铜作电缆、电线,主要是利用铜的导电性。(______)A.正确B.错误评卷人得分四、实验题(共1题,共6分)24、铜的配合物广泛存在;对含铜配合物的研究一直是关注的热点。
Ⅰ.同学甲设计如下制备铜的配合物的实验Ⅰ:
已知:铜离子的配位数通常为4,呈深蓝色,呈深蓝色。
(1)硫酸铜溶液呈蓝色的原因是溶液中存在配离子___________(填化学式),配离子中配体的空间结构为___________,外界阴离子的空间结构___________
(2)结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因___________。
(3)由实验Ⅰ可得出以下结论:
结论1:配合物的形成与___________、___________有关;
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:___________>___________(填化学式)。
Ⅱ.同学乙查阅资料发现与在溶液中可以发生配位反应,生成配合物同学丙认为Cu(Ⅱ)有氧化性,与在溶液中可以发生氧化还原反应。
【资料】
ⅰ.(绿色),(无色);
ⅱ.(无色),遇空气容易被氧化成(蓝色);
ⅲ.易被氧化为或
实验Ⅱ:探究与溶液的反应。实验操作实验序号(mL)(mL)逐滴加入溶液时的实验现象a1.50.5溶液逐渐变为绿色,静置无变化b1.01.0溶液先变为绿色,后逐渐变成浅绿色,静置无变化溶液先变为绿色,后逐渐变成浅绿色,静置无变化c02.0溶液先变为绿色,后逐渐变浅至无色,静置无变化溶液先变为绿色,后逐渐变浅至无色,静置无变化(4)①丙同学认为实验Ⅱ可证明发生了氧化还原反应,他的理由是___________
②丙同学利用已知资料进一步确证了无色溶液中存在Cu(Ⅰ),他的实验方案是:取少量无色溶液,___________。
(5)经检验氧化产物以形式存在,写出与发生氧化还原反应得到无色溶液的离子方程式:___________。
(6)由实验Ⅱ可得出以下结论:
Cu(Ⅱ)盐与在溶液中的反应与多种因素有关,随的增大,___________。评卷人得分五、有机推断题(共4题,共36分)25、用N-杂环卡其碱(NHCbase)作为催化剂;可合成多环化合物。下面是一种多环化合物H的合成路线(无需考虑部分中间体的立体化学)。
回答下列问题:
(1)A的化学名称为_______。写出反应①的化学方程式:_______。
(2)反应②涉及两步反应,已知第一步反应类型为加成反应,第二步的反应类型为_______。
(3)E的结构简式为_______。
(4)D中官能团的名称是_______。
(5)化合物X是C的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式:_______。
(6)如果要合成H的类似物H'(),参照上述合成路线,写出相应的D'和G'的结构简式:_______、_______。H'分子中有_______个手性碳(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)。26、三唑并噻二嗪类化合物具有抗炎;抗肿瘤、抗菌的作用。该类新有机化合物G的合成路线如图所示。
已知:R1COOH+R2NH2R1CONHR2+H2O
(1)化合物B的名称为_______,化合物C的结构简式为_______。
(2)由E→F的化学方程式为_______。
(3)C、N、O三种元素第一电离能由大到小的顺序为_______。
(4)有机物H是B的同分异构体,则满足下列条件的H有_______种。
a.与FeCl3溶液反应显紫色b.能发生银镜反应c.分子中不含甲基。
(5)利用题中信息,设计以乙醇为原料制备另一种三唑并噻二嗪类化合物中间体P()的合成路线_______(无机试剂任选)。27、富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”;可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
回答下列问题:
(1)由A生成B的反应类型为___,反应的化学方程式为:___。
(2)由D生成E的反应类型为___,反应的化学方程式为:__。
(3)检验富血铁中是否含有Fe3+的实验所用的试剂是___。富血铁中存在的化学键有___。
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键。
(4)富马酸为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有___,___(写出结构简式,考虑立体异构)。28、化合物G是治疗高血压的药物“比索洛尔”的中间体;一种合成G的路线如下:
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰;峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1molNaOH或2molNa反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为_________________。
(4)由E生成F的反应类型为____________。评卷人得分六、原理综合题(共3题,共6分)29、A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大。A、C原子2p能级上均有两个未成对电子,EC2与BC2-为等电子体;D基态原子有11种运动状态的电子,F是第四周期未成对电子最多的原子。请回答下列问题:
(1)上述元素中第一电离能最大的是__(填元素符号)。A基态原子的电子排布式是__,E在周期表中的位置是第__周期__族。
(2)科学家成功地在高压下将AC2转化为具有空间立体网状结构的晶体,该晶体中A的杂化轨道类型是__。
(3)D+、AB-、F6+三种离子组成的化合物D3F(AB)6,其中化学键的类型有__,该化合物中存在一个复杂离子,该离子的化学式为__。
(4)“酒精检测仪”中有红色FC3和少量H2SO4,检测酒驾时反应的化学方程式为___。30、乙烯是重要的有机化学原料;工业上可利用乙烷脱氢制备乙烯。
(1)乙烷裂解为乙烯为自由基反应,其可能的引发反应及对应化学键的解离能如下:。可能的引发反应有关键的解离能(kJ/mol)C2H6(g)→C2H5·(g)+H·(g)410C2H6(g)→2CH3·(g)368
根据表格信息,乙烷裂解引发的反应主要为________________________。
(2)经过引发的后续反应历程为(已略去链终止过程):
ΔH1
ΔH2
①C2H4(g)+H2(g)→C2H6(g)的ΔH=________________________(用含ΔH1和ΔH2的式子表示)。
②上述历程中“”所代表的反应为____________________________________。
(3)CH3·中的单电子不能占据杂化轨道,则CH3·中碳原子的杂化方式为________________________。
(4)乙烷裂解中主要发生的反应及其在不同温度下的平衡常数如下表:。反应1100K1300K1500KI.C2H6C2H4+H21.618.972.0II.C2H6C2H4+CH460.9108.7165.8III.C2H4C2H2+H20.0150.333.2IV.C2H22C+H26.5×1071.5×1061.0×105
①当裂解反应达到平衡状态时,体系将会产生大量积碳。由表中数据分析,平衡时混合气体中____________(填化学式)的百分含量最大,原因是______________。
②为提高乙烯的产率,工业生产的适宜反应条件为______(填标号)。
A.高温 较长的反应时间B.高温 较短的反应时间。
C.低温 较长的反应时间D.低温 较短的反应时间。
③在某温度下投入molC2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为mmol、nmol、rmol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp____________(以分压表示,分压=总压物质的量分数)。
(5)工业上制备乙烯常使用Ni-Cr-Fe合金炉,某Ni-Cr-Fe合金的晶胞结构如图所示,表示Ni原子,表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中位置),则该合金可表示为__________(填化学式)。
31、氮、磷、砷锑铋镆为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置_______;的中子数为_______。
(2)已知:
由此推知,其中最稳定的磷单质是_______。
(3)氮、磷、砷锑铋镆电负性依次_______(增大或减小)。
(4)和与卤化氢的反应相似,产物的结构和性质也相似。下列对与反应产物的推断正确的是_______(填序号)。
a.不能与反应b.含离子键、共价键c.能与水反应。
(5)中配体分子以及分子的空间结构和相应的键角如图所示。
中P的杂化类型是_______;的键角小于的,分析原因_______。
(6)在1L真空密闭容器中加入amol固体;t℃时发生如下反应:
①
②
③
达平衡时,体系中则t℃时反应①的平衡常数K值为_______(用字母表示)。参考答案一、选择题(共8题,共16分)1、A【分析】【详解】
A.分子中键由氢原子的轨道和另一个氢原子的轨道以“头碰头”方式重叠形成;A正确;
B.分子中键由氢原子的轨道和原子的轨道以“头碰头”方式重叠形成;B错误;
C.分子中键由原子的轨道和另一个原子的轨道以“头碰头”方式重叠形成;C错误;
D.分子中键由F原子的轨道和另一个F原子的轨道以“头碰头”方式重叠形成;D错误;
故选A。2、D【分析】【详解】
A.大多数σ键比π键强度大;但是有个别反例,A错误;
B.金属元素的电负性一般小于1.8;非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗;锑等)的电负性则在1.8左右,B错误;
C.第八周期元素原子核外有8个电子层;根据排布规律,最后一种元素各层电子数为2;8、18、32、50、32、18、8,原子序数为168;第七周期元素原子核外有7个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、32、18、8,原子序数为118,则第八周期元素种类数为168-118=50,C错误;
D.同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能大于相邻元素,故第一电离能:D正确;
故选D。3、B【分析】【分析】
【详解】
A.原子核外没有两个运动状态完全相同的电子;有几个电子就有几种运动状态,硫原子核外有16个电子,所以有16种不同状态,A项错误;
B.SO3中含有3个键;孤电子对数是0,所以价层电子对数是3,空间构型为平面三角形,B项正确;
C.非极性键由同种原子构成;这些粒子中均没有非极性键,因此反应过程中无非极性键的断裂,C项错误;
D.HNO2中,N原子的价层电子对数为2+=3,为sp2杂化类型且有一个孤电子对;由于孤电子对对成键电子对的排斥作用,导致键角小于120°,D项错误;
故选B。4、A【分析】【分析】
【详解】
在CH3COCH3(丙酮)分子中,羰基碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化;A正确;
答案选A。5、B【分析】【分析】
装置B中稀硫酸与Zn反应生成氢气,生成的氢气将C中中液体压入D中,硫酸铜和Zn发生置换反应生成Cu单质后形成原电池,加快Zn与稀硫酸的反应速率,生成的氢气进入E中,将E中液体压入过量氨水中,发生Cu2++4NH3•H2O=4H2O+[Cu(NH3)4]2+;然后进入G中,催化双氧水的分解生成氧气,生成的氧气进入过量硫化氢溶液中发生氧化还原反应生成,装置I吸收尾气。
【详解】
A.该实验中要利用反应中气体产生的压力和虹吸作用;进行实验前必须进行的操作检验装置的气密性,一旦漏气实验失败,故A正确;
B.B与D两容器中比较;D中形成原电池后可以加快反应速率,故B错误;
C.[Cu(NH3)4]2+中氨气分子和铜离子之间形成配位键,氨气分子中存在氢原子和氮原子形成的极性共价键,氨气分子中的N原子的价层电子对数为4,H2O分子中O原子的价层电子对数也为4,均为sp3杂化;故C正确;
D.H中出现浅黄色浑浊说明氧气将硫化氢氧化成硫单质,说明氧化性O2>S;证明O非金属性强于S,故D正确;
综上所述答案为B。6、C【分析】【分析】
由合成示意图可知H2O在催化剂①和光照条件下生成H2,然后H2和CO2在催化剂②催化下生成甲醇。
【详解】
A.甲醇中存在醇羟基;能够形成氢键,所以甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键,A正确;
B.催化剂可以降低相应反应的活化能;使化学反应速率加快,B正确;
C.由示意图可知H2和CO2在催化剂②催化下生成甲醇,CO2的化合价由+4价降低到甲醇的-2价,理论上生成时,光催化过程至少转移电子;C错误;
D.根据CH3OH燃烧方程式2CH3OH+3O22CO2+4H2O,充分燃烧消耗的物质的量为1.5D正确;
故答案为:C。7、B【分析】【分析】
【详解】
A.由不同元素的原子形成的共价键是极性键,分子中正电中心和负电中心能重合的是非极性分子,CS2为直线形分子,所以CS2为含极性键的非极性分子;故A错误;
B.MgO、Na2O都是离子晶体,离子晶体的熔点高低的比较要看离子键的强弱,离子键越强,熔点越高,而离子键的强弱要看离子半径的大小和离子所带的电荷,离子半径越小和离子所带电荷越多,离子键越强,熔点越高,离子半径由大到小的顺序为:Na+>Mg2+,离子所带电荷:Mg2+>Na+,所以熔点由高到低的排序为MgO>Na2O;故B正确;
C.基态Cl原子核外有17个电子;有5个能级,同一能级上电子能量相同,故有5种能量不同的电子,故C错误;
D.同周期从左往右元素的电负性依次增大;同主族从下往上元素的电负性依次增大,故C;N、O、P四种元素电负性最大的是O,故D错误;
故选B。8、A【分析】【详解】
A.电子排布式[Ar]3d64s2符合能量最低原理,所以[Ar]3d64s2是基态原子的电子排布式;故A正确;
B.Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1;故B错误;
C.铜原子的价电子排布式是3d104s1,而不是3d94s2;故C错误;
D.基态氮原子核外电子总数为7,2p轨道3个电子各占据1个轨道,正确的电子排布图为故D错误;
故选A。
【点睛】
本题的易错点为BC,要注意洪特规则的应用,基态原子核外电子排布要满足能量最低原理,书写电子排布式时按照能层递增顺序书写。二、填空题(共9题,共18分)9、略
【分析】【分析】
【详解】
(1)分子晶体熔化时需要破坏范德华力,干冰和晶体Ar都属于分子晶体,所以晶体熔化时需要破坏范德华力的是②⑤;分子晶体的熔点与其相对分子质量成正比,相对分子质量越小,该分子晶体的熔点越低,干冰和Ar都属于分子晶体,Ar的相对分子质量小于二氧化碳,所以Ar的沸点最低,故选⑤;晶体中只存在一种微粒间作用力,说明该物质为原子晶体或单原子分子的分子晶体或只含离子键的离子晶体或金属晶体,金刚石为只含共价键的原子晶体,氩分子晶体是单原子分子,即一个分子仅由一个原子构成,分子之间只存在范德华力;属于离子晶体的是Na2SO4和NH4Cl;故答案为:②⑤;⑤;①⑤;③④;
(2)碳、氧均有孤对电子,形成配位键如图所示CO与N2分子的结构相似,则CO中含有1个σ键,则1molX2Cl2•2CO•2H2O含有σ键的物质的量为(2+4+8)mol=14mol,数目为14NA(或14×6.02×1023或8.428×1024),故答案为:14NA(或14×6.02×1023或8.428×1024)。【解析】①.②⑤②.⑤③.①⑤④.③④⑤.⑥.14NA(或14×6.02×1023或8.428×1024)10、略
【分析】【详解】
Ⅰ.由题给信息;在某种无线电波照射下,盐水可以释放出氢原子,说明水分子中的O-H被破坏,O-H键属于极性共价键,故选D;
Ⅱ.(1)在弱电场的条件下水变成“热冰”;水分子结构由无序变为有序,说明水分子中存在带正电和带负电的两部分,即水分子是极性分子;利用水分子的这一特点可建造室温溜冰场或室温条件下做冰雕;
(2)①水分子间能形成“网”的原因是水分子间存在氢键;
②水分子释放出电子时产生的阳离子是具有较强的氧化性,在反应中得电子,有还原性,在反应中失电子,反应的离子方程式是与反应后,呈酸性,并产生该过程的离子方程式是【解析】D极性极性建造室温溜冰场或室温条件下做冰雕水分子间存在氢键11、略
【分析】【详解】
(1)由图1可知Y原子数为8×+1=2,Ni原子位于晶胞面上,则原子数为8×=4,B原子位于棱上和体心,则原子数为8×+2=4,C原子位于棱上和面上,则原子数为4×+2×=2,所以四种原子数之比为1:2:2:1,化学式为YNi2B2C。
(2)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,γFe中一个晶胞中含有Fe的个数为8×+6×=4,晶胞质量m=56×4g,晶胞边长a与Fe的半径的关系为a=4r,所以a=2r,晶胞体积V=a3pm3=(2r×10-10)3cm3,晶体密度ρ=
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,该立方晶胞体中(1,1,1)晶面共有8个,如图所示①与3、6体对角线垂直的晶面是1、5、7和2、4、8,②与4、5体对角线垂直的晶面是2、6、8和1、3、7,③与1、8体对角线垂直的晶面是3、5、7和2、4、6,④与2、7体对角线垂直的晶面是4、6、8和1、3、5。【解析】(1)YNi2B2C
(2)812、略
【分析】【分析】
【详解】
(1)基态铁原子为26号元素,核外的价电子排布式为3d64s2,则价电子排布图为
(2)OCN-中三种元素为同周期元素;非金属性越强,则电负性越大,则电负性由小到大的顺序为C<N<O;
(3)与CN-含有相同原子个数,且价电子相等的微粒互为等电子体,其中属于分子为CO或N2;[Fe(CN)6]3-中含有6个配位键,6个C≡N微粒,则含有键的数目为12,1.5mol[Fe(CN)6]3-中含有键的数目为18NA;
(4)[Fe(CN)6]4-中含有6个CN-,微粒化合价的代数和为-4,则铁元素的化合价为+2。【解析】①.②.C<N<O③.CO或N2④.18NA⑤.+213、略
【分析】【分析】
(1)根据N2H4·H2O成键原理进行分析;(2)根据形成的结构特点进行判断;(3)根据氢键比较范德华力更强的性质进行解答;(4)根据杂化轨道理论进行分析解答;
【详解】
(1)N2H4·H2O分子含有1个N-N键、4个N-H键、2个O-H键,分子共含有7个σ键,所以1molN2H4·H2O含σ键的数目为7NA,故答案:7NA;
(2)Cu2O与NH3·H2O反应能形成较稳定的的原因是:NH3·H2O中NH3的N原子提供孤对电子与Cu+的空轨道形成配位键,故答案:NH3‧H2O中NH3的N原子提供孤对电子,与Cu+的空轨道形成配位键;(3)因为N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强,所以N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),故答案:N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强;(4)HClO的中心原子O原子孤电子对数==2,价层电子对数=2+2=4,HClO的空间构型为V形,O原子采取sp3杂化,故答案为:V形;sp3。【解析】①.7NA②.NH3‧H2O中NH3的N原子提供孤对电子,与Cu+的空轨道形成配位键③.N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强④.V形⑤.sp314、略
【分析】【详解】
(1)Cd与Zn同族且相邻,Zn的价电子排布式为3d104s2,则基态Cd原子的价层电子排布式为4d105s2。
(2)Si的价电子排布式为3s23p2,3s2上的两个电子自旋方向相反;自旋磁量子数的代数和为0,3p上的两个电子自旋方向相同,则自旋磁量子数的代数和为+1或-1。
(3)同主族元素从上到下,电子层数逐渐增多,对核外电子的引力逐渐减弱,所以第一电离能逐渐减小,所以O和S第一电离能较大的是O;H2O和H2S分子的中心原子均为sp3杂化,都有两个孤电子对,由于O的电负性比S大,所以O原子周围的电子较多,排斥力较大,键角较大,所以键角较大的是H2O;O原子的半径比S小,所以H2O中的键长比H2S中的键长短;中心原子的价电子对数=2+(6+2-2×2)=2+2=4;其VSEPR模型为四面体形,去掉两个孤电子对,其空间结构为V形。
(4)吡咯是平面结构,C原子和N原子均采取sp2杂化,C原子杂化后还剩一个未参加杂化的p轨道上的电子,N原子杂化后还剩余一对电子,所以吡咯分子中的大π键是5个原子共用6个电子形成的,表示为吡咯分子中有C-Cσ键;C-Nσ键、C-Hσ键和N-Hσ键;1mol吡咯分子中有10molσ键;吡咯分子中有N原子,N原子上连着H原子,可以形成分子间氢键,而噻吩不能形成分子间氢键,所以吡咯的沸点比噻吩高。
(5)根据吸电子效应的强度可知,−Cl>−C≡CH>−C6H5>−H,所以四种物质酸性由强到弱的顺序为B>C>D>A。
(6)第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所需吸收的最低能量,根据图示可知,Li原子的第一电离能为1040kJ/mol÷2=520kJ/mol;键能是拆开1mol共价键需要吸收的能量,根据图示可知,O=O键键能为249kJ/mol×2=498kJ/mol。【解析】(1)4d105s2
(2)+1或-1
(3)OH2OH2OV形。
(4)sp210吡咯分子间有氢键。
(5)BCDA
(6)52049815、略
【分析】【分析】
【详解】
(1)该晶体是由活泼金属Ca和活泼的非金属F形成的离子晶体,在该晶胞中Ca2+有8个在顶点,6个在面心,个数为:F-有8个在体内,个数为8,则该晶体的化学式为:CaF2,故答案为:离子晶体;4;8;CaF2;
(2)由晶胞的结构可知每个F-与周围的四个Ca2+形成四面体结构;故答案为:4;
(3)晶胞边长为anm,晶胞的体积为a3nm3=a3×10-21cm3,晶胞的质量=故答案为:【解析】①.离子晶体②.4③.8④.CaF2⑤.4⑥.a3×10-21⑦.16、略
【分析】【详解】
Si原子与O原子以共价键相互结合形成空间网状结构,所以SiO2为原子(共价)晶体。【解析】Si原子与O原子以共价键相互结合形成空间网状结构17、略
【分析】【分析】
【详解】
(1)金刚石晶体中原子间以共价键结合形成空间网状结构,则金刚石晶体属于共价晶体,其中每个碳原子与4个碳原子距离最近且相等;碘晶体熔沸点低,属于分子晶体,每个碘晶胞中实际占有的碘分子个数是=4;碘晶体是分子晶体,熔化过程中克服的作用力为分子间作用力。
(2)冰晶体和碘晶体是分子晶体;铜形成的是金属晶体,氧化镁和氯化钙形成的是离子晶体,金刚石形成的共价晶体,因此这些晶体中,微粒之间以共价键结合而形成的是金刚石晶体。
(3)熔点的一般规律:共价晶体>离子晶体>分子晶体;冰和碘属于分子晶体,熔点:碘>冰,MgO属于离子晶体,金刚石是共价晶体,则冰;金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为:金刚石>MgO>碘单质>冰;
(4)由于MgO晶体中离子所带的电荷数大于NaCl晶体中离子所带的电荷数,且晶格能前者大于后者,所以NaCl晶体的熔点小于MgO晶体的熔点。
(5)碘晶胞中实际占有的碘分子个数是=4,碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为则碘晶体的密度为【解析】①.共价②.4③.分子④.4⑤.分子间作用力⑥.金刚石晶体⑦.金刚石碘单质>冰⑧.小于⑨.MgO晶体中离子所带的电荷数大于NaCl晶体中离子所带的电荷数,且⑩.三、判断题(共6题,共12分)18、B【分析】【分析】
【详解】
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;正确;
(2)分子中中心原子若通过sp3杂化轨道成键;则该分子正四面体结构或三角锥形或折线形,错误;
(3)NH3分子为三角锥形,N原子发生sp3杂化;错误;
(4)只要分子构型为平面三角形,中心原子均为sp2杂化;正确;
(5)中心原子是sp1杂化的;其分子构型一定为直线形,错误;
(6)价层电子对互斥理论中;π键电子对数不计入中心原子的价层电子对数,正确;
(7)PCl3分子是三角锥形,这是因为P原子是以sp3杂化的结果且没有孤电子对;错误;
(8)sp3杂化轨道是由中心原子的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道;错误;
(9)凡中心原子采取sp3杂化的分子;其VSEPR模型都是四面体,正确;
(10)AB3型的分子空间构型为平面三角形或平面三角形;错误;
(11)分子中中心原子通过sp3杂化轨道成键时;该分子正四面体结构或三角锥形或折线形,正确;
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;正确;
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键;正确;
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果不矛盾;错误;
(15)配位键也是一种静电作用;正确;
(16)形成配位键的电子对由一个原子提供,另一个原子提供空轨道,错误。19、A【分析】【详解】
同周期从左到右;金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性变弱;故第ⅠA族金属元素的金属性一定比同周期的第ⅡA族的强。
故正确;20、A【分析】【分析】
【详解】
乙醇中的羟基与水分子的羟基相近,因而乙醇能和水互溶;而苯甲醇中的烃基较大,其中的羟基和水分子的羟基的相似因素小得多,因而苯甲醇在水中的溶解度明显减小,故正确。21、B【分析】【分析】
【详解】
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;正确;
(2)分子中中心原子若通过sp3杂化轨道成键;则该分子正四面体结构或三角锥形或折线形,错误;
(3)NH3分子为三角锥形,N原子发生sp3杂化;错误;
(4)只要分子构型为平面三角形,中心原子均为sp2杂化;正确;
(5)中心原子是sp1杂化的;其分子构型一定为直线形,错误;
(6)价层电子对互斥理论中;π键电子对数不计入中心原子的价层电子对数,正确;
(7)PCl3分子是三角锥形,这是因为P原子是以sp3杂化的结果且没有孤电子对;错误;
(8)sp3杂化轨道是由中心原子的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道;错误;
(9)凡中心原子采取sp3杂化的分子;其VSEPR模型都是四面体,正确;
(10)AB3型的分子空间构型为平面三角形或平面三角形;错误;
(11)分子中中心原子通过sp3杂化轨道成键时;该分子正四面体结构或三角锥形或折线形,正确;
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;正确;
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键;正确;
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果不矛盾;错误;
(15)配位键也是一种静电作用;正确;
(16)形成配位键的电子对由一个原子提供,另一个原子提供空轨道,错误。22、A【分析】【详解】
葡萄糖是多羟基醛,与新制氢氧化铜反应生成铜原子和四个羟基络合产生的物质,该物质的颜色是绛蓝色,类似于丙三醇与新制的反应,故答案为:正确。23、A【分析】【详解】
因为铜具有良好的导电性,所以铜可以用于制作电缆、电线,正确。四、实验题(共1题,共6分)24、略
【分析】【分析】
Ⅰ.浑浊液中存在溶解平衡,加入NH3•H2O后形成[Cu(NH3)4]2+的深蓝色溶液;NaOH的浓度小,依然是浑浊液;NaOH的浓度较大时生成深蓝色配离子为[Cu(OH)4]2-;c中加入与a中加入的NaOH相同浓度的NH3•H2O,就生成了深蓝色配离子为[Cu(NH3)4]2+,试管b中的深蓝色配离子为[Cu(OH)4]2-加入氨水可以转化为c中深蓝色配离子为[Cu(NH3)4]2+。
(1)
水合铜离子显蓝色,其中的配离子为[Cu(H2O)4]2+;配体H2O分子的价层电子对数=2+=4,VSEPR模型为四面体结构,去掉孤电子对数后,分子的空间构型为V形;外界阴离子的价层电子对数=4+=4+0=4,VSEPR模型为四面体结构,没有孤电子对,则分子的空间构型为正四面体形,故答案为:[Cu(H2O)4]2+;V;正四面体形;
(2)
Cu2++2OH-=Cu(OH)2↓,Cu(OH)2的浑浊液中存在溶解平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),加入NH3•H2O后Cu2+与NH3配位形成配离子[Cu(NH3)4]2+,则c(Cu2+)降低,使得Cu(OH)2的溶解平衡正向移动,Cu(OH)2生成深蓝色的[Cu(NH3)4]2+配离子,故答案为:浑浊液中存在平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),加入NH3•H2O后Cu2+与NH3配位形成[Cu(NH3)4]2+,c(Cu2+)降低;使得平衡正向移动,浑浊液转变为深蓝色溶液;
(3)
试管a加入1mol/L的NaOH,NaOH的浓度小,依然是浑浊液;而试管b加入6mol/L的NaOH,NaOH的浓度较大时生成深蓝色配离子为[Cu(OH)4]2-,是由于NaOH的浓度不同造成的现象不同,即配体的浓度也不同造成的;试管a加入1mol/L的NaOH时依然是浑浊液;而c中加入相同浓度的NH3•H2O,就生成了深蓝色配离子为[Cu(NH3)4]2+,是由于配体OH-离子和NH3的种类不同而造成的;所以配合物的形成与配体的浓度、配体的种类有关;向生成[Cu(OH)4]2-蓝色配离子的溶液中加入氨水的溶液碱性增强,说明生成蓝色配离子为[Cu(NH3)4]2+,所以试管b、c中深蓝色配离子的稳定性强弱顺序为[Cu(NH3)4]2+>[Cu(OH)4]2-,故答案为:配体的浓度;配体的种类;[Cu(NH3)4]2+;[Cu(OH)4]2-;
(4)
①通过CuSO4与Na2S2O3溶液反应的现象,由实验a到实验c,Na2S2O3溶液浓度越大,最终溶液颜色越来越浅,最后生成的是无色的[Cu(S2O3)2]3-,即发生了氧化还原反应,故答案为:由实验a到实验c,Na2S2O3溶液浓度越大;最终溶液颜色越来越浅,说明发生了氧化还原反应;
②根据资料:2NH3+Cu+⇌[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);若无色溶液中存在Cu(Ⅰ),加入氨水,先呈无色,后变为蓝色,故实验方案为:取少量无色溶液,向其中加入氨水,放置在空气中,若溶液变为蓝色,则说明含有Cu(Ⅰ),故答案为:向其中加入氨水,放置在空气中,若溶液变为蓝色,则说明含有Cu(Ⅰ);
(5)
Cu2+与发生氧化还原反应得到无色溶液,生成和[Cu(S2O3)2]3-,离子方程式为:2Cu2++6=+2[Cu(S2O3)2]3-,故答案为:2Cu2++6=+2[Cu(S2O3)2]3-;
(6)
结合分析,可以获得结论:①随n():n(Cu2+)的增大,二者发生络合反应的趋势减弱,发生氧化还原反应的趋势增强,②Cl-易于Cu+生成CuCl,Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+与发生氧化还原反应的趋势,故答案为:二者发生络合反应的趋势减弱,发生氧化还原反应的趋势增强;Cl-易于Cu+生成CuCl,Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+与发生氧化还原反应的趋势。【解析】(1)[Cu(H2O)4]2+V正四面体形。
(2)浑浊液中存在平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),加入NH3•H2O后Cu2+与NH3配位形成[Cu(NH3)4]2+,c(Cu2+)降低;使得平衡正向移动,浑浊液转变为深蓝色溶液。
(3)配体的浓度配体的种类[Cu(NH3)4]2+[Cu(OH)4]2-
(4)由实验a到实验c,Na2S2O3溶液浓度越大;最终溶液颜色越来越浅,说明发生了氧化还原反应取少量无色溶液,向其中加入氨水,放置在空气中,若溶液变为蓝色,则说明含有Cu(Ⅰ),故答案为:向其中加入氨水,放置在空气中,若溶液变为蓝色,则说明含有Cu(Ⅰ)
(5)2Cu2++6=+2[Cu(S2O3)2]3-
(6)二者发生络合反应的趋势减弱,发生氧化还原反应的趋势增强;Cl-易于Cu+生成CuCl,Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+与发生氧化还原反应的趋势五、有机推断题(共4题,共36分)25、略
【分析】【分析】
由合成路线,A的分子式为在Cu作催化剂的条件下发生催化氧化生成B,B的结构简式为则A为B与发生加成反应生成再发生消去反应生成C,C的结构简式为C与发生加成反应得到再在碱性条件下发生消去反应生成D,D为B与E在强碱的环境下还原得到F,E的分子式为F的结构简式为可推知E为F与反应生成G;G与D反应生成H,据此分析解答。
(1)
由分析可知,A的结构简式为其化学名称为苯甲醇;反应①的化学方程式:
(2)
由B、C的结构简式,结合反应条件,可知B()先与发生碳氧双键的加成反应生成再发生消去反应生成C();故第二步的反应类型为消去反应;
(3)
由分析可知,E的结构简式为
(4)
D的结构简式为其分子中含有的官能团为碳碳双键;碳溴键和醛基;
(5)
C的结构简式为分子式为其同分异构体X可发生银镜反应,说明含有醛基,又与酸性高锰酸钾反应后可得到对苯二甲酸,则X的取代基处于苯环的对位,满足条件的X的结构简式为
(6)
G与D反应生成H的反应中,D中碳碳双键断裂与G中和成环,且与成环,从而得到H,可推知,若要合成(),相应的为为手性碳原子为连有4个不同基团的饱和碳原子,则()的手性碳原子为共5个。【解析】(1)苯甲醇
(2)消去反应。
(3)
(4)碳溴键;碳碳双键、醛基。
(5)
(6)526、略
【分析】【分析】
根据B,D的结构、结合C的分子式可知:B转化成C发生取代反应,C的结构为
欲以乙醇为原料制备P(),则需2个引入肽键,第一个肽键的引入可仿照流程中A→B→C,即与乙醇先发生酯化反应得到与H2NNH2发生取代反应得到与发生信息反应生成第2个肽键得到目标产物
【详解】
(1)苯甲酸和乙醇发生酯化反应得到苯甲酸乙酯,则化合物B的名称为苯甲酸乙酯,据分析化合物C的结构简式为
(2)E→F的反应,即与BrCH(CN)2发生取代反应生成和HBr,化学方程式为+BrCH(CN)2→+HBr。
(3)同周期从左到右元素的第一电离能呈增大趋势,因为氮原子的价电子排布式2s22p3;p能级半充满,比较稳定,N的第一电离能大于O,C;N、O三种元素第一电离能由大到小的顺序为N>O>C。
(4)有机物H是B的同分异构体;满足下列条件:
a.与FeCl3溶液反应显紫色b.能发生银镜反应c.分子中不含甲基;则含有醛基和酚羟基,为苯环上含有一个羟基和一CH2CH2CHO;则满足条件的H有邻间对三种结构,即H有3种。
(5)据分析,以乙醇为原料制备P()的合成路线为:【解析】(1)苯甲酸乙酯
(2)+BrCH(CN)2→+HBr
(3)N>O>C
(4)3
(5)27、略
【分析】【分析】
环己烷与氯气发生取代反应生成B,B在氢氧化钠的醇溶液中发生消去反应生成环己烯,可知B是一氯环己烷,环己烯和溴的四氯化碳溶液发生加成反应生成D,D是1,2-二氯环己烷;酸化得到富马酸,富马酸的结构简式是
【详解】
(1)环己烷与氯气在光照条件下发生取代反应生成反应类型为取代反应,反应的化学方程式为+Cl2+HCl;
(2)D是在氢氧化钠的醇溶液中发生消去反应生成反应类型为消去反应,反应的化学方程式为+2NaOH+2NaBr+2H2O;
(3)Fe3+遇KSCN溶液变红色,苯酚与Fe3+发生显色反应,检验富血铁中是否含有Fe3+所用的试剂是KSCN溶液或苯酚溶液。Fe2+和反应生成可知富血铁是离子化合物,存在的化学键有离子键;共价键、σ键、π键,选ABEF;
(4)为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有【解析】取代反应+Cl2+HCl消去反应+2NaOH+2NaBr+2H2OKSCN溶液或苯酚溶液BCEF28、略
【分析】【分析】
A的分子式为C2H4O,且核磁共振氢谱为单峰,说明A中氢原子环境相同,只含有一种H,则A的结构简式为B的分子式为核磁共振氢谱为三组峰,峰面积比为6∶1∶1,说明B中含有3种H,且三种H的个数比为6∶1∶1,则B的结构简式为D的分子式为C7H8O2,且含有苯环,1molD可与1molNaOH或2molNa反应,则D中含有2个羟基,且其中一个为酚羟基(与NaOH反应),苯环上仅有两种不同化学环境的氢,可推断出其结构简式为:C和D发生取代反应生成E:E在碱性条件下发生取代反应生成F,由G的结构简式可推出
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 中医养生课件
- 中专红色文化课件图片
- 共享共赢汽车租赁合同
- 管理外包合同
- 高端住宅委托代理合同
- 《会计信息系统》全套教学课件
- 塑钢门窗设计与施工合同
- 六安职业技术学院《环境基础化学》2023-2024学年第二学期期末试卷
- 辽宁朝阳市普通高中2025届高三下学期第二次段考历史试题试卷含解析
- 山东省青岛市58中2025届高三高考模拟试卷(二)物理试题含解析
- 《纺织材料生产》课件-项目7:短纤工段
- 提水试验过程及数据处理
- 城市供水企业(用氯)安全检查表
- 《口腔基础医学概要》课件-口腔的功能
- 枣桃小食心虫的发生与防治
- 悯农-幼儿园通用课件
- 米兰大教堂完整版本
- 失能老人消防应急预案
- CONSORT2010流程图(FlowDiagram)【模板】文档
- 国际经济与贸易-关于阿里巴巴国际站RTS频道外贸新机遇的研究
- 切片机安全操作保养规程

评论
0/150
提交评论