



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
2024年10月25日第12章分光光度法12.1概述
12.1.1定义分光光度法是基于物质对光的选择性吸收而建立起来的分析方法,包括比色法、可见及紫外分光光度法及红外光谱法等。本章重点讨论可见光区的分光光度法。2024年10月25日12.1.2分光光度法的特点
a灵敏度高。常用于测定试样中质量分数为1%~10-5的微量组分,甚至可测定低至质量分数为10-6~10-8的痕量组分。
b准确度较高。目视比色法的相对误差为5%~10%,分光光度法为2%~5%。
c应用广泛。几乎所有的无机离子和许多有机化合物都可以直接或间接地用目视比色法或分光光度法进行测定。
d仪器简单、操作简便、快速。2024年10月25日12.1.3溶液的颜色与光吸收的关系
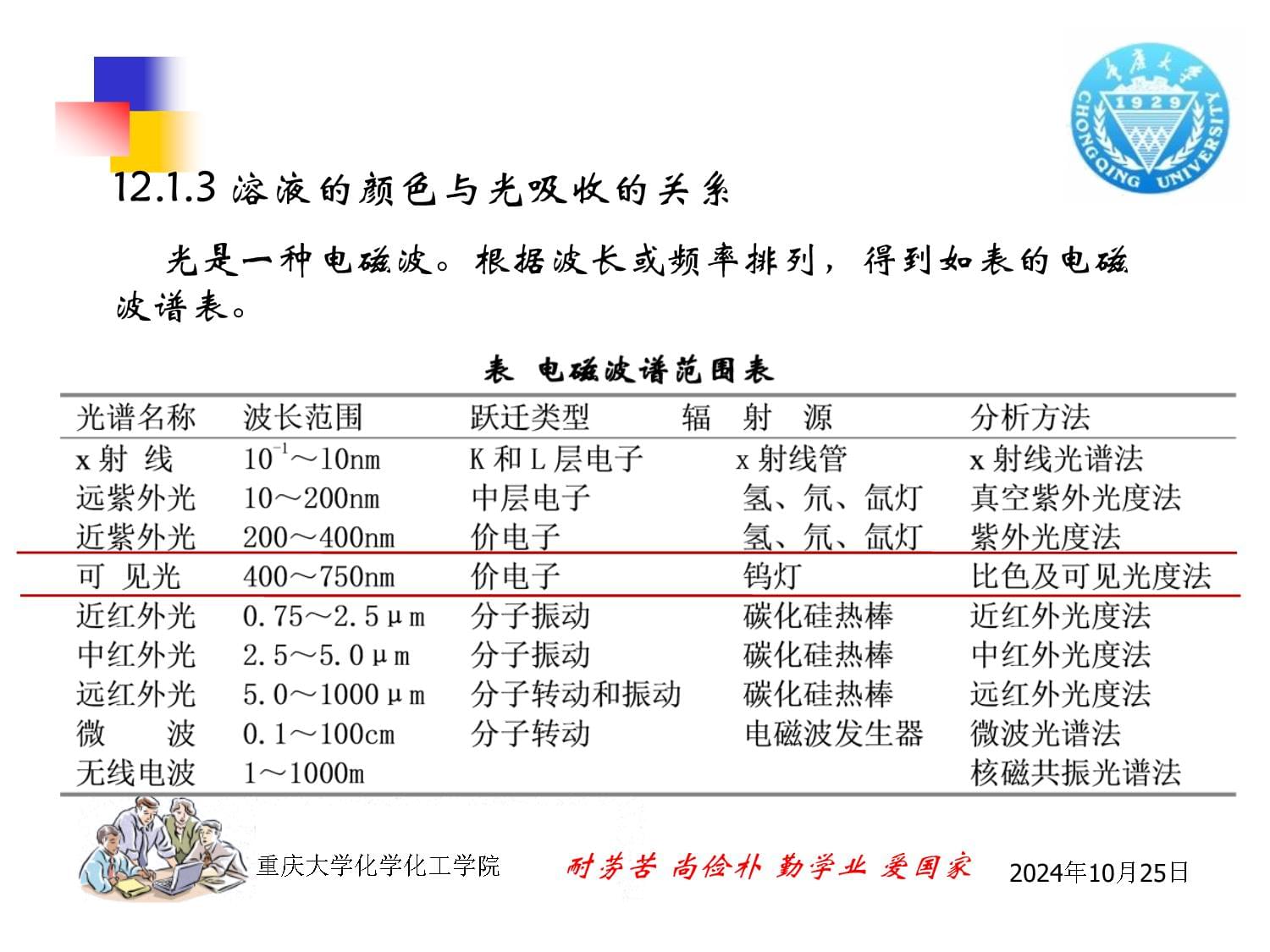
光是一种电磁波。根据波长或频率排列,得到如表的电磁波谱表。
2024年10月25日相关概念*吸收光谱:原子吸收光谱和分子吸收光谱。是因物质对不同波长的光具有选择性吸收作用而产生的。*单色光:具同一波长的光。*复合光:由不同波长组成的光。*波段:各种色光的波长范围不同。2024年10月25日*互补色光:按一定比例混合,得到白光。*物质的颜色是因物质对不同波长的光具有选择性吸收作用而产生的。2024年10月25日*吸收光谱曲线或光吸收曲线:以波长为横坐标,吸光度为纵坐标作图。*最大吸收波长:光吸收程度最大充处的波长,用λmax表示。*吸光度A(也称消光度E或光密度D):溶液对光的吸收程度。2024年10月25日
在可见光,KMnO4溶液对波长525nm附近绿色光的吸收最强,而对紫色和红色的吸收很弱。λmax=525nm。
浓度不同时,光吸收曲线形状相同,λmax不变,吸光度不同。2024年10月25日12.2光吸收基本定律12.2.1朗伯-比尔定律当一束平行单色光通过任何均匀、非散射的固体、液体或气体介质时,一部分被吸收,一部分透过介质,一部分被器皿的表面反射。如图所示,设入射光强度为I0,吸收光强度为Ia,透过光强度为It,反射光强度为Ir。2024年10月25日
在分光光度分析法中,试液和空白溶液分别置于同样质料及厚度的吸收池中,然后让强度为I0的单色光分别通过这两个吸收池,再测量其透过光的强度。此时反射光强度基本上是不变的,且其影响可以相互抵消。透光度或透光率透过光强度It与入射光强度Io之比称为透光度或透光率,用T表示溶液的透光度愈大,表示它对光的吸收愈小;相反,透光度愈小,表示它对光的吸收愈大。2024年10月25日
朗伯(LambertJH)和比尔(BeerA)分别于1760和1852年研究了光的吸收与溶液层的厚度及溶液浓度的定量关系,二者结合称为朗伯-比尔定律,也称为光的吸收定律。
当一束强度为I0的平行单色光垂直照射到长度为b的液层、浓度为c的溶液时,由于溶液中吸光质点(分子或离子)的吸收,通过溶液后光的强度减弱为I:定量分析的理论基础。2024年10月25日比例常数K与吸光物质的性质、入射光波长及温度等因素有关。含有多种吸光物质的溶液,如果各吸光物质对某一波长的单色光均有吸收作用,且各吸光物质的吸光质点之间相互不发生化学反应,则:这一规律称吸光度的加和性。2024年10月25日*摩尔吸收系数当浓度c用mol·L-1,液层厚度b用cm为单位表示,则K用另一符号ε来表示。ε称为摩尔吸收系数,单位为L·mol-l·cm-1,它表示物质的量浓度为lmol·L-1,液层厚度为lcm时溶液的吸光度。12.2.2摩尔吸收系数和桑德尔灵敏度2024年10月25日
例浓度为25.5μg/50mL的Cu2+溶液,用双环已酮草酰二腙光度法测定,在波长600nm处用2cm比色皿测量A=0.297,计算摩尔吸光系数。解:2024年10月25日*桑德尔(Sandell)灵敏度(灵敏度指数)S
指当仪器的检测极限A=0.001时,单位截面积光程内所能检测出来的吸光物质的最低含量,其单位为μg·cm-2,S与ε及吸光物质摩尔质量M的关系为:桑德尔灵敏度越小,表示显色反应越灵敏。2024年10月25日12.3光度分析的方法和仪器12.3.1目视比色法用眼睛观察、从管口垂直向下观察(比色管),比较待测溶液和标准溶液颜色的深浅,以确定物质含量的方法。
优点是仪器简单,操作简便,适宜于大批试样的分析。灵敏度高,因为是在复合光-白光下进行测定,故某些显色反应不符合朗伯-比尔定律时,仍可用该法进行测定。主要缺点是准确度不高,标准系列不能久存,需要在测定时临时配制。2024年10月25日12.3.2标准曲线法
借助分光光度计来测量一系列标准溶液的吸光度,绘制标准曲线,根据被测试液的吸光度,从标准曲线上求得被测物质的浓度或含量。12345样品标液C1C2C3C4C5CXAA1A2A3A4A5AX
特点:入射光是纯度较高的单色光,故使偏离朗伯-比尔定律的情况大为减少,标准曲线直线部分的范围更大,分析结果的准确度较高。AλCXAX2024年10月25日
12.3.3比较法:在一定条件下,配制标准溶液和样品溶液,在λmax下测A
标准溶液As=εCsL
被测溶液Ax=εCxLCx=CsAx/As
注意:Cs与Cx大致相当2024年10月25日
1为选好的测定波长,一般为待测物质的max
2为选好的参比波长,一般为待测物质的min测得的是样品在两种波长1和2处的吸光度之差A,A为扣除了背景吸收的吸光度
A=A1-A2=(ε1-ε2)CL优点:(1)大大提高了测定准确度,可完全扣除背景(2)可用于微量组分的测定(3)可用于混浊液和多组分混合物的定量测定12.3.4扣除法2024年10月25日EFAλλ1测λ2
参ab12.3.5多组分定量方法由于吸光度具有加合性,因此可以在同一试样中测定多个组份。设X,Y组份在波长
1
和
2
处的摩尔吸光系数
可由已知浓度的X,Y纯溶液测得。解上述方程组可求得cx
及cy。2024年10月25日12.3.6分光光度计及其基本部件分光光度计的基本部件:光源、单色器、样品池(比色皿)、检测器和显示装置。光源单色器样品池检测器显示装置2024年10月25日*光源光源的作用是提供辐射--连续复合光可见光区钨灯320-2500nm
优点:发射强度大、使用寿命长紫外光区氢灯或氘灯180-375nm氘灯的发射强度比氢灯大4倍
玻璃对这一波长有强吸收,必须用石英光窗。紫外-可见分光光度计同时具有可见和紫外两种光源。2024年10月25日*单色器
单色器的作用是将光源发出的连续光谱分解为单色光的装置。分为棱镜和光栅。
*比色皿也称吸收池或样品池。用于盛放试液的容器。它是由无色透明、耐腐蚀、化学性质相同、厚度相等的玻璃或石英制成,按其厚度分为0.5cm,lcm,2cm,3cm和5cm。使用比色皿时应注意保持清洁、透明,避免磨损透光面。紫外光只能用石英比色皿;
可见光可用石英或玻璃比色皿。2024年10月25日*检测器接受从比色皿发出的透射光并转换成电信号进行测量。分为光电管和光电倍增管。*显示装置
作用是把放大的信号以吸光度A或透射比T的光度分析法的设计方式显示或记录下来。分光光度计常用的显示装置是检流计、微安表、数字显示记录仪。2024年10月25日12.4显色反应和显色条件12.4.1显色反应待测物质本身有较深的颜色,直接测定;待测物质是无色或很浅的颜色,需要选适当的试剂与被测离子反应生成有色化合物再进行测定,此反应称为显色反应,所用的试剂称为显色剂。
按显色反应的类型来分,主要有氧化还原反应和络合反应两大类,而络合反应是最主要的。2024年10月25日(1)显色反应的选择A选择性好,干扰少,或干扰容易消除;灵敏度高,有色物质的ε应大于104。B有色化合物的组成恒定,符合一定的化学式。C有色化合物的化学性质稳定,至少保证在测量过程中溶液的吸光度基本恒定。这就要求有色化合物不容易受外界环境条件的影响。D有色化合物与显色剂之间的颜色差别要大,即显色剂对光的吸收与络合物的吸收有明显区别,要求两者的吸收峰波长之差Δλ(称为对比度)大于60nm。2024年10月25日(2)显色剂无机显色剂不多,因为生成的络合物不稳定,灵敏度和选择性也不高。如用KSCN显色测铁、钼、钨和铌;用钼酸铵显色测硅、磷和钒;用H2O2显色测钛等(Ti4+能与过氧化氢反应产生橙黄色)。
2024年10月25日A磺基水杨酸
OO型螯合剂,可与很多高价金属离子生成稳定的螯合物,主要用于测Fe3+。B丁二酮肟
NN型螯合显色剂,用于测定Ni2+。C1,10-邻二氮菲
NN型螯合显色剂,测微量Fe2+。D二苯硫腙含S显色剂,萃取光度测定Cu2+,Pb2+,Zn2+,Cd2+,Hg2+等。E偶氮胂Ⅲ(铀试剂Ⅲ)
偶氮类螯合剂,强酸性溶液中测Th(Ⅳ),Zr(Ⅳ),U(Ⅳ)等;在弱酸性溶液中测稀土金属离子。F铬天青S
三苯甲烷类显色剂,测定Al3+。G结晶紫三苯甲烷类碱性染料,测定Tl3+。有机显色剂2024年10月25日
实验条件包括:溶液酸度,显色剂用量,试剂加入顺序,显色时间,显色温度,有机络合物的稳定性及共存离子的干扰等。12.4.2显色条件的选择(1)溶液的酸度
M+HR=MR+H+*影响显色剂的平衡浓度和颜色*影响被测金属离子的存在状态*影响络合物的组成
*pH与吸光度关系曲线确定pH范围。2024年10月25日(2)显色剂的用量
M(被测组分)+R(显色剂)=MR(有色络合物)
为使显色反应进行完全,需加入过量的显色剂。但显色剂不是越多越好。有些显色反应,显色剂加人太多,反而会引起副反应,对测定不利。在实际工作中根据实验结果来确定显色剂的用量。
2024年10月25日(3)显色反应时间
有些显色反应瞬间完成,溶液颜色很快达到稳定状态,并在较长时间内保持不变;
有些显色反应虽能迅速完成,但有色络合物的颜色很快开始褪色;
有些显色反应进行缓慢,溶液颜色需经一段时间后才稳定。制作吸光度-时间曲线确定适宜时间。(4)显色反应温度显色反应大多在室温下进行。但是,有些显色反应必需加热至一定温度完成。2024年10月25日(5)溶剂
有机溶剂降低有色化合物的解离度,提高显色反应的灵敏度。如在Fe(SCN)3的溶液中加入丙酮颜色加深。溶剂还可能提高显色反应的速率,影响有色络合物的溶解度和组成等。2024年10月25日(6)干扰及其消除方法
试样中存在干扰物质会影响被测组分的测定:例如干扰物质本身有颜色或与显色剂反应,在测量条件下也有吸收,造成正干扰。干扰物质与被测组分反应或与显色剂反应,使显色反应不完全,也会造成干扰。干扰物质在测量条件下从溶液中析出,便溶液变混浊,无法准确测定溶液的吸光度。为消除以上原因引起的干扰,可采取以下几种方法。2024年10月25日a.控制溶液酸度b.加入掩蔽剂选取的条件是掩蔽剂不与待测离子作用,掩蔽剂以及它与干扰物质形成的络合物的颜色应不干扰待测离子的测定;c.利用氧化还原反应,改变干扰离子的价态;d.利用校正系数;e.用参比溶液消除显色剂和某些共存有色离子的干扰;f.选择适当的波长;g.当溶液中存在有消耗显色剂的干扰离子时,可通过增加显色剂的用量来消除干扰;h.分离以上方法均不奏效时,采用预先分离的方法。2024年10月25日
在分光光度分析中,仪器测量不准确也是误差的主要来源。任何光度计都有一定的测量误差。这些误差可能来源于光源不稳定,实验条件偶然变动,读数不准确等。在光度计中,透射比的标尺刻度均匀。吸光度标尺刻度不均匀。对于同一仪器,读数的波动对透射比为一定值;而对吸光度读数波动则不再为定值。吸光度越大,读数波动所引起的吸光度误差也越大。12.5仪器测量测量误差和测量条件12.5.1仪器测量误差2024年10月25日
透光率很小或很大时,浓度测量误差都较大。
当△T=0.01,作图或对上式再求导,可求得:当A=0.434(或透光率T=36.8%)时,测量的相对误差最小。
一般情况下使待测溶液的透光率T在15%~65%之间,或使吸光度A在0.2~0.8之间,来保证测量的相对误差较小。
将此式对T微分:两边同除以A,得:2024年10月25日(1)测量波长的选择为了使测定结果有较高的灵敏度,应选择被测物质的最大吸收波长的光作为入射光,这称为“最大吸收原则”。选用这种波长的光进行分析,不仅灵敏度高,且能减少或消除由非单色光引起的对朗伯-比尔定律的偏离。但是,在最大吸收波长处有其他吸光物质干扰测定时,则可选另一灵敏度稍低,但能避免干扰的入射光波长。12.5.2测量条件的选择2024年10月25日
例丁二酮肟光度法测钢中镍,络合物丁二酮肟镍的最大吸收波长为470nm,但试样中的铁用酒石酸钠掩蔽后,在470nm处也有一定吸收,干扰镍的测定。为避免铁的干扰,可以选择波长520nm进行测定,虽然测镍的灵敏度有所降低,但酒石酸铁不干扰镍的测定。2024年10月25日(2)吸光度范围的选择从仪器测量误差的角度来看,为使测量结果得到较高准确度,一般控制标准溶液和被测试液的吸光度在0.2~0.8范围内。可通过控制溶液的浓度或选择不同厚度的吸收池来达到目的。(3)参比溶液的选择利用参比溶液来调节仪器的零点,可消除由吸收池壁及溶剂对入射光的反射和吸收带来的误差,扣除干扰的影响。2024年10月25日参比溶液选择:
a试液及显色剂均无色,蒸馏水作参比溶液;
b显色剂为无色,被测试液中存在其他有色离子,用不加显色剂的被测试液作参比溶液;
c显色剂有颜色,被测试液无色,可选择不加试样溶液的试剂空白作参比溶液。
d显色剂和试液均有颜色,可加入适当掩蔽剂,将被测组分掩蔽起来,使之不再与显色剂作用,而显色剂及其他试剂均按试液测定方法加入,以此作为参比溶液,这样就可以消除显色剂和一些共存组分的干扰。2024年10月25日(4)标准曲线的制作
有时标准曲线不通过原点可能是由于参比溶液选择不当,吸收池厚度不等,吸收池位置不妥,吸收池透光面不清洁等原因所引起的。若有色络合物的解离度较大,特别是当溶液中还有其他络合剂时,常便被测物质在低浓度时显色不完全。找出原因,尽量加以避免。2024年10月25日12.5.3对朗伯-比尔定律的偏离
在分光光度分析中,经常出现标准曲线不呈直线的情况,特别是当吸光物质浓度较高时,明显地看到通过原点向浓度轴弯曲的现象(吸光度轴弯曲)。这种情况称为偏离朗伯-比尔定律。若在曲线弯曲部分进行定量,将会引起较大的误差。
偏离朗伯-比尔定律的原因主要是仪器或溶液的实际条件与朗伯-比尔定律所要求的理想条件不一致。2024年10月25日(1)非单色光引起的偏离*朗伯-比尔定律只适用于单色光,但由于单色器色散能力的限制和出口狭缝需要保持一定的宽度,所以目前各种分光光度计得到的入射光实际上都是具有某一波段的复合光。由于物质对不同波长光的吸收程度的不同,因而导致对朗伯-比尔定律的偏离。较平坦不平坦2024年10月25日*克服非单色光引起的偏离的措施◎使用比较好的单色器,从而获得纯度较高的“单色光”,使标准曲线有较宽的线性范围。◎入射光波长选择在被测物质的最大吸收处,保证测定有较高的灵敏度,此处的吸收曲线较为平坦,在此最大吸收波长附近各波长的光的ε值大体相等,由于非单色光引起的偏离要比在其他波长处小得多。◎测定时应选择适当的浓度范围,使吸光度读数在标准曲线的线性范围内。2024年10月25日(2)介质不均匀引起的偏离朗伯-比尔定律要求吸光物质的溶液是均匀的。如果被测溶液不均匀,是胶体溶液、乳浊液或悬浮液时,入射光通过溶液后,除一部分被试液吸收外,还有一部分因散射现象而损失,使透射比减少,因而实测吸光度增加,便标准曲线偏离直线向吸光度轴弯曲。故在光度法中应避免溶液产生胶体或混浊。2024年10月25日(3)由于溶液本身的化学反应引起的偏离溶液中的吸光物质常因解离、缔合、形成新化合物或互变异构等化学变化而改变其浓度,因而导致偏离朗伯—比尔定律。2024年10月25日12.6分光光光度法的应用络合物组成的测定固定一种组分(通常是金属离子M)的浓度,改变络合剂(R)的浓度,得到一系列[R]/[M]比值不同的溶液,并配制相应的试剂空白作参比液,分别测定其吸光度。
以吸光度A为纵坐标,[R]/[M]
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 酒店餐饮AI应用行业深度调研及发展战略咨询报告
- 瘦身精油按摩套餐行业深度调研及发展战略咨询报告
- 玻璃幕墙安装企业制定与实施新质生产力战略研究报告
- 热带建筑风格设计行业跨境出海战略研究报告
- 新型解热镇痛内服药品企业制定与实施新质生产力战略研究报告
- 植被覆盖监测行业深度调研及发展战略咨询报告
- 在校园文化传承中的运用
- 学校安全管理机制的建立与实施
- 化工企业安全生产风险控制
- 企业国际化经营的跨文化交流与合作案例研究
- DL∕T 1120-2018 水轮机调节系统测试与实时仿真装置技术规程
- 公积金归集委托协议
- JTG D30-2015 公路路基设计规范
- 一年级下册口算题卡大全(50套直接打印版)
- 慢性肾脏病英文
- 涉密文件失泄密应急预案
- 智联招聘测评题库2024答案
- 农业社会化服务体系课件
- WS 10013-2023 公共场所集中空调通风系统卫生规范
- 医务人员医德考评登记表(模板)
- 临时电缆敷设方案

评论
0/150
提交评论