



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
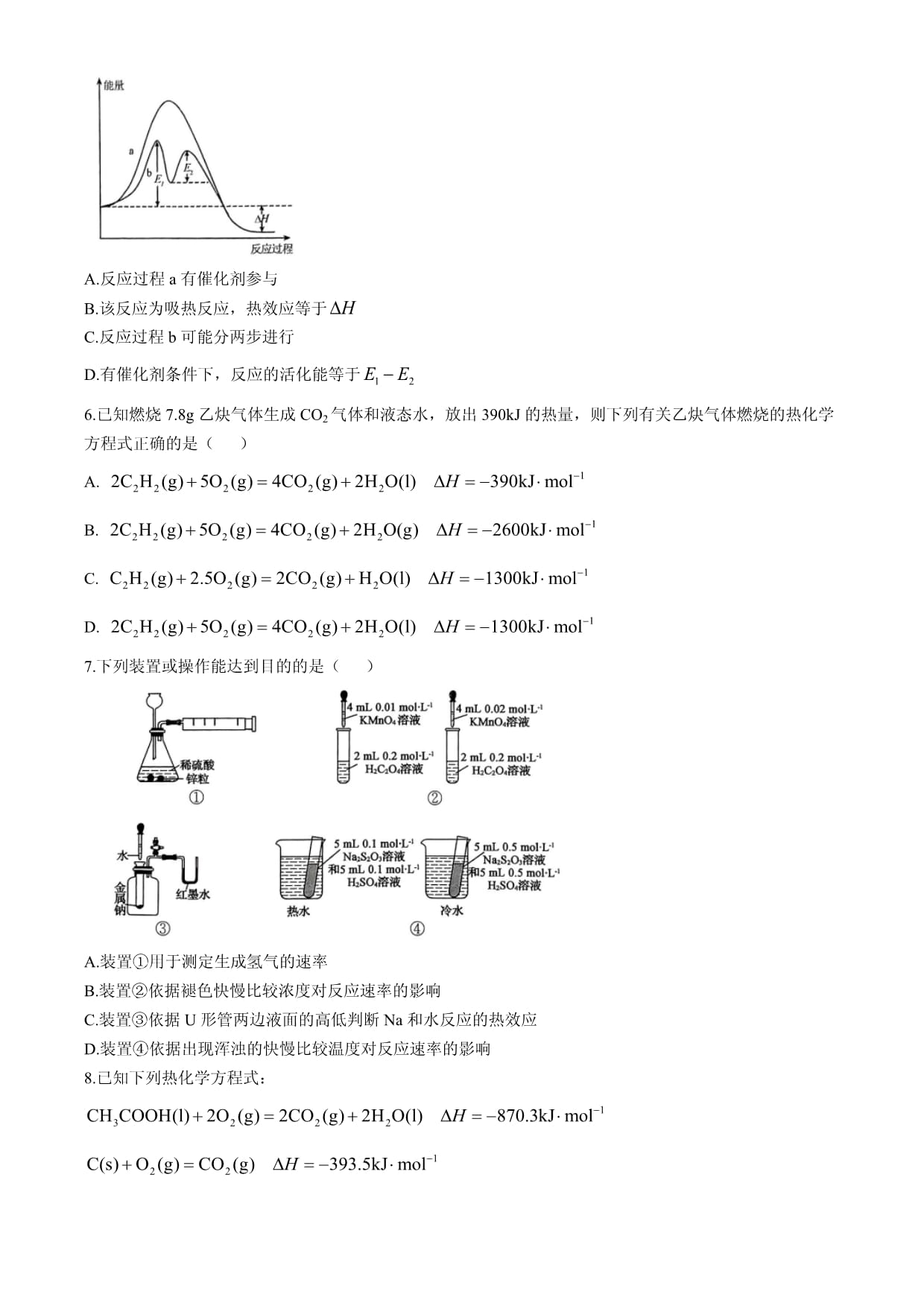
安龙四中2024年秋季学期高二年级10月月考化学考生注意:1.满分100分,考试时间75分钟。2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。3.本卷命题范围:人教版选择性必修1第一章至第二章第二节。可能用到的相对原子质量:H1C12O16一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.在生产、生活中为减小反应速率而采取的措施合理的是()A.使用加酶洗衣粉洗涤衣物 B.白炽灯泡抽成近真空C.煅烧前将矿石粉碎成细小颗粒 D.用稀硫酸溶浸回收的废渣时加热到80℃2.中华传统文化蕴含着丰富的化学知识,下列诗句中主要涉及吸热反应的是()A.白居易《赋得古原草送别》:“野火烧不尽,春风吹又生。”B.于谦《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。”C.于谦《咏煤炭》:“爝火燃回春浩浩,烘炉照破夜沉沉。”D.李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”3.工业上由CO2和H2合成气态甲醇的热化学方程式为。下列表示合成甲醇的反应的能量变化示意图中正确的是()A.B.C.D.4.下列说法正确的是()A.温度计能直接测出中和反应中的能量变化B.C(金刚石,s)=C(石墨,s),则石墨比金刚石稳定C.甲烷完全燃烧时化学能全部转化为热能D.中和反应的反应热为,则0.5mol浓H2SO4与足量NaOH溶液反应放热57.3kJ5.某反应过程中能量变化如图所示。下列说法正确的是()A.反应过程a有催化剂参与B.该反应为吸热反应,热效应等于C.反应过程b可能分两步进行D.有催化剂条件下,反应的活化能等于6.已知燃烧7.8g乙炔气体生成CO2气体和液态水,放出390kJ的热量,则下列有关乙炔气体燃烧的热化学方程式正确的是()A.B.C.D.7.下列装置或操作能达到目的的是()A.装置①用于测定生成氢气的速率B.装置②依据褪色快慢比较浓度对反应速率的影响C.装置③依据U形管两边液面的高低判断Na和水反应的热效应D.装置④依据出现浑浊的快慢比较温度对反应速率的影响8.已知下列热化学方程式:则反应的为()A. B. C. D.9.物质(t—BuNO)2可发生如下反应:。相同温度下,起始浓度相等的(t—BuNO)2在CCl4溶剂中的平衡转化率小于其在正庚烷溶剂中的平衡转化率。CCl4溶剂中: 平衡常数K1正庚烷溶剂中: 平衡常数K2则K1与K2的关系正确的是()A. B. C. D.10.可逆反应,下列研究目的与图示相符的是()选项ABCD研究目的压强对反应的影响(p2>p1)温度对反应的影响平衡体系增加N2对反应的影响催化剂对反应的影响图示11.对于任何一个化学反应平衡体系,采用以下措施,一定会使化学反应平衡移动的是()A.加入一种反应物 B.升高温度C.对平衡体系增加压强 D.使用催化剂12.工业上苯乙烯的生产主要采用乙苯脱氢工艺:。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是()A.曲线①表示的是逆反应的v—t关系B.t1时刻体系处于平衡状态C.反应进行到t1在时,Q>K(Q为浓度商)D.催化剂存在时,v1、v2都增大13.关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①②下列叙述错误的是()A.降低温度,反应②平衡正向移动B.反应②正方向是吸热反应C.降低关节滑液中HUr及Na+含量是治疗关节炎的方法之一D.关节保暖可以缓解疼痛,原理是平衡②逆向移动14.金属插入CH4的C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图所示是CH4与Zr形成过渡金属化合物的过程。下列说法错误的是()A.整个反应快慢,由状态2反应决定B.C.在中间产物中状态最稳定D.的活化能为213.67二、非选择题:本题共4小题,共58分。15.(14分)某小组同学在化学实验室完成中和反应的反应热的测定。回答下列问题:(1)实验桌上备有内筒、外壳、隔热层、杯盖(中心有两个小孔)、胶头滴管、玻璃搅拌器、0.50盐酸、0.55NaOH溶液。该实验尚缺少的玻璃用品是。(2)该实验(填“可以”或“不可以”)用铜丝搅拌器代替玻璃搅拌器,其原因是。(3)记录的实验数据如下:实验用品溶液温度t1t2=1\*GB3①50mL0.55NaOH溶液50mL0.50盐酸20℃23.3℃②50mL0.55NaOH溶液50mL0.50盐酸20℃23.5℃已知:,中和后生成的溶液的比热容,各物质的密度均为1.0。=1\*GB3①根据表中数据计算中和反应的反应热(保留1位小数)。②根据实验结果,NaOH溶液与HCl溶液反应的热化学方程式为。(4)若用0.55KOH溶液代替0.55NaOH溶液做实验,对测定结果(填“有”或“无”)影响;若用0.50醋酸溶液代替0.50盐酸做实验,对测定结果(填“有”或“无”)影响。16.(15分)研究人员通过实验在钌催化剂表面成功观察到CO与O形成化学键生成CO2的过程,起始阶段及反应过程如下图:回答下列问题:(1)整个实验过程中吸收能量的是(填标号)。a.O22O b.状态I状态II c.状态II状态III(2)CO2的形成过程中,图中物质最稳定的是状态(填“I”“II”或“III”);从能量角度考虑钌催化剂的作用是。(3),O2中O=O键能为498,CO2中O=C键能为803。①CO中的键能为。②。(4)工业生产甲醇的常用方法是。已知:,=1\*GB3①H2的燃烧热。②1gH2(g)完全燃烧生成水蒸气(填“放出”或“吸收”)的热量为kJ。③的。17.(15分)把在空气中久置的镁条7.2g投入盛有500mL0.5硫酸的烧杯中,镁条与硫酸反应产生氢气的总体积与反应时间的关系如图所示。回答下列问题:(1)0~a时间段内不产生氢气的原因是,0~a时间段内发生反应的离子方程式为。(2)(填“ab”“bc”或“cd”)段化学反应速率最快,原因是。(3)在b到c这段时间内,收集到VL(标准状况)氢气,则这段时间内用硫酸表示的平均反应速率为(假设反应前后溶液体积不变)。(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验:将表中所给的混合溶液分别加入6个盛有过量镁片的容器中,收集产生的气体,记录获得相同体积气体所需的时间。实验混合溶液ABCDEF4的硫酸溶液/mL30V1V2V3V4V5饱和CuSO4溶液/mL00.52.55V620H2O/mLV7V8V9V10100=1\*GB3①请完成此实验设计:其中V1=,V6=。②该同学最后得出的结论为当加入少量饱和CuSO4溶液时,生成氢气的速率会大大提高,但当加入的饱和CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:。18.(14分)回答下列问题:(1)用活性炭可以还原处理氮氧化物,有关反应为。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填标号)。A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)B.混合气体的密度不再发生改变C.反应体系的压强不再发生改变D.混合气体的平均相对分子质量不再改变(2)CO和H2合成甲醇的反应为。若在容积可变的密闭容器中充入mmolCO和nmolH2,(2m≠n)发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(p)的变化曲线如图1所示。①反应0(填“>”“<”或“=”)。②比较p1p2(填“>”“<”或“=”),理由是。图1 图2(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,反应相同时间内CO2的转化率随温度变化如图2所示。催化剂效果最佳的是催化剂(填“I”“II”或“III”)。b点v(正)(填“>”“<”或“=”)v(逆)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是。(4)图中c点对应温度下反应的平衡常数K=。
安龙四中2024年秋季学期高二年级10月月考·化学参考答案、提示及评分细则一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。题号1234567891011121314答案BBABCCCABCBDBD1.B使用加酶洗衣粉相当于加入生物催化剂,可加快去污速率,A项不符合题意;白炽灯泡抽成近真空可减小钨丝被氧化的速率,B项符合题意;煅烧前将矿石粉碎成细小颗粒,可增大反应物的接触面积,加快反应速率,C项不符合题意;升高温度,反应速率加快,加速溶解,D项不符合题意。2.B碳酸钙高温发生分解的反应是吸热反应,则诗句中主要涉及的是吸热反应。3.A反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图像是A。4.B 5.C 6.C7.C装置①生成的氢气可以由长颈漏斗逸出,不能根据生成氢气的体积测定生成氢气的速率,故A错误;装置②依据褪色快慢比较浓度对反应速率的影响,应保证高锰酸钾溶液的浓度相同,用不同浓度的草酸来做实验,故B错误;Na和水反应放热,广口瓶内气体受热膨胀,U形管左侧液面下降,右侧液面上升,所以装置③能实现目的,故C正确;装置④中浓度、温度都不同,无法判断温度对速率的影响,故D错误。8.A9.B温度相同,但由于溶剂不同,起始浓度相等的在CCl4溶剂中的平衡转化率小于其在正庚烷溶剂中的平衡转化率,即平衡常数。10.C11.B在反应中,加入一种固体反应物,固体量的增减不会引起化学平衡的移动,A项错误;任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热反应方向进行,B项正确;对于没有气体参加的反应,或是反应前后气体体积不变的反应,压强改变不会引起平衡的移动,C项错误;使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,D项错误。12.D反应为乙苯制备苯乙烯的过程,开始反应物浓度最大,随着反应进行反应物浓度逐渐减小,则正反应速率逐渐减小,所以曲线①表示的是正反应的v-t关系,A错误;t1时,正.逆反应速率不相等,反应未达到平衡状态,B错误;反应进行到t1时,正反应速率大于逆反应速率,反应正向进行,故Q<K,C错误;催化剂能降低反应的活化能,反应速率均增大,D正确。13.B由题目信息可知,关节炎病因是在关节滑液中形成尿酸钠体,尤其在寒冷季节能诱发关节疼痛,说明温度越低,越有利于尿酸钠的形成,温度降低平衡向正反应方向进行,降低温度平衡向放热方向移动,故反应②正反应是放热反应,即,降低温度则平衡正向移动,A项正确,B项错误;降低关节滑液中HUr及Na+含量能减少尿酸钠的生成,所以是治疗关节炎的方法之一,C项正确;反应②正方向为放热反应,保暖是升高温度平衡逆向移动,从而减缓病痛,D项正确。
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 青春的旋律校园文化节活动记9篇范文
- 国际商务谈判英语考点汇编及答案解析
- 2025年四川省自贡市中考物理试题含答案
- 顾客忠诚度提升的心理学原理
- 音乐节、艺术展等活动的社会影响力分析
- 非遗在办公文化塑造中的独特作用与价值体现研究报告
- 音乐产业线上线下融合策略新零售时代的创新路径
- 音乐产业从传统到新型商业模式的转变
- 音乐、舞蹈等艺术形式的跨文化传播实践
- 青少年学习的最 佳时间管理技巧探索
- 2025部编版语文二年级下册第七单元测试卷(含答案)
- 免疫细胞疗法在阿尔茨海默病中的应用-全面剖析
- SWOT分析应用试题及答案
- DB15T 3727-2024温拌再生沥青混合料超薄磨耗层碳排放核算技术规程
- 浦发银行贷款合同文本样式
- 2025年刑事技术考试试题及答案
- 2024年安徽省《辅警招聘考试必刷500题》考试题库及完整答案(必背)
- 2025年部编版新教材语文一年级下册期末测试题及答案(一)
- 农村调解培训课件
- 2025年标准房产共有份额转让协议书样本
- 机器人柔性控制系统-深度研究

评论
0/150
提交评论