



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
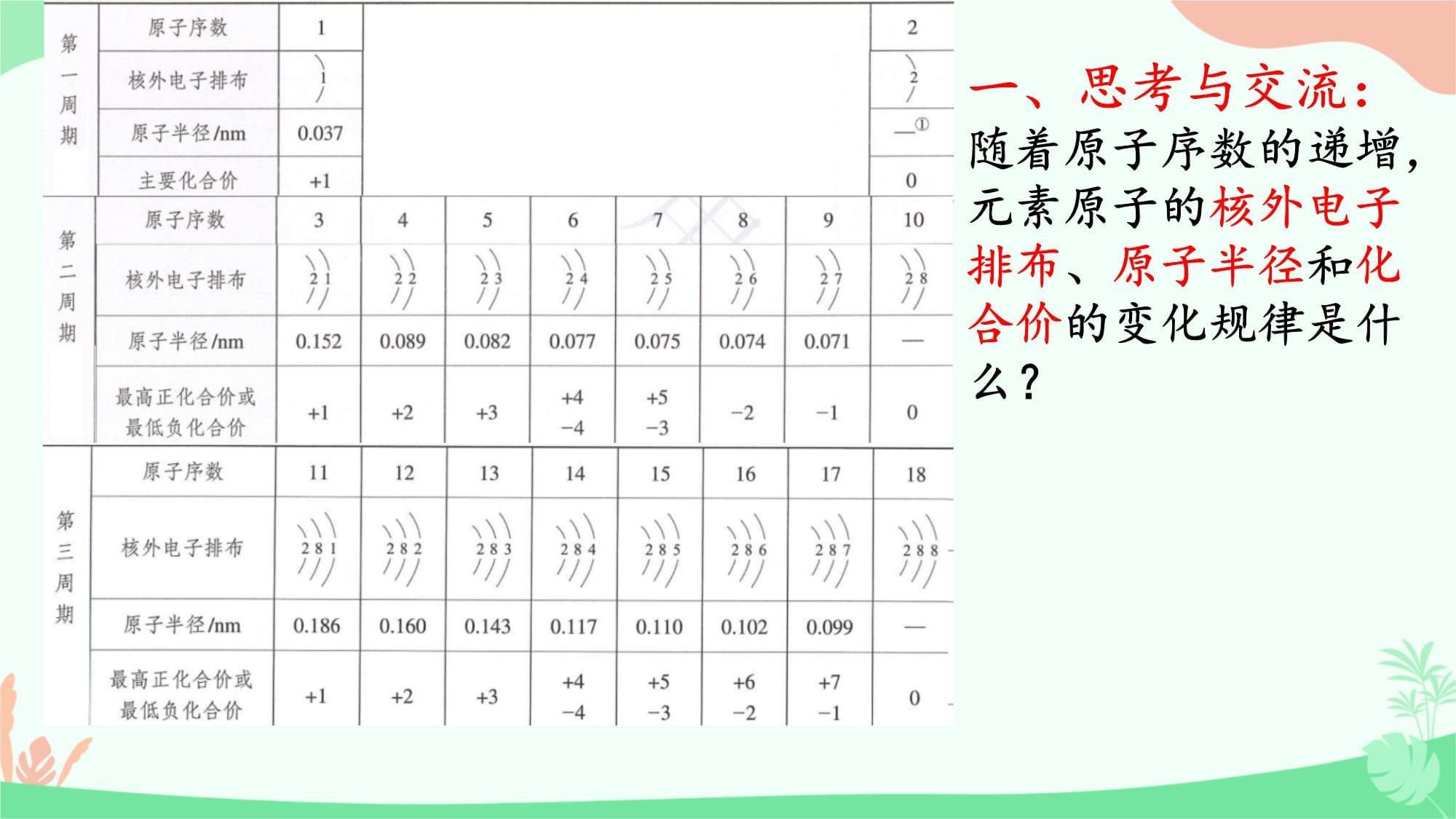
人教版必修第一册第二节元素周期律第1课时元素性质的周期性变化规律通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,周期表中同周期元素的性质有什么变化规律呢?一、思考与交流:随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价的变化规律是什么?最外层电子数1→2最外层电子数1→8最外层电子数1→81、元素原子核外电子排布的周期性变化规律:随着原子序数的递增,同周期元素原子的最外层电子排布呈现1→8的周期性变化(第一周期除外)原子半径的变化规律:原子半径逐渐减小原子半径逐渐减小同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)规律:随着原子序数的递增,同周期元素原子半径呈现由大到小的周期性变化(不包括稀有气体)2、元素原子半径的周期性变化原子半径逐渐增大原子半径逐渐减小H是半径最小的原子短周期主族元素中,原子半径最大的是哪种元素?Na正价:+1→+5,负价:-4→-1正价:+1→+7,负价:-4→-1规律:随着原子序数的递增,元素最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。3、元素主要化合价的周期性变化注意:(1)并不是所有周期的主族元素最高正价重复+1价至+7价的周期变化。如O、F的最高正价不是+6、+7价(2)并不是所有元素均有负化合价,如金属元素只有正价,无负价【思考与交流】
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。那么,元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性变化呢?【思考】同一周期的元素,原子结构有何异同?电子层数相同,原子序数依次增大,最外层电子数增多
我们通过第三周期元素的一些化学性质来探讨这一问题。【探究】【问题讨论】根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?钠Na镁Mg铝Al硅Si磷P硫S氯Cl氩Ar最外层电子数少,容易失去半径减小,失电子能力减弱元素金属性减弱最外层电子数多,容易得到半径减小,得电子能力减弱元素非金属性增强NaMgAlSiPSCl失电子能力减弱,得电子能力增强金属性减弱,非金属性增强请将课本翻至95页,阅读一下课本下面的注释如何证明Na、Mg、Al的金属性逐渐减弱呢?单质与水(或酸)反应的难易最高价氧化物的水化物——氢氧化物的碱性强弱二、Na、Mg、Al的金属性实验现象:常温下镁与水的反应较缓慢,镁条表面有一些红色;加热后反应剧烈,镁条表面有大量气泡,溶液变为红色。实验现结论:与金属钠相比较,该反应明显困难,说明钠的金属性强于镁【探究】2、镁、铝和盐酸的反应镁有气泡放出,镁反应剧烈Mg+2HCl=MgCl2+H2↑铝也有气泡放出,反应较缓和2Al+6HCl=2AlCl3+3H2↑单质还原性:Na>Mg>Al即金属性:Na>Mg>Al3、演示实验:向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。AlCl3溶液氨水HCl溶液NaOH溶液Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O白色絮状沉淀两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物【探究】白色沉淀Mg(OH)2白色沉淀Al(OH)3加NaOH溶
液NaOH溶液MgCl2溶液AlCl3溶液沉淀不溶解沉淀溶解4、用MgCl2溶液代替AlCl3溶液Mg(OH)2不和碱反应Mg(OH)2为典型金属元素性质Al(OH)3和碱反应溶解Al(OH)3呈非金属元素性质Al(OH)3+NaOH=NaAlO2+2H2O元素金属性:Na>Mg>AlAl(OH)3两性①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序为
;②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为
;③钠、镁、铝的金属性由强到弱的顺序为
。Na>Mg>AlNaOH>Mg(OH)2>Al(OH)3Na>Mg>Al第三周期金属还原性强弱变化规律【总结】NaMgAlSiPSCl失电子能力减弱,得电子能力增强金属性减弱,非金属性增强请将课本翻至97页,阅读一下课本下面的注释如何证明Si、P、S、Cl的非金属性逐渐增强呢?最高价氧化物的水化物的酸性强弱单质与氢气反应生成气态氢化物的难易气态氢化物的稳定性三、Si、P、S、Cl的非金属性H4SiO4极弱酸H3PO4中强酸H2SO4强酸HClO4最强酸高温光照或点燃爆炸化合磷蒸气加热很不稳定SiH4PH3不稳定H2S较稳定HCl稳定第三周期非金属单质氧化性强弱变化规律元素非金属性增强【探究】①硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为
;②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为
;③硅、磷、硫、氯元素非金属性由强到弱的顺序为
。Cl>S>P>SiHClO4>H2SO4>H3PO4>H2SiO3Cl>S>P>Si【总结】第三周期非金属单质氧化性强弱变化规律元素金属性减弱元素非金属性增强元素金属性减弱元素非金属性增强元素金属性减弱元素非金属性增强随着原子序数的递增,元素金属性和非金属性呈现周期性变化同一周期从左往右,金属性逐渐减弱,非金属性逐渐增强元素金属性减弱元素非金属性增强四、第三周期元素金属性和非金属性强弱变化规律(1)元素周期律是指元素的性质随着原子序数的递增而
的变化。(2)元素的性质包括:
、
、
、
等。(3)元素周期律实质是
的必然结果。呈现周期性原子半径主要化合价金属性非金属性核外电子排布发生周期性变化减弱增强五、元素周期律小结(1)同周期一般来说,同周期从左→右,其原子半径逐渐减小,但稀有气体除外。稀有气体元素的原子半径一般比相同电子层的非金属元素的原子半径大。例如:原子半径Mg>Al>P>Cl(2)同主族一般来说,同主族(上→下)原子的逐渐增大。例如:原子半径K>Na>Li(3)当电子层数和最外层电子数都不同时,可运用三角规律来比较。例如:原子半径大小的比较【课堂练习】1、下列各组微粒半径比较中错误的是()A.Cl-<Br-<I-B.Al3+>Mg2+>Na+C.Rb>K>NaD.P>S>OB电子层数不同电子层数不同电子层排布相同电子层数相同×√√√【课堂练习】1.下列各组元素性质或原子结构递变情况错误的是()A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正化合价依次升高C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数依次增多
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 供应链价值链分析方法-试题及答案
- 重要贸易条款解析试题及答案
- 2024年CPMM应试心理调节及试题及答案
- 供应链终端管理试题及答案探讨
- CPSM考试全科目复习试题及答案
- 分阶段复习的2024年CPMM试题及答案
- 2024年CPMM备考进阶试题及答案
- 2025年ABS专用料项目合作计划书
- 豫南九校2025届高考考前模拟化学试题含解析
- 植物体内水分调节机制试题及答案
- 隧道施工工艺及技术方法课件
- 风力发电厂安全培训课件
- 应用文写作全套优质课件(修改稿)
- 施工企业安全生产评价汇总表
- 健康体检套餐
- 一对蝈蝈吹牛皮-完整版获奖课件
- 建设工程消防设施检测报告模板
- 安徽省中等职业学校优秀教学软件(微课)
- 阴滋病的课题:拉开攻破的序幕
- 330KV变电站设计论文
- 无刷直流永磁电动机设计流程和实例

评论
0/150
提交评论