



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
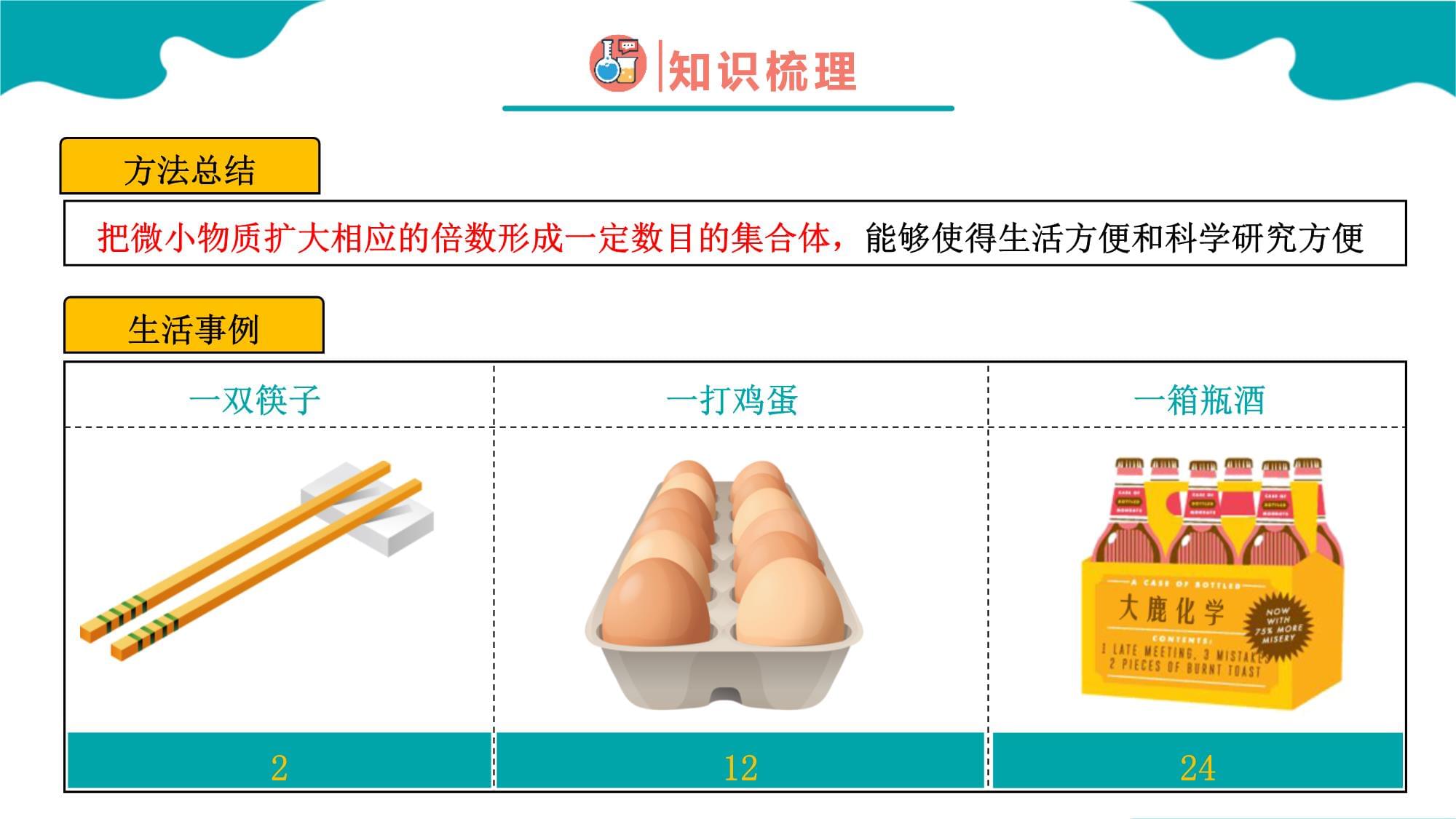
第二章海水中的重要元素──钠和氯第三节物质的量第1课时21本节重点本节难点物质的量物质的量、微粒数、摩尔质量之间的换算招驸马必备问答1000题大鹿化学工作室很久之前,皇帝招驸马时提出了这样一个问题:1000石小米是多少粒?(古代十六两为一斤,一百五十斤为一石)思考:驸马是如何解决这个问题的呢?驸马的做法方法:数出了一斤小米的数量确定一石小米的数量大鹿化学工作室制作确定1000石小米的数量把微小物质扩大相应的倍数形成一定数目的集合体,能够使得生活方便和科学研究方便方法总结生活事例一双筷子一打鸡蛋一箱瓶酒21224请同学们正确读出下列化学反应方程的意义(定量描述)每2个氢分子可以和1个氧分子发生反应产生2个水分子微观角度宏观角度角度一每4份质量的氢气和32份质量的氧气恰好完全反应生成36份质量的水角度二每2体积的氢气和1体积的氧气恰好完全反应生成水宏观角度气体体积(V气
)质量(m)微观角度微粒个数(N)这些物理量之间有什么联系呢?物质的量212微观粒子分子个数比43236宏观物质物质质量比如何将可称量与肉眼看不见及难以称量的联系起来呢?宏观物质微观粒子物质的量将宏观物质和微观粒子联系起来的一座桥梁物质的量的单位——摩尔•••1箱1打宏观物质把微小物质扩大倍数形成一定数目的集体筷子啤酒鸡蛋•••1双微观粒子表示含有一定数目粒子的集合体离子原子分子••••••1mol1mol1mol物理量______质量______电流热力学温度物质的量发光强度单位(符号)米(m)____________秒(s)安(A)开(K)________坎(cd)物质的量的单位——摩尔千克(kg)摩(mol)国际单位制(SI)中的7个基本单位长度时间物质的量的定义微观粒子:分子、原子、离子、电子、质子、原子团、中子等物质的量是国际单位制七个基本物理量之一单位是-摩尔、简称-摩,符号:_______表示含有一定数目粒子的集合体,符号为____,nmol物质的量的单位——摩尔注意事项“物质的量”是该物理量的全称,是专有名词;物质的量不能当成物质的数量或质量来理解01“物质的量”只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质02摩尔作为单位时,必须指明物质微粒的名称、符号或化学式,如:1molH,不能用“1mol氢”这样含糊无意义的表示03物质的量的数值可以是整数,也可以是小数04【例1】下列说法不正确的是(
)物质的量可以理解为物质的数量物质的量是国际单位制中七个基本物理量之一摩尔是物质的量的单位物质的量描述对象是分子、原子等微观粒子A【例2】判断正误(正确的打“√”,错误的打“×”)。(1)1mol铅笔()(2)2mol氧()(3)4molH2()(4)1molNa2CO3中含有2molNa+()(5)0.012kg12C中约含有6.02×1023个碳原子()××√√√1双筷子是2支,1打鸡蛋是12个,1箱啤酒是24听,那么,1mol微观粒子是多少个呢?
1971年,由41个国家参加的第14届国际计量大会上,正式宣布国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为国际单位制中的一个基本物理量,物质的量的单位为摩尔同时规定:0.012kg12C中所含的碳原子数目作为1mol的标准即:1mol粒子集体所含的粒子数=0.012kg12C中所含的碳原子数(已知一个12C原子的质量为1.993×10-26kg)思考:0.012kg12C中所含的碳原子数是多少呢?=6.02×1023
1mol粒子集体所含的粒子数N(12C)=0.012kg1.993×10-26kg1mol任何粒子的集合体都含有约6.02×1023个粒子阿伏加德罗常数阿伏伽德罗常量的值,最早由奥地利化学及物理学家约翰·约瑟夫·洛施米特,法国物理学家让·佩兰于1909年提出,把常数命名为阿伏伽德罗常量来纪念他阿伏加德罗常数即:若某物质含有与0.012Kg12C中所含的碳原子数相同的粒子数,该物质的物质的量为1mol符号:NA数值:
近似等于6.02×1023单位:mol-1(每摩尔)规定:0.012Kg12C中所含的碳原子数洛施米特我是测出者阿伏加德罗常数到底有多大呢?如果把6.02×1023粒米给全球70亿人吃,每人每天吃一斤,同学们计算下,可以吃多少年?阿伏加德罗常数与微观粒子数之间的关系约为6.02×10231mol粒子的粒子数0.012Kg12C中所含原子数阿伏加德罗常数=阿伏加德罗常数==不能认为1mol粒子等于6.02×1023个,也不能认为6.02×1023就是阿伏加德罗常数物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系式(约6.02×1023mol-1)=NA×n×NA÷NA【规律】微粒之间的物质的量之比等于微粒的_______之比N=n×NA阿伏加德罗常数N粒子个数物质的量NA=N/n
粒子数解:O2的分子数为N(O2)=n×NA
【例1】在0.5molO2中含有的氧分子数目是多少?氧原子数目是多少?N(O2)=0.5mol×6.02×1023mol-1
N(O2)=3.01×1023
氧原子数为N(O)=2×N(O2)N(O)=2×3.01×1023
N(O)=6.02×10231个水分子中有2个氢原子和1个氧原子,有如下关系:2NANANA即H2O——2H——O1mol2mol1mol(n1︰n2=N1︰N2)121
粒子个数:物质的量:×NA×NA×NA分子中原子的物质的量之比=分子中原子个数之比分子中原子个数之比【例1】1个CO2分子中有1个C原子、2个O原子。那么1molCO2中有___molC和__molO,0.5molCO2中有____molC和__molO。含有0.5molO的CO2的物质的量为_____mol。10.510.252【例2】1(1)1molNa2SO4中含有Na+的数目是___________,与其含有相同Na+数目的NaCl的物质的量为______。(2)若测得某Na2SO4溶液中含有0.5molSO42-,则溶液中含有__molNa+。(3)____molNH3与0.3molH2O中所含H原子一样多。(4)0.3molH2O中含____mol原子,含___________个电子。1.204×10242mol10.20.91.806×10241mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同1molH2O约含有6.02×1023个水分子,质量是18g1molAl约含有6.02×1023个铝原子,质量是27g1mol任何微观物质都约含6.02×1023个粒子,那么,这1mol物质的质量到底有多大?粒子符号相对分子或原子质量1个粒子的质量1mol物质含有的粒子数(个)1mol物质质量(g)C121.993×10-23g
Fe569.032×10-23gH2SO4
981.628×10-22gH2O182.990×10-23gNa+233.821×10-23gOH-172.824×10-23gNANANANANANA125698182317分析以上计算结果可得出什么规律?(6.02×1023)(6.02×1023)(6.02×1023)(6.02×1023)(6.02×1023)(6.02×1023)规律1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量1mol任何微粒或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量结论摩尔质量定义:符号:M常用单位:g·mol-1公式:m=n×M数值:等于物质的相对原子(分子)质量摩尔质量单位物质的量(即1mol)的物质所具有的质量叫做该物质的摩尔质量。摩尔质量概念的理解确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变NAN
=Mm
=n
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系物质的量将宏观物质和微观粒子联系起来的一座桥梁物质的量不等同1mol物质的质量、摩尔质量、相对分子质量(或相对原子质量)是不同的概念当摩尔质量以“g·mol-1”为单位时,三者在数值上相等,但单位不同,故三者不等同思考题:1mol物质的质量、摩尔质量、相对分子质量(或相对原子质量)是否等同?【例1】计算下列物质的摩尔质量。(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。(2)1.28g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为
__________。(3)已知一个铁原子的质量为bg,则铁的摩尔质量为____________。(4)NA为阿伏加德罗常数,已知ag某气体中含分子数为b,则该气体的摩尔质量为_____________。17g·mol-164g·mol-1bNAg·mol-1baNA
g·mol-1摩尔的出现先于物质的量德国化学家奥斯特瓦尔德(1853-1932)基于对道尔顿原子假说和阿伏加德罗分子假说的质疑,于1900年首次提出“摩尔(mole)”这个名称,将其定义为一个关于质量的量。采用“摩尔”来统一“克分子”“克原子”“克离子”“克当量”等概念。这与当时盛行的当量理论一致,与分子原子论不一致。采用“摩尔”主要是达到反对原子假说和分子假说的目的,因为摩尔是拉丁语,其含义是“质量很大、一堆”,刚好与原子、分子的含义“质量很小”相反【答案】A【详解】物质的量是描述微观粒子的数目多少的物理量;香蕉、铅笔、大米均为宏观物质,不能使用物质的量描述;1mol钠原子化学用语使用正确;故选A。【答案】A【详解】A.物质的量和物质的数量是两个不同的概念,A错误;B.物质的量是国际单位制中七个基本物理量之一,7个基本的物理量分别为:长度(单位:m)、质量(单位:kg)、时间(单位:s)、电流强度(单位:A)、发光强度(单位:cd)、温度(单位:K)、物质的量(单位:mol),B正确;C.摩尔是物质的量的单位,C正确;D.物质的量描述对象是分子、原子、离子、质子、电子、中子等微观粒子,D正确;故选A。【答案】A【详解】A.1mol甘氨酸分子中含有1mol氮原子,A正确;
B.1mol甘氨酸分子中含有5mol氢原子,B错误;C.1mol甘氨酸分子中含有2mol氧原子、即含1.204×1024个氧原子,C错误;
D.1mol甘氨酸分子中含有2mol碳原子、即含
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 未来五年酱腌藠头企业数字化转型与智慧升级战略分析研究报告
- 未来五年岩土工程企业ESG实践与创新战略分析研究报告
- 未来五年亚麻子油(非食用)企业数字化转型与智慧升级战略分析研究报告
- 基于大概念整合与分层建构的六年级英语Starter单元语言知识系统化学习方案
- 奔跑的奥秘:设计与优化个人短跑训练方案-八年级物理与体育跨学科项目化学习案例
- 学校消防安全教育、培训制度
- 事业单位内部控制制度建设案例
- 公路养护施工环境保护措施方案
- 初中科学教材教学计划与实施方案
- 员工薪酬福利调查报告分析
- 2025年主管护师考试真题及答案
- 2025年威海银行校招笔试面试及答案
- DB51T 3342-2025炉灶用合成液体燃料经营管理规范
- 2026年浙江康复医疗中心公开招聘25人笔试参考题库及答案解析
- 2025税务副科级选拔笔试题及答案
- 山东省淄博市张店区2024-2025学年七年级上学期1月期末考试英语试题
- 甲醛生产培训课件
- 档案保护修复员工作总结报告
- 2025年及未来5年市场数据中国覆膜机市场调查研究及行业投资潜力预测报告
- 工程机械设备租赁服务方案投标文件(技术方案)
- 麻醉科术后疼痛管理流程

评论
0/150
提交评论