



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
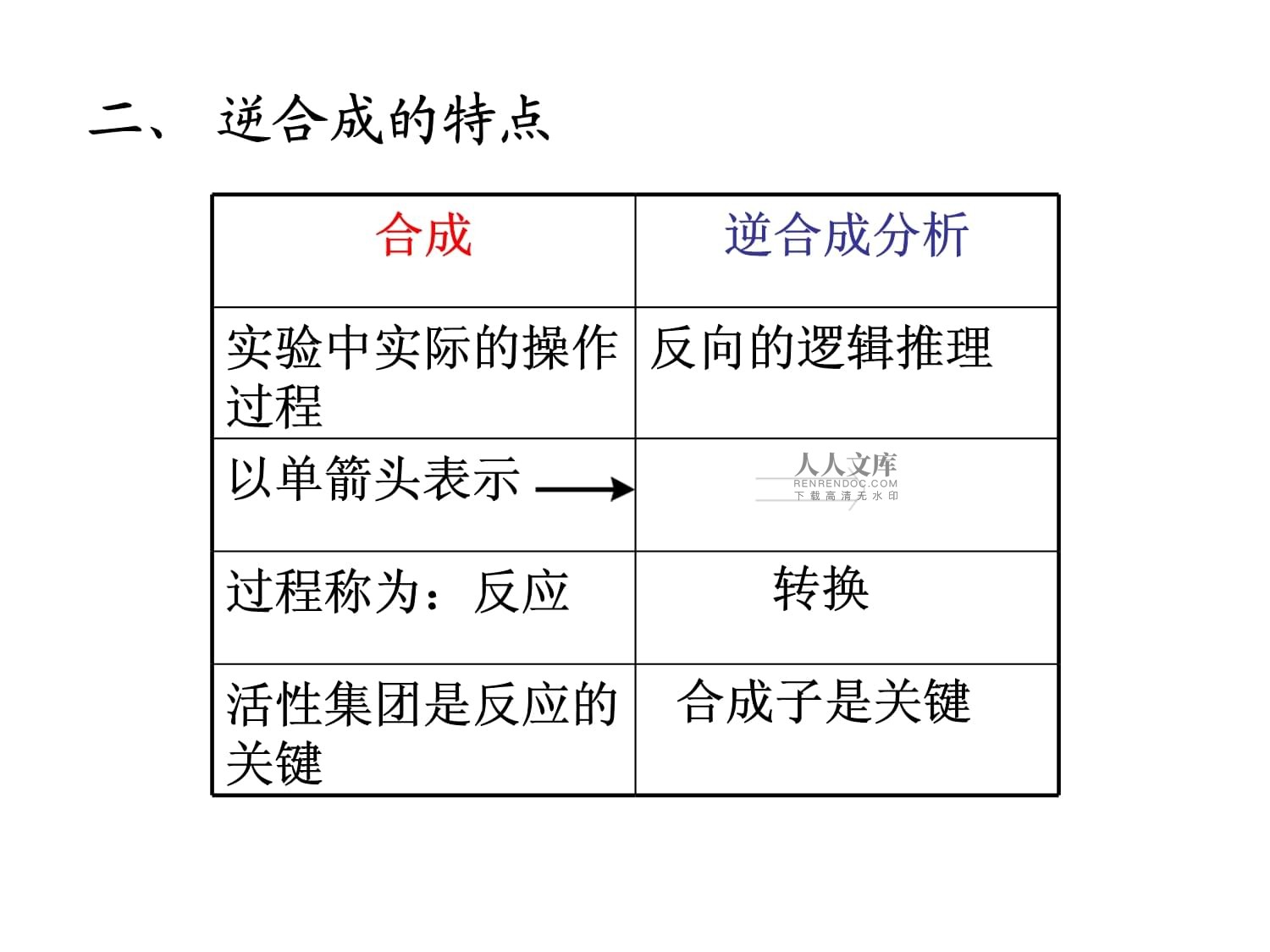
第三章、有机合成设计的逻辑推理-逆向分析法1967年,E.J.Corey首先提出逆向分析法逆向分析法:是从目标化合物出发,把它分割成两部分找出可能的前体,这些前体可以用可靠的反应结合成目标化合物。如果前体中一种或几种仍较复杂,则把它们当作新的目标化合物,继续推导其可能的前体,到所有的前体都是简单的化合物为止的思维方法。一、概念:合成逆合成分析实验中实际的操作过程反向的逻辑推理以单箭头表示过程称为:反应转换活性集团是反应的关键合成子是关键二、逆合成的特点三、设计合成路线的具体步骤第一步,分析(Analysis)。具体包括两点1.原理上的推导从目标分子出发,分析其结构,逐步化繁为简、反推路线,去追溯最终所需要的原料-符合①易得;②价廉。2.确定实用的路线将按上法推出的各种可能的路线,进行比较和试用。若客观条件不便实施,则应当放弃,再重新另推,直到得以切实可行的实用路线为止。第二步:合成1.确定反应的具体条件完成各步反应进行的具体条件,如,酸、碱环境,何种溶剂,温度,压力,光照或加催化剂,反应时间等等。选择的反应,要尽量避免高温、高压、超低温、有毒或昂贵的试剂和溶剂等等。2.适当控制反应其办法是(对于多官能团化合物尤其如此):(1)引入导向基。(2)引入保护基。一、目标分子的初步考察逆合成的基本程序:将目标分子的结构打断,分割为一些前体,这些前体能用已知的方法和反应重新合成目标分子。双向考虑:一是将目标分子简化,分割为合理的结构片断,找出可行的原料。二是从原料出发,合成中间体,最后合成目标分子。第四章、分子拆分法官能团价键环式结构的战略键特殊的亚结构单元立体化学对称性官能团的分析:注意它的种类和特性。考虑形成的方法和引入的次序,敏感的尽可能放到后期,否则应保护。战略键Mannichreaction特殊的亚结构单元对称性1.通过特定的转换简化合成问题以特定的反应去考虑某些目标分子具有1,3-二羰基结构简单分子的分割与合成双向思考线索
Friedel-Craftsreaction
Grignard
reation
AldolandClaisencondensation
WittigreactionA.Michaelreation
烷基化
Mannichreaction2.通过特定的结构单元简化合成问题潜在的中间体起始原料的结构单元起始原料的手性中心识别类似于脱氧己糖3.利用目标分子的对称性简化合成问题目标分子对称性潜在的分子对称性局部对称性Example1:Example2:鹰爪豆碱二、合成子与手性合成子1.合成子与合成等当体合成子:凡能用已知的或合理的合成操作,将有机分子连接起来的结构单元。结构单元:是目标分子进行结构剖析时,分子中的化学键被分割而产生的分子碎片。正离子a(acceptor)负离子d(donor)自由基r(radical)中性分子e(electron)合成子的有效性在拆开一个有机分子时,有很多拆开的方法,可以在多处拆开成很多碎片。这些碎片不一定都能反过来键接而成分子。也就是说,在有机合成中,它们中有些是有效的(即实际上,能逆向合成的),另一些是无效的。作为合成子必须拆开后在有机合成中确实有效的碎片。合成子是否一定实际存在“合成子”是一个人为的、概念化了的名词。它区别于实际存在的起反应的离子、自由基或分子。合成子可能是实际存在的,也可能是一个实际不存在的、抽象化了的东西。合成等当体:与合成子对应的试剂。目标分子合成子合成等当体合成子合成等当体合成子合成等当体合成子合成等当体Example2.手性合成子通过对映选择性合成,首先在底物分子中引入手性元素。采用天然或合成的光学活性化合物-手性合成子。光学活性产物的合成设计有两种方法:TM手性元手性模板手性元:对映异构纯的手性合成子不是假设的结构片断,而是真正的中间体手性元三、目标分子化学键的分割符号:or1.分割的原则(1)要有合理的反应机理Example1Example2合成子等当体(2)最大程度的简化Example(3)应找出易得的原料Example2.分割的技巧(1)如果化合物中只有一种碳碳单键,试用以下分割方法:紧接官能团切割。在官能团的α-C与β-C之间切割。在官能团的β-C与γ-C之间切割。在碳链的支链接点处切断。(2)如果化合物只含有碳碳单键,而两个官能团的碳原子很接近(中间间隔不超过3个碳原子),最好在这两个官能团的碳原子之间切开。如果两个官能团相距较远,就按上述(1)的方法分割。(3)如果化合物含有C=C,则考虑从此处切开如果是孤立双键(非共轭)就联想Wittig反应。如果是α,β-
不饱和羰基化合物则可能是缩合反应,或是稳定的叶立德的Wittig反应。如果双键上含有氢,则最好从相应的炔烃来考虑。(4)当分子中含有复杂的环式结构(如桥环,多环等),用共用原子法来简化。(5)若有-OH时,可考虑从此两侧相邻的碳之间分割。αβγδExample1βExample2Example3WittigreactionReformatskyreactionExample4第五章、目标分子中碳骨架分析TMABCDEFGHIJKLMNO合成树:把所有目标分子可能的“切断”连同所得的中间体汇集成图。1.直链分子的反合成Example1Example21,3-二羰基化合物1,4-二羰基化合物1,5-二羰基化合物1,6-二羰基化合物2.环系化合物的反合成(1)对于芳环,芳环一般由原料带入。Example(2)芳香杂环化合物一般由适宜的开链化合物合成(3)脂环化合物通常也是由开链化合物合成Example2(4)对于多环体系采用切断共用原子法习题第六章、保护基与官能团的保护保护其他官能团而引入分子内的官能团,称为“保护基”对保护基的要求:1.容易引入所要保护的分子中2.与被保护分子能有效的结合3.在保持分子的其他部分结构不损坏的条件下易除去例1设计5—甲基—5—轻基—2—己酮的合成路线。一、几类重要官能团的保护法二、醇类——羟基的保护三、酚类—对羟基的保护四、酸类—羧基保护注意:(1)甲脂的制备和水解,均比乙酯容易。(2)甲酯为围体衫相应的乙酷为液体,处理时应当采取不同的措施。(3)通过采用原酸酯,进行保护可降低官能团的活性。五、醛、酮—羰基的保护合成实例例一第五章、有立体择向性要求的合成有光学活性化合物的合成(1)利用拆分(2)利用有光学活性的起始原料2.立体专一反应的运用(1)常见立体专一反应(2)环氧化合物的利用三、立体选择性反应的运用第六章、简单分子的逆合成举例Example1合成:Example2Example3Example
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026年绿色施工技术在隧道工程中的应用
- 2026年电气防爆防护措施的实施
- 2026年绿色建筑中光伏系统的集成设计
- 货运驾驶员超载安全培训
- 货车司机安全培训标语课件
- 生物D打印技术助力个性化治疗
- 医疗行业市场预测与展望
- 2026年河南地矿职业学院单招职业技能考试模拟试题带答案解析
- 2026年福州工商学院单招综合素质笔试参考题库带答案解析
- 医疗礼仪:医护人员礼仪修养的重要性
- 肿瘤化疗导致的中性粒细胞减少诊治中国专家共识解读
- 2025年查对制度考核考试题库(答案+解析)
- 云南省2025年普通高中学业水平合格性考试历史试题
- 四川省2025年高职单招职业技能综合测试(中职类)汽车类试卷(含答案解析)
- 隧道施工清包合同(3篇)
- 消化系统肿瘤多学科协作(MDT)诊疗方案
- 安泰科技招聘笔试题库2025
- 二级生物安全培训课件
- 2025广东省横琴粤澳开发投资有限公司第二批社会招聘21人笔试历年典型考点题库附带答案详解试卷2套
- 塔吊拆除安全操作培训
- 2025年及未来5年中国抓娃娃机行业市场全景监测及投资前景展望报告

评论
0/150
提交评论