



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
专题4
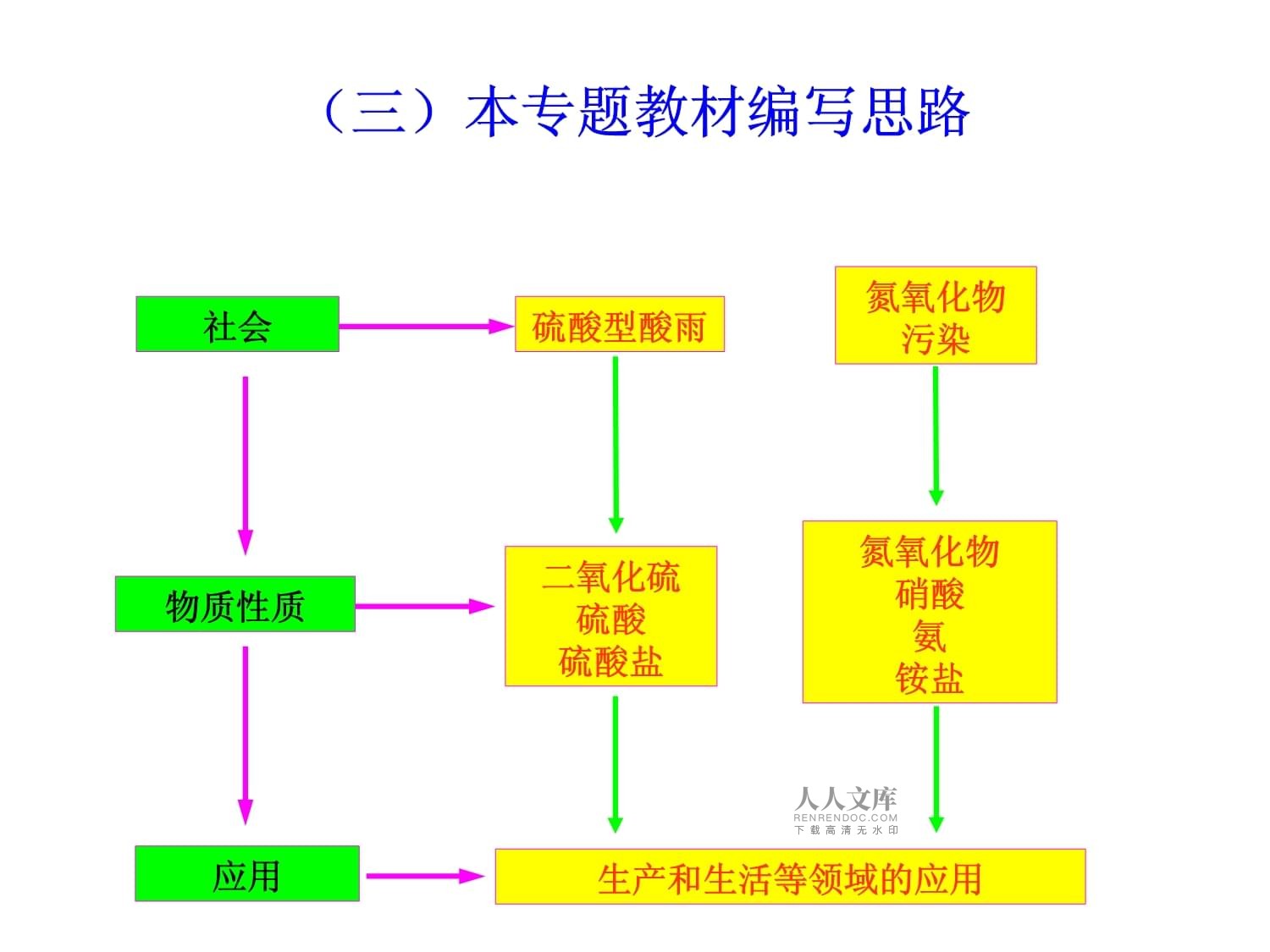
硫、氮和可持续发展复习社会物质性质应用硫酸型酸雨氮氧化物污染二氧化硫硫酸硫酸盐氮氧化物硝酸氨铵盐生产和生活等领域的应用(三)本专题教材编写思路三、硫酸型酸雨的形成及防治SO2+H2OH2SO32SO2+O22SO3催化剂SO3+H2O=H2SO42H2SO3+O2
=2H2SO4硫酸型酸雨的形成酸雨:PH值小于5.6的降水。三、酸雨的形成及防治氨水法石灰石-石膏法Ca(OH)2+SO2=H2O+CaSO32CaSO3+O2=2CaSO4SO2+2NH3+H2O=(NH4)2SO32(NH4)2SO3+O2=(NH4)2SO4SO2+CaO=CaSO3
△2CaSO3+O2=2CaSO4
△CaCO3=CO2↑+CaO△3.你认为减少酸雨产生的途径可采用的措施是______________。①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源。①③⑤例题.A、B两种气体都是污染大气的主要污染物,国家《环境保护法》严禁未经处理就把它们排放到空气中。A是一种单质,其水溶液具有杀菌消毒作用,B是形成酸雨的主要污染物。请写出下列变化的化学方程式:⑴A用于工业上制取漂白精:
;⑵B的水溶液露置在空气中酸性增强:
;⑶A、B都能分别使品红试液褪色,但两者水溶液混合后却不能使品红褪色且溶液酸性增强:
;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2H2SO3+O2=2H2SO4Cl2+SO2+2H2O=H2SO4+2HClSO2与H2O反应与碱反应氧化性还原性酸性氧化物+4价漂白性特性重视环境保护,防止酸雨危害环境!与碱性氧化物SO2+2NaOH=Na2SO3+H2OSO2+Cl2+2H2O=H2SO4+2HClSO2+2Br2+2H2O=H2SO4+2HBrSO2+2H2S=3S↓+2H2O品红褪色,加热后又变红课堂练习下列可以用来鉴别SO2
和CO2
的方法是[]A、通入紫色石蕊试液B、闻气味
C、通入澄清石灰水D、通入品红溶液中都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能BD1、下列关于SO2的说法中错误的是()
A.SO2是一种无色,有刺激性气味的有毒气体
B.SO2能使紫色的石蕊变红色
C.SO2是硫酸的酸酐,称为硫酐
D.SO2能与CaO反应生成CaSO3C2、下列物质做干燥剂可干燥SO2的是()
A.生石灰
B.NaOH固体
C.碱石灰
D.浓硫酸D5.银耳本身为淡黄色,福建省生产的一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密闭状态良好的塑料棚内,在棚的一端支一口小锅,锅内放有硫磺,加热使硫磺融化并燃烧,两天左右,雪耳就制成了,雪耳炖而不烂,且对人体有害,制作雪耳利用的就是()A.硫的还原性B.硫的漂白性C.二氧化硫的还原性D.二氧化硫的漂白性D“硫酸的制备和性质”知识体系硫酸FeS2(或S)SO2SO3稀硫酸的通性浓硫酸的特性吸水性脱水性氧化性工业制硫酸的原理硫酸的性质及应用1、一瓶浓盐酸和一瓶浓硫酸长期敞口放置,质量会如何变化?浓度如何变化?2、硫酸在下列用途或反应中各表现的性质是:
A.强酸性B.难挥发性C.吸水性D.脱水性
E.强氧化性F.高沸点性(1)干燥H2、SO2等气体________;(2)用铝槽车装运浓硫酸________;(3)清洗镀件表面氧化物________;(4)浓硫酸使湿润石蕊试纸变红,后来又变黑_____(5)胆矾中加入浓硫酸,久置变为白色粉末
;(6)蔗糖中加入浓硫酸,形成“黑色发糕”
;浓盐酸质量减少,浓硫酸质量增加。浓度均减小。CEAAECDE一、硫酸工业生产的原理第一步:硫磺(或含硫矿石)与氧气反应生成SO2S+O2=SO2点燃沸腾炉4FeS2+11O2=2Fe2O3+8SO2高温第二步:SO2在催化剂作用下与氧气反应生成SO3接触室第三步:SO3的吸收SO3+H2OH2SO4吸收塔2SO2+O22SO3催化剂△硫酸工业生产流程动画硫酸的工业生产沸腾炉接触室吸收塔净化冷却21.下列说法正确的是A工业制取硫酸的设备依次是沸腾炉、热交换器、吸收塔。B硅是制造光导纤维的材料C水玻璃是建筑行业常用的一种黏合剂。D纯碱、石灰石是制取水泥的原料C“硫及其化合物之间的相互转化”知识体系Na2SO4H2SO4BaSO4SO3SO2SH2SFeSHgSH2SO3Na2SO3不同价态硫元素之间的氧化还原反应及含同价态硫元素的物质之间的酸碱反应4.下列物质均有漂白作用,其漂白原理相同的是()①双氧水②次氯酸③二氧化硫④活性炭⑤臭氧A.①②⑤B.①③⑤C.②③④D.①②③A“氮氧化合物的产生及转化”知识体系①雷电(自然固氮)NONO2HNO3空气中N2②化工、汽车尾气雷雨发庄稼光化学烟雾32O
NO2
23O主要反应拓展N2+3H22NH3催化剂高温高压“氮肥的生产和使用”知识体系空气中N2NH3溶解性NH4+弱碱性氯化铵的热分解铵盐与碱反应空气合成氨的意义铵态氮肥使用性质探究铵态氮肥NH4+的检验:溶液中加入NaOH共热,湿润的红色石蕊试纸变蓝。NH4++OH-=NH3+H2O氮肥的生产和使用
1、氨气(2)性质:2、铵盐(1)生产:(3)制取:易溶于水;一元弱碱。(1)易溶解;(2)易分解;(2)易碱解。“硝酸的性质”知识体系NH3NONO2HNO3物理性质不稳定性、强酸性强氧化性(浓、稀硝酸与铜反应,浓硝酸与炭反应,钝化)硝酸工业制法硝酸的性质及应用Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓)==CO2↑
+4NO2↑+2H2O△S+6HNO3(浓)H2SO4+6NO2↑+2H2O
△4HNO32H2O+4NO2↑+O2↑
△或光照足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
反应停止后,如果在溶液中再加入足量盐酸,会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续氧化铜,当然此时NO3-/H+的溶度较稀.思考题
一开始是铜与浓硝酸反应:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O随着反应进行,硝酸由浓变稀,则发生:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O思考题1、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2,下面是三位同学提出的三个方案:甲:铜浓硝酸乙:铜稀硝酸丙:铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuOA、B、C、D五种物质按右图所示发生转变(反应条件已略去)。(1)若A在通常情况下是固体,则A、B、C、D、E的化学式分别是:A
B
C
D
E
,(2)若A在通常情况下是气体,则A、B、C、D、E的化学式分别是:A
B
C
D
E
、
SSO3SO2H2SH2SO4N2NO2NONH3HNO32.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是 ()
A.温室效应——二氧化碳
B.光化学污染——二氧化氮
C.酸雨——二氧化碳
D.臭氧层破坏——氟氯烃CA、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如下图所示的转化,其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物,则A可能是()A.Cl2B.N2C.SD.CABCDEBC
4.最新的研究表明:一氧化氮吸入治疗法可快速改善SARS中重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是()
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮易溶于水,不能用排水法收集
C下图A~H分别代表有关反应中的一种物质,其中B是能使澄清石灰水变浑浊的无色无味的气体,完成以下空白:(1)A、B、C的化学式分别是
、
、
。(2)C与氧气反应的化学方程式是
。(3)G与C反应的化学方程式是
。NH4HCO3CO2NH3NONO2NOHNO3(NH4)2CO3H2O16.(8分)右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作氮肥,也可用来作炸药。(1)写出A和F的化学式:A
、F
;
(2)写出下列变化的化学方程式:
B→C:
。
E→C:
。NO2
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 村民物品交换协议书范本
- 私人荒地转让合同协议书
- 离职合同终止协议书模板
- 门面出租协议协议书模板
- 鸡排店合伙人合同协议书
- 股权转让服务协议合同书
- 锅炉运行及维护合同范本
- 碳钢计量罐采购合同范本
- 肉店转让合同协议书模板
- 生意交易合同协议书模板
- 220KV升压站运行规程(改后)
- 肠系膜脉管系统肿瘤的诊断
- 非标设备制作安装工程施工方案
- 爆破工程技考核试卷
- GB/T 9766.6-2021轮胎气门嘴试验方法第6部分:气门芯试验方法
- 操场塑胶面层施工方案及工艺方法
- 粤信签小程序操作使用说明
- 医院季度院感监测信息及分析
- 福建省林业行政执法人员法律考试
- GB∕T 15329-2019 橡胶软管及软管组合件 油基或水基流体适用的织物增强液压型 规范
- 《组织机构代码证》word版

评论
0/150
提交评论