

版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、PAGE PAGE 26专题十水溶液中的离子平衡高考命题研究高频考点两年考向命题角度再思考1.溶液中的“三大平衡”考向1.电离平衡、盐类水解及影响因素2021广东卷,82021浙江卷,232020山东卷,152020北京卷,112020天津卷,7考向2.沉淀溶解平衡及影响因素2020天津卷,7考向1.近两年,高考题结合电解质溶液图像,考查电离平衡、水解平衡及影响因素,溶液的酸碱性判断、水的电离程度比较、离子浓度的大小比较等。考向2.在选择题中结合沉淀溶解平衡图像,考查沉淀溶解平衡的影响因素、溶度积的计算等2.溶液中的“四大常数”考向1.电离常数、水解常数及应用2021山东卷,152020全国,
2、132020天津卷,7考向2.溶度积常数及应用2021全国甲,122021全国乙,132021广东卷,182020全国,272020山东卷,162020天津卷,7考向1.在选择题中结合电解质溶液图像,考查电离常数或水解常数的计算。考向2.在化工流程题中考查溶度积常数(Ksp)的计算及应用等3.酸碱中和滴定及迁移应用考向1.酸碱中和滴定及应用2021湖南卷,92020全国,27考向2.酸碱中和滴定的迁移应用2020浙江卷,302020浙江卷,272020山东卷,202020北京卷,18考向1.以有机物(如苯甲酸)的制备为载体,考查酸碱中和滴定操作、仪器及用途、产品纯度的测定等。考向2.一般出现在
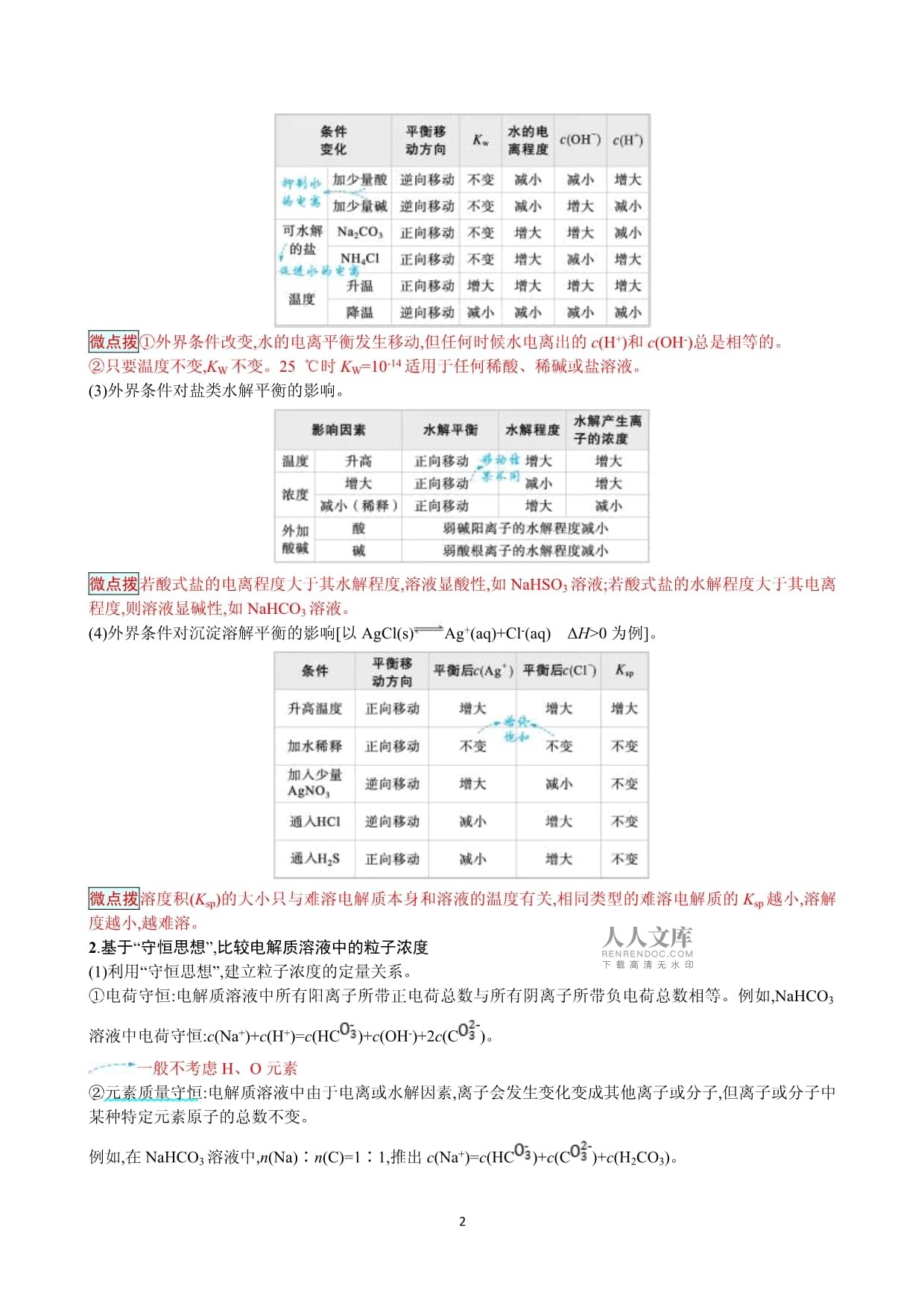
3、化学工艺流程题或综合实验题中,考查产品纯度的测定等,以氧化还原滴定为主,侧重考查实验数据的处理能力等考点一溶液中的“三大平衡”要点归纳再提升1.立足“动态平衡”,认识电解质溶液中的“三大平衡”(1)外界条件对弱电解质的电离平衡的影响以CH3COOH(aq)CH3COO-(aq)+H+(aq)H0为例。(2)外界条件对水的电离平衡的影响(H2OH+OH-H0)。微点拨外界条件改变,水的电离平衡发生移动,但任何时候水电离出的c(H+)和c(OH-)总是相等的。只要温度不变,KW不变。25 时KW=10-14适用于任何稀酸、稀碱或盐溶液。(3)外界条件对盐类水解平衡的影响。微点拨若酸式盐的电离程度大
4、于其水解程度,溶液显酸性,如NaHSO3溶液;若酸式盐的水解程度大于其电离程度,则溶液显碱性,如NaHCO3溶液。(4)外界条件对沉淀溶解平衡的影响以AgCl(s)Ag+(aq)+Cl-(aq)H0为例。微点拨溶度积(Ksp)的大小只与难溶电解质本身和溶液的温度有关,相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。2.基于“守恒思想”,比较电解质溶液中的粒子浓度(1)利用“守恒思想”,建立粒子浓度的定量关系。电荷守恒:电解质溶液中所有阳离子所带正电荷总数与所有阴离子所带负电荷总数相等。例如,NaHCO3溶液中电荷守恒:c(Na+)+c(H+)=c(HC)+c(OH-)+2c(C)。一般不
5、考虑H、O元素元素质量守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其他离子或分子,但离子或分子中某种特定元素原子的总数不变。例如,在NaHCO3溶液中,n(Na)n(C)=11,推出c(Na+)=c(HC)+c(C)+c(H2CO3)。可根据电荷守恒和元素质量守恒联合求出质子守恒:质子守恒是指电解质溶液中的分子或离子得到或失去的质子的物质的量相等。例如,在NH4HCO3溶液中,H+、H2CO3为得到质子后的产物,NH3H2O、OH-、C为失去质子后的产物,故有c(H+)+c(H2CO3)=c(NH3H2O)+c(OH-)+c(C)。微点拨电荷守恒式中不能只是各离子浓度的简单相加,要
6、考虑离子所带的电荷,例如2c(C)的化学计量数2代表一个C带有2个负电荷,不可漏掉。(2)熟知溶液中粒子浓度的“不等式关系”。类型典型实例多元弱酸溶液0.1 molL-1的H2S溶液中:c(H+)c(HS-)c(S2-)c(OH-)一元弱酸的正盐溶液0.1 molL-1的CH3COONa溶液中:c(Na+)c(CH3COO-)c(OH-)c(H+)二元弱酸的正盐溶液0.1 molL-1的Na2CO3溶液中:c(Na+)c(C)c(OH-)c(HC)c(H+)二元弱酸的酸式盐溶液0.1 molL-1的NaHCO3溶液中:c(Na+)c(HC)c(OH-)c(H+)c(C)经典对练得高分考向1电离
7、平衡、盐类水解及影响因素真题示例1- 1.(2021浙江卷)实验测得10 mL 0.50 molL-1 NH4Cl溶液、10 mL 0.50 molL-1 CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 时CH3COOH和NH3H2O的电离常数均为1.810-5。下列说法不正确的是()A.图中实线表示pH随加水量的变化,虚线表示pH随温度的变化B.将NH4Cl溶液加水稀释至浓度为 molL-1,溶液pH变化值小于lg xC.随温度升高,KW增大,CH3COONa溶液中c(OH-)减小,c(H+)增大,pH减小D.25 时稀释相同倍数的NH4Cl溶液与CH3COONa溶
8、液中:c(Na+)-c(CH3COO-)=c(Cl-)-c(N)1- 2.(双选)(2020山东卷)25 时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 molL-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是()A.O点时,c(CH3COOH)=c(CH3COO-)B.N点时,pH=-lg KaC.该体系中,c(CH3COOH)= molL-1D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大【解题思路】分析可知,随着pH的升高,OH-
9、和CH3COO-浓度增大,H+和CH3COOH浓度减小,又因pH=7时,c(H+)=c(OH-),故可推知,图中各曲线代表的物质分别是曲线1表示CH3COO-,曲线2表示H+,曲线3表示OH-,曲线4表示CH3COOH,据此分析作答。方法技巧“四步法”突破溶液中的“两大平衡”难题。电离平衡、盐类的水解平衡是溶液中的“两大平衡”,此类试题大多以电解质溶液的有关图像为载体,依据“勒夏特列原理”分析外界条件对上述平衡的影响,具体步骤如下:对点演练1- 1.(2021北京顺义模拟)常温下,向20 mL 0.1 molL-1 CH3COOH溶液中逐滴加入0.1 molL-1的NaOH溶液,溶液中水电离的
10、c(OH-)随加入NaOH溶液的体积变化如图所示,下列说法正确的是()A.b、d两点溶液的pH相同B.从a到e,水的电离程度一直增大C.从ac的过程中,溶液的导电能力逐渐增强D.e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.1 molL-11- 2.(双选)(2021山东济宁模拟)已知N2H4在水中的电离与NH3相似,室温下向N2H4水溶液中滴加某强酸,溶液的pH与离子浓度的关系如图所示。下列说法不正确的是()A.N2H4在水溶液中的第二步电离平衡常数为10-13B.N2+N2H42N2的平衡常数为1.0109C.N2H5Cl溶液中N2的水解能力大于电离能力
11、D.N2H6Cl2溶液中:c(Cl-)=c(N2)+c(N2)+c(H+)考向2沉淀溶解平衡及影响因素真题示例(2019全国)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是()A.图中A和B分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的Ksp的关系为Ksp(M)=Ksp(N)Ksp(P)1.010-7,则A-的水解常数Khc(Cl-)c(OH-)c(H+)1- 2.(2020全国)以酚酞为指示剂,用0.100 0 molL-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2
12、A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积V(NaOH)的变化关系如下图所示。比如A2-的分布系数:(A2-)=下列叙述正确的是()A.曲线代表(H2A),曲线代表(HA-)B.H2A溶液的浓度为0.200 0 molL-1 C.HA-的电离常数Ka=1.010-2D.滴定终点时,溶液中c(Na+)3c(A2-)D.b点对应溶液中:c(OH-)=c(H+)+c(HA-)+c(H2A)1- 2.(2021福建莆田质检)常温下,向20.00 mL 0.10 molL-1 NH4Cl溶液中逐滴加入0.10 molL-1 NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑
13、挥发),其中d点为反应终点。下列说法不正确的是()A.V=20.00 mLB.常温下,Kb(NH3H2O)的数量级为10-5C.b点溶液中:c(Cl-)c(Na+)c(H+)=c(OH-)D.c点的混合溶液中:c(N)=c(Na+)方法技巧弱酸的酸式盐(如NaHX)溶液中存在HX-的电离平衡和水解平衡,要根据(H2X)和Kh(HX-)的大小判断HX-的电离程度和水解程度的相对大小,继而判断NaHX溶液的酸碱性:若(H2X)Kh(HX-),则HX-的电离程度大于其水解程度,NaHX溶液呈酸性;若(H2X)6.0时,溶液中Mo元素以Mo的形态存在。“沉钼”中,pH为7.0。若条件控制不当,BaCO
14、3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HC)c(Mo)=(列出计算式)时,应停止加入BaCl2溶液。对点演练2- 1.(双选)(2021山东邹城一中模拟)常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 molL-1的氨水,反应过程中-lg c(Ag+)或-lg c(Ag(NH3)2+)与加入氨水体积的关系如图。下列说法错误的是()A.原硝酸银溶液的浓度是0.1 molL-1B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-8C.b点对应溶液中N的浓度小于c点对应溶液中N的浓度D.m点对应溶液中c(N)c(Ag+)+c(Ag(NH3)2+)+c(N)2-
15、 2.(2021福建模拟节选)(1)常温下,若在含Cd2+、Te4+滤液中加入NaOH溶液调节pH为7,溶液中c(Cd2+)的最大值为。(已知:KspCd(OH)2=5.310-15)(2)溶液中Co2+的浓度为0.33 molL-1,通过计算说明,常温下除铝控制溶液pH为4.5,是否造成Co2+的损失?(列出算式并给出结论)。已知:(KspCo(OH)2=5.910-15)方法技巧根据沉淀溶解平衡曲线计算Ksp。(1)根据沉淀溶解平衡图像中处于曲线上平衡点的坐标,计算溶度积常数(Ksp)的值,要注意看清横坐标、纵坐标是c还是lg c(或-lg c)。(2)结合沉淀溶解平衡,确定Ksp的表达形
16、式,根据图中沉淀溶解平衡曲线上点的信息,计算Ksp的值。(3)当溶液中离子浓度10-5 molL-1时,可认为该离子沉淀完全,可结合Ksp确定此时另一离子的浓度。易错防范不失分判断正误(正确的画“”,错误的画“”)。(1)0.1 molL-1 CH3COOH溶液中,升高温度,电离平衡正向移动,则KW、Ka(CH3COOH)均增大。()(2)0.1 molL-1 CH3COONa溶液中,滴加浓NaOH溶液,水解平衡逆向移动,溶液中c(OH-)增大,但Kh(CH3COO-)减小。()(3)在0.1 molL-1 NH4Cl溶液中,存在定量关系:KW=Kb(NH3H2O)Kh(N)。()(4)在0.
17、1 molL-1 CH3COONa溶液中,水解常数Kh(CH3COO-)=。()考点三酸碱中和滴定及迁移应用要点归纳再提升1.酸碱中和滴定实验操作要点微点拨酸碱恰好中和(即滴定终点)时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质。2.氧化还原滴定的原理及应用(1)滴定原理:依据氧化还原反应中定量关系,以氧化剂(或还原剂)为滴定剂,滴定一些具有还原性(或氧化性)的物质。(2)常用试剂。常见的用于滴定的氧化剂有KMnO4、K2Cr2O7、I2等;常见的用于滴定的还原剂有亚铁盐、草酸、Na2S2O3等。(3)应用实例。酸性KMnO4溶液滴定H2C2O4溶液。原理2Mn+6H+5H2C2O41
18、0CO2+2Mn2+8H2O指示剂酸性KMnO4溶液本身呈紫红色,不用另外选择指示剂终点判断当滴入最后半滴酸性KMnO4溶液后,溶液由无色变浅红色,且半分钟内不褪色,说明到达滴定终点Na2S2O3溶液滴定碘液(碘量法)。原理2Na2S2O3+I2Na2S4O6+2NaI指示剂用淀粉作指示剂终点判断当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点3.沉淀滴定法及应用(1)沉淀滴定法是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。(2)沉
19、淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以Cr为指示剂,这是因为AgCl比Ag2CrO4更难溶。经典对练得高分考向1酸碱中和滴定及应用真题示例(2020全国)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:+KMnO4+MnO2+HCl+KCl名称相对分子质量熔点/沸点/溶解性甲苯92-95110.60.867不溶于水,易溶于乙醇苯甲酸122122.4(100 左右开始升华)248微溶于冷水,易溶于乙醇、热水实验步骤:(1)在
20、装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,置于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,加入100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.010 00 molL-1的KOH标
21、准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。回答下列问题。(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为(填字母)。A.100 mLB.250 mL C.500 mLD.1 000 mL(2)在反应装置中应选用(填“直形”或“球形”)冷凝管,当回流液不再出现油珠即可判断反应已完成,其判断理由是。(3)加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理: 。(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是。(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是。(6)本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率
22、最接近于(填字母)。A.70%B.60%C.50%D.40%(7)若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。【解题思路】(1)仪器的选择。(2)仪器的选择。根据物质性质分析判断:甲苯沸点低,且不溶于水,因此当回流液没有油珠时,说明不溶于水的甲苯已经完全被氧化。(3)分析试剂的作用。陌生氧化还原反应方程式的书写。(4)判断物质的组成元素转化思想。(5)根据题给信息分析判断。(6)定量计算利用关系式的计算。苯甲酸纯度的计算。由关系式C6H5COOHKOH可知,苯甲酸的纯度为:100%=86.0%。苯甲酸产率的计算。1.5 mL甲苯理论上可得到苯甲酸的质量:122 gmol-1=1.72 g
23、;产品的产率为100%=50%,所以C项正确。(7)物质提纯的方法。苯甲酸中含有被氧化生成的硫酸钠和硫酸锰等盐类物质,可利用苯甲酸微溶于冷水、易溶于热水的性质通过重结晶的方法提纯。方法技巧酸碱中和滴定实验数据的处理。(1)根据题意写出酸碱中和反应的原理,建立酸与碱的定量关系。例如,C6H5COOH+KOHC6H5COOK+H2O,则有n(C6H5COOH)=n(KOH)。(2)分析实验数据确定每次滴定实验消耗标准溶液的体积,看是否存在明显错误的数据,若存在,舍去错误数据,根据其他实验数据求出消耗标准溶液的平均体积。(3)结合酸、碱的定量关系进行计算,计算物质的量浓度、产品的纯度(或产率)等。对
24、点演练现使用酸碱中和滴定法测定市售白醋的总酸量(每100 mL白醋中含有醋酸的质量单位为g/100 mL)。.实验步骤(1)配制待测白醋溶液,用(填仪器名称)量取10.00 mL食用白醋,在(填仪器名称)中用水稀释后转移到100 mL(填仪器名称)中定容,摇匀即得待测白醋溶液。(2)量取待测白醋溶液20.00 mL置于锥形瓶中,向其中滴加2滴酚酞作指示剂。(3)读取盛装0.100 0 molL-1 NaOH溶液的碱式滴定管的初始读数。(4)滴定。判断滴定终点的现象是,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3次。(5)如图是某次滴定时的滴定管中的液面,其读数为 mL。.实
25、验记录滴定次数1234V(样品)20.0020.0020.0020.00V(NaOH)(消耗)15.9515.0015.0514.95.数据处理与讨论(6)甲同学在处理数据时计算得:平均消耗NaOH溶液的体积V= mL=15.24 mL。指出他计算的不合理之处:。按正确数据处理,得出c(市售白醋)= molL-1,市售白醋总酸量= g/100 mL。易错提醒第(6)小题易忽视实验数据的分析,未判断是否存在明显错误数据,直接计算市售白醋的浓度及白醋的总酸量。考向2酸碱中和滴定的迁移应用真题示例2- 1.(2021浙江卷节选)某兴趣小组用铬铁矿Fe(CrO2)2制备K2Cr2O7晶体,流程如下:已
26、知:2H+2CrCr2+H2O。(1)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。下列关于滴定分析的操作,不正确的是。A.用量筒量取25.00 mL待测液转移至锥形瓶B.滴定时要适当控制滴定速率C.滴定时应一直观察滴定管中溶液体积的变化D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下(2)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测液
27、时少加了一种试剂。该试剂是,添加该试剂的理由是。2- 2.(2021湖南卷改编)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量。过程如下:步骤.Na2CO3的制备步骤.产品中NaHCO3含量测定称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;移取25.00 mL上述溶液置于锥形瓶,加入2滴指示剂M,用0.100 0 molL-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1;在上述锥形瓶中再加入2滴指示剂N,继续用0.100 0 molL-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2;
28、平行测定三次,V1平均值为22.45 mL,V2平均值为23.51 mL。已知:()当温度超过35 时,NH4HCO3开始分解。()相关盐在不同温度下的溶解度表温度/0102030405060NaCl35.735.836.036.336.637.037.3NH4HCO311.915.821.027.0NaHCO36.98.29.611.112.714.516.4NH4Cl29.433.337.241.445.850.455.2回答下列问题。(1)步骤中晶体A的化学式为,晶体A能够析出的原因是。(2)步骤中“300 加热”所选用的仪器是(填字母)。(3)指示剂N为,描述第二滴定终点前后颜色变化。
29、(4)产品中NaHCO3的质量分数为(保留到0.01%)。(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果(填“偏大”“偏小”或“无影响”)。方法技巧高考试题中常考的氧化还原滴定反应。(1)酸性KMnO4标准溶液滴定含H2C2O4、HC2、Fe2+等的溶液:2Mn+5H2C2O4+6H+2Mn2+10CO2+8H2O,2Mn+5HC2+11H+2Mn2+10CO2+8H2O,Mn+5Fe2+8H+Mn2+5Fe3+4H2O。(2)碘标准溶液滴定含S2、S2等的溶液:S2+2I2+3H2O2S+4I-+6H+,I2+2S2S4+2I-。对点演练2- 1.取未
30、知浓度的硫酸、盐酸和醋酸各25.00 mL,分别用0.10 molL-1的NaOH溶液或0.10 molL-1的氨水滴定得如图所示曲线。下列说法正确的是()。A.由图可知曲线c为NaOH溶液滴定硫酸B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度C.曲线b、c的滴定实验可用酚酞作指示剂D.由图可知滴定前醋酸电离百分比约为1.67%2- 2.某烧碱样品中含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:A.用250 mL的容量瓶配制250 mL的烧碱溶液;B.用碱式滴定管量取25.00 mL的烧碱溶液放入锥形瓶中并加几滴甲基橙作指示剂;C.在天平上准确称取烧碱样品x g,在烧杯中加
31、蒸馏水溶解;D.将物质的量浓度为y molL-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为a mL;E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度数为b mL。请回答下列问题。(1)正确的操作步骤顺序是(填写字母):D。(2)操作中锥形瓶下垫一张白纸的作用是。(3)操作D中液面应调整到;尖嘴部分应。(4)滴定到终点时锥形瓶内溶液的颜色变化是。(5)若酸式滴定管没用标准H2SO4溶液润洗,会对测定结果有何影响?(填“偏高”“偏低”或“无影响”,其他操作均正确)。(6)该烧碱样品的纯度计算式是。2- 3.(2021湖北联考)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-)
32、,实验过程包括准备标准溶液和滴定待测溶液。.准备标准溶液a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。b.配制并标定100 mL 0.100 0 molL-1 NH4SCN标准溶液,备用。.滴定的主要步骤a.取待测NaI溶液25.00 mL加入锥形瓶中。b.加入25.00 mL 0.100 0 molL-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。c.加入NH4Fe(SO4)2溶液作指示剂。d.用0.100 0 molL-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。e.重复上述操作两次。三次测定数据如下表:实验序号123消耗NH4SCN标准溶液体积/mL10.2410.029.98f.数据处理。回答下列问题。(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有。(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是。(3)滴定应在pHKsp。(3)曲线下方区域的点均为不饱和溶液,此时QKsp。【解法导引】 1.抓住“五个”关键点,破解酸碱中和滴定曲线题(1)抓住反应的“起点”,根据
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 云计算安全配置建议探讨与分享
- 中医护理肺胀病要点
- 2026年建筑设计创意及设计规范笔试模拟题
- 2026年公共关系危机管理与应对策略测试题
- 2026年注册会计师CPA会计信息系统应用与维护考试模拟题
- 2026年税务师税法实务方向专业笔试模拟卷
- 2026年公共关系管理企业形象塑造与传播问题集
- 2026年企业战略规划模拟测试题
- 2026年土木工程结构设计与施工管理习题集
- 2026年初级会计师实务与财经法规习题集
- 2026中国建材集团数字科技有限公司招聘23人参考考试试题及答案解析
- 高考冲刺历史预测必考热点十三 世界殖民体系的演进与亚非拉民族国家的崛起
- 2026衢州市柯城区机关事业单位编外招聘78人笔试参考题库及答案解析
- 2026年上海市初三语文一模试题汇编之古诗文阅读(学生版)
- 2025年聊城事业编考试作文真题及答案
- AI支持的幼儿园语言发展游戏化教学策略研究课题报告教学研究课题报告
- 旋挖桩试桩方案
- 产品认证常见问题及实操指南
- 2025至2030实验室能力验证行业调研及市场前景预测评估报告
- 藕种购销合同范本
- 纱窗生产合同范本

评论
0/150
提交评论